
Глава 6. Термодинамические характеристики многокомпонентных систем
6.1. Растворы. Основные понятия и определения
Любая многокомпонентная система может быть гомогенной (однофазной) или гетерогенной. Каждая фаза гетерогенной системы может состоять как из одного, так и из нескольких компонентов.
Раствором называют гомогенную систему, состоящую не менее чем из двух компонентов, содержание которых можно непрерывно изменять в определенных пределах. Другими словами, раствор – двух- или многокомпонентная фаза переменного состава.
По агрегатному состоянию растворы разделяют на газообразные (газовые смеси), жидкие и твердые. Компоненты раствора принято разделять на растворитель и растворенные вещества. Такое разделение условно, так как с термодинамической точки зрения все компоненты раствора равноправны. Обычно растворителем называют компонент, содержащийся в наибольшем количестве. Если же один из компонентов раствора – жидкость, а другие – газы или твердые вещества, то растворителем считают жидкость, не зависимо от ее количества.
Одними из основных параметров, определяющих состояние раствора, являются концентрации, т. е. относительные содержания компонентов в растворе. Поскольку содержание компонента в растворе можно выражать в различных единицах, то и состав раствора можно представлять различными способами. В физической химии наиболее употребительными являются следующие способы выражения состава растворов:
Мольная доля компонента xi – число молей данного компонента nі в одном моле раствора:
хі = nі / nі. (6.1)
Из уравнения (6.1) следует, что всегда хі = 1. Иногда используются также мольные проценты, т.е. число молей данного компонента в 100 молях раствора (100 хі).
Молярность – число молей компонента в единице объема раствора:
с = nі /V. (6.2)
Чаще всего в качестве единицы объема берется 1 дм3 (1 л) раствора.
Моляльность – число молей растворенного вещества в 1000 г растворителя:
m =1000nі /w = 1000nі /n1M1, (6.3)
где w – масса растворителя в г, n1 и M1 – число молей и молярная масса растворителя.
Иногда используют и другие способы выражения состава растворов – массовые доли и массовые проценты, объемные доли и проценты, мольные отношения и т.д.
Способность веществ растворяться друг в друге характеризуется растворимостью. Количественно растворимость определяется как содержание вещества в его насыщенном растворе. Насыщенным по отношению к данному веществу является раствор, в котором растворенное вещество находится в равновесии с его чистой фазой, что соответствует равенству химических потенциалов компонента в растворе и в индивидуальном состоянии (если твердое вещество образует кристаллосольваты – то в равновесии с кристаллосольватом). В зависимости от природы компонентов и внешних условий растворимость может меняться в очень широких пределах – от неограниченной растворимости, когда вещества образуют раствор при любых соотношениях, до практической нерастворимости друг в друге.
6.2. Парциальные мольные величины
Любое экстенсивное свойство раствора (объем, внутренняя энергия, теплоемкость и т.д.) зависит от его состава. Изменение какого-либо свойства зависит от количества добавляемого в раствор вещества. По изменению общего свойства раствора в целом (например, объема раствора) можно судить о значении данного свойства вещества в растворе заданного состава. Количество добавляемого вещества должно быть таким, чтобы состав раствора не изменялся. Это можно осуществить, добавляя 1 моль вещества к бесконечно большому количеству раствора или добавляя бесконечно малое количество вещества к конечному количеству раствора, а затем пересчитать полученное изменение свойства на 1 моль вещества.
Изменение экстенсивного свойства
раствора постоянного состава при
введение в него 1 моля компонента при
постоянных температуре и давлении
называется парциальной мольной
величиной этого компонента
![]() :
:
![]() =
=
![]() , (6.4)
, (6.4)
где Z – какое-либо экстенсивное
свойство раствора – U, Н, S,
V, ср
и другие; Z – соответствуещее
парциальное мольное свойство системы,
т.е.
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() и
т.д.
и
т.д.
В термодинамике многокомпонентных систем парциальные мольные величины играют ту же роль, что и мольные величины в термодинамике однокомпонентных систем. Рассмотрим, например, какие-либо свойства Z, y и x чистого вещества, связанные уравнением
у = Z/х. (6.5)
В соответствии с уравнением (6.4) получим для парциального мольного свойства:
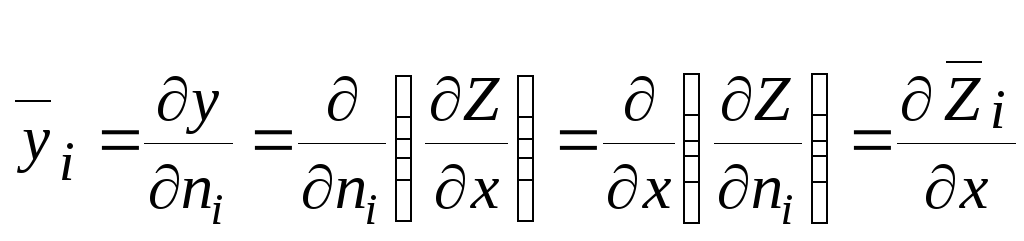 . (6.6)
. (6.6)
Например,
![]() ,
а
,
а
![]() ;
;
![]() ,
а
,
а
![]() .
.
Таким образом, для компонентов раствора справедливы те же соотношения, что и для чистых веществ, но только вместо мольных свойств необходимо использовать парциальные мольные свойства. При этом нужно обратить внимание на то, что парциальные мольные величины выражают изменения свойств, поэтому они могут иметь как положительные так и отрицательные значения в отличие от мольных величин.
Кроме того, нельзя отождествлять
парциальные мольные величины
![]() ,
,
![]() ,
,
![]() с химическими потенциалами і.
Последние представляют собой производные
от термодинамических потенциалов при
постоянстве их естественных переменных,
а парциальные мольные величины всегда
определяются при постоянных p и T.
Только парциальный мольный изобарный
потенциал
с химическими потенциалами і.
Последние представляют собой производные
от термодинамических потенциалов при
постоянстве их естественных переменных,
а парциальные мольные величины всегда
определяются при постоянных p и T.
Только парциальный мольный изобарный
потенциал
![]() является химическим потенциалом:
является химическим потенциалом:
і
=
![]() . (6.7)
. (6.7)
В случае бинарных растворов часто используются кажущиеся мольные величины. Обычно они определяются для растворенного вещества в предположении, что свойства растворителя при изменении состава раствора остаются неизменными:
![]() , (6.8)
, (6.8)
где
![]() и
n2 – кажущаяся мольная величина
и число молей растворенного вещества,
n1 и
и
n2 – кажущаяся мольная величина
и число молей растворенного вещества,
n1 и
![]() – число молей и мольное свойство
растворителя.
– число молей и мольное свойство
растворителя.
Связь между истинными значениями парциальных мольных величин и кажущимися мольными свойствами можно установить, исходя из уравнения (6.8):
Z
= n2z
+ n1![]() , (6.9)
, (6.9)
откуда
![]() .
(6.10)
.
(6.10)
