
лекції
.pdf41
3) Титрування замісника або заміщене титрування (непряме титрування ), коли до визначуваної речовини додають спецiальний реагент, який кiлькiсно взаємодiє з нею, а потiм один з продуктiв реакцiї вiдтитровують стандартним розчином. Прикладом може бути йодометричне визначення мiдi:
2Cu2+ |
+ |
4J– |
|
2CuJ |
+ |
J2; |
(V) |
||
|
|
|
надлиш. |
|
|
|
|
|
|
J2 |
+ |
2Na2S2O3 |
|
Na2S4O6 |
+ |
2NaJ. |
(VI) |
||
|
|
станд. р-н |
|
|
|
|
|
|
|
Таким же способом визначають кетони та альдегіди за реакцією їх оксимування |
|||||||||
солянокислим гідроксиламіном із звільненням еквівалентної кількості HCl: |
|
||||||||
(CH3)2С=О |
+ |
Н2NOH.HCl |
|
(CH3)2C=N–OH |
+ |
HCl, (VII) |
|||
|
|
надлишок |
|
ацетоноксим |
|
|
|||
|
HCl |
+ |
KOH |
|
KCl |
+ |
H2O, |
|
|
або визначення амонію за реакцією з метанальом: |
|
|
|
|
|||||
4NH4+ + |
6H2C=О |
|
(CH2)6N4 |
+ |
6H2O |
+ |
4H+, |
||
|
|
|
|
уротропін |
|
|
|
|
|
після чого відтитровують еквівалентну кількість йонів водню. |
|
|
|
||||||
4) У деяких випадках застосовують т.з. реверсивне титрування, при якому порцiю стандартного розчину, вiдiбрану пiпеткою, титрують аналiзованим розчином. Метод застосовують тодi, коли аналiзована речовина нестiйка на повiтрi (окислюється, поглинає СО2, Н2О і т.п.).
6.4. Метрологічні характеристики результатів аналізу.
Як і при будь-яких вимiрах, у результатах кiлькiсного аналiтичного визначення завжди мiститься деяка похибка. Оцiнка похибки результату є частиною аналiзу, а сама
похибка - його дуже важливою характеристикою. |
|
|
|
|
|
|
|
Похибкою вимірювання називають |
вiдхилення |
|
результату |
вимiрювання |
вiд |
||
iстинного значення вимiрюваної величини |
|
|
|
|
|
|
|
xi = xi |
– |
|
|
|
|
|
(6.2) |
де xi – абсолютна похибка вимiрювання; xi – результат аналiзу; |
– |
iстинний вмiст |
|||||
аналiзованого компонента в пробi. |
|
|
|
|
|
|
|
Похибка вимiрювання, яка при повторних вимiрах залишається постiйною або закономiрно змiнюється та має постiйний знак, називається систематичною похибкою. Похибка, яка при повторних вимiрах змiнюється випадковим чином та не має постiйного знаку називається випадковою похибкою вимiрювання.
Грубi похибки, що суттєво впливають на очiкуванi при даних умовах результати, називають промахами.
Виявляють систематичні похибки аналізом стандартних зразків. Випадкові похибки виявляють проведенням паралельних дослідів та обчислюють математичною обробкою результатів аналізу. Грубі похибки виявляють за допомогою Q-критерію та виключають при розрахунках результатів аналізу.

42
6.5. Правильнiсть, вiдтворюванiсть та точнiсть аналiзу.
Правильністю вимiрювань називають якiсть вимiрювань, що вiдбиває близькiсть до нуля систематичної похибки.
Відтворюваністю вимiрювань називають якiсть вимiрювань, що вiдбиває близькiсть один до одного результатiв вимiрювань, якi виконуються в рiзних умовах (в рiзний час, рiзними методами i т.п.).
Точністю вимiрювань називають якiсть вимiрювань, що вiдбиває близькiсть їх результатiв до iстинного значення вимiрюваної величини.
Висока точнiсть вимiрювань вiдповiдає малим похибкам всiх видiв, як систематичних, так i випадкових. Результат аналiзу, який наближається до iстинного вмiсту настiльки, що може використовуватися замiсть нього, назвають дійсним вмiстом.
6.6. Обробка результатів кількісного аналізу.
Теорiя похибок доказує, що якщо похибки пiдпорядковуються закону розподiлу Гауса (є справдi випадковими), то найбiльш ймовiрним та надiйним значенням вимiрюваної величини є математичне очікування або середнє арифметичне одержаних рiвноточних результатiв вимiрювання. Строго це положення вiдноситься до гiпотетичної генеральної сукупності, тобто сукупностi всiх мислимих при даних умовах спостережень. Середнє арифметичне цих спостережень називають генеральним середнім .
В аналiтичнiй хімiї число паралельних визначень переважно невелике (3-5) i сукупнiсть одержаних результатiв називають вибірковою сукупністью або випадковою вибіркою. Середнє значення результатiв випадкової вибiрки називають вибірковим середнім:
_ |
x1 x2 x3 xn |
|
xi |
|
|
|
x |
|
|
|
, |
(6.3) |
|
n |
n |
|||||
|
|
|
|
де x1, x2, x3, ..., xn - результати паралельних визначень компонента в пробi; n – число
_
паралельних визначень; x– середнє арифметичне результатiв вимiрювання.
_
Рiзницю мiж окремими результатами та середнiм значенням x називають
випадковим вiдхиленням:
|
|
|
|
_ |
|
|
|
|
|
di xi x. |
(6.4) |
||||
Вибіркове стандартне відхилення s окремого визначення розраховують за |
|||||||
формулою: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
_ |
|
|
|
|
|
di2 |
|
||||
s |
|
( xi x)2 |
(6.5) |
||||
|
|
. |
|||||
|
|
n 1 |
|
n 1 |
|
||
Квадрат стандартного вiдхилення s2 називають дисперсією вимiрювань. |
|
||||||
Якщо число спостережень |
дуже |
велике, то величина s прямує до |
деякого |
||||
постiйного значення , яке можна назвати статистичною межею s: |
|
||||||
|
|
lims. |
(6.6) |
||||
|
|
n |
|
||||
43
Строго кажучи, цю границю i слiд назвати стандартним вiдхиленням, а 2 – дисперсiєю вимiрювань.
В умовах аналiтичного визначення переважно знаходять середнє значення вибiрки
_
x, а не генеральне середнє та стандартне вiдхилення вибiрки s, а не .
Для оцiнки відтворюваності обчислюють дисперсію середнього значення вибiрки
|
|
_ |
_2 |
|
( xi x)2 |
sx |
(6.7) |
|
|
|
n (n 1) |
i стандартне відхилення середнього результату
|
|
|
|
|
( xi |
_ |
2 |
|
_ |
s |
|
|
x) |
|
|||
sx |
|
|
. |
(6.8) |
||||
|
|
|
|
|
||||
|
n |
|
|
|||||
|
|
|
|
n (n 1) |
|
|||
Практика вимiрювань показує, що великі за числовим значенням похибки спостерігаються рідше, нiж малі. Зауважимо також, що при великому числi
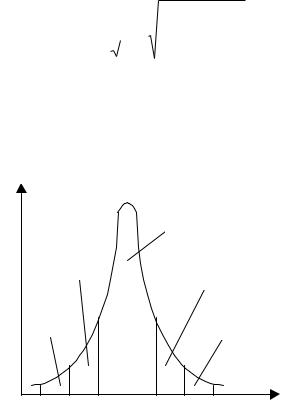
спостережень однакові похибки різного знаку зустрiчаються однаково часто. Сказане можна вiдобразити кривою нормального розподiлу (рис.3).
(х) – частота |
|
|
|
68.3% |
|
95% |
95% |
|
|
|
|
99.7% |
99.7% |
|
-3 -2 - |
+ +2 +3 |
х |
Рис.3. Крива нормального розподілу помилок.
Заштрихована площа пiд кривою в межах вiд – до + показує ймовірність p –
появи результату xi у вказаних межах значень: |
|
xi – k < xi < xi + k |
k = 1, 2, 3,... |
Цю величину ймовiрностi називають довірчою ймовірністю або статистичною надійністю, iнтервал вiд – k до + k – довірчим інтервалом, а межi iнтервалу –
довірчими межами. Таким чином, довiрча ймовiрнiсть одержати результат в межах вiд– до + складає 68.3 % (тобто 2/3 всiх результатiв вимiрювання), в межах 2 знаходиться 95 % всiх вимiрiв, а дiапазон 3 охоплює 99.7 %, тобто практично всi вимiри. Очевидно, ймовiрнiсть одержати результат аналiзу, який буде знаходитися поза межами iнтервалу k , буде рiвною

44
= 1 – p. |
(6.9) |
Величину називають рівнем значимості. |
|
Класична теорiя похибок, заснована на нормальному розподiлi, |
справджується |
тiльки при великому числi вимiрiв однiєї величини. При обмеженому числi спостережень (паралельних аналiзiв) великi похибки переважно не появляються, що приводить до заниження величини дисперсiї малої вибiрки i, вiдповiдно, занижуються величини, пов'язанi з дисперсiєю.
Ступiнь наближення дисперсiї вибiрки s2 до генеральної дисперсiї 2 визначається
числом ступенів свободи |
|
f = n – 1, |
(6.10) |
де n - число вимiрiв (паралельних визначень). |
|
Чим менше число ступенiв свободи f, |
тим менш надiйною характеристикою |
генеральної дисперсiї 2 є вибiркова дисперсiя s2. Ця ненадiйнiсть, що пов'язана з числом вимiрiв, враховується t-розподілом Стьюдента (Госсета), в якому передбачається бiльша ймовiрнiсть появи великих похибок, а малих – менша нiж у нормальному розподiлi. Крива t-розподiлу подiбна до кривої нормального розподiлу i спiвпадає з нею при f . Практично, ця рiзниця стає малопомiтною вже при f >20. При малих значеннях f рiзниця мiж нормальним та t-розподiлом досить суттєва, наприклад, для f = 3 i p = 95 % коефiцiєнт (критерій Стьюдента) t0.95;3 = 3.18 замiсть k = 2, як для нормального розподiлу.
З врахуванням вищезгаданого, ймовірну похибку середнього арифметичного
розраховують за формулою:
|
_ |
|
p tp;f |
sx , |
(6.11) |
де tp;f – критерiй Стьюдента (знаходять за спецiальними таблицями). |
|
|||
Вiдповiдно при |
заданiй довiрчiй ймовiрностi p довiрчий iнтервал результатiв |
|||
аналiзу буде складати |
|
|
|
|
|
_ |
|
|
|
|
x tp;f sx x s / |
n |
tp;f . |
(6.12) |
Дiйсний (iстинний) вмiст або генеральне середнє знаходиться в межах вiд x– p до x+ p з ймовiрнiстью p, тобто в довiрчих межах.
Як видно з рiвняння (6.12), чим бiльше число вимiрiв n, тим менший довiрчий iнтервал при заданiй довiрчiй ймовiрностi, тобто тим вища точність аналізу. Наприклад, для p = 95 % при n = 2 довiрчий iнтервал складе (12.71/ 2)s = 9s, при n = 3
це буде (4.30/ 3)s= 2.5s, при n=4 – (3.18/ 4)s= 1.6s i при n=5 – (2.78/ 5)s= 1.24s. Як бачимо, найбiльш ефективний вплив на довiрчий iнтервал справляє збiльшення числа паралельних визначень до 4–5, тому бiльше 4-х паралельних визначень роблять тiльки в спецiальних випадках, наприклад, в арбiтражних аналiзах.
Ймовірну відносну похибку середнього арифметичного (вiдносне вiдхилення)
обчислюють за формулою:
_ |
|
|
|
|
|
|
|
|
tp;f sx |
|
tp;f |
s |
|
||
p |
|
100% |
|
|
|
100% . |
(6.13) |
x |
x |
|
|
||||
|
|||||||
|
|
n |
|
||||
45
Приклад. За чотирма наважками тетраборату натрiю проводили стандартизацiю робочого розчину сульфатної кислоти, в результатi чого були одержанi такi результати:
C(1/2H2SO4)=0.2017, 0.2071, 0.2075 i 0.2068 моль/л. Знайти метрологiчнi характеристики стандартного розчину кислоти.
Розв'язок. Середню концентрацiю обчислюємо за формулою (6.3):
C_ 0.2017 0.2071 0.2075 0.2068 0.2058 М, 4
стандартне вiдхилення за формулою (6.5):
|
(0.2017 0.2058)2 |
(0.2071 0.2058)2 (0.2075 0.2058)2 |
(0.2068 0.2058)2 |
|
s |
|
|
|
0.0027 |
|
4 1 |
|
||
|
|
|
|
|
та стандартне вiдхилення середньої концентрацiї:
_ |
|
sC 0.0027 / |
4 0.00135. |
При довiрчiй ймовiрностi p = 0.95 i f = 4 – 1 = 3 з таблицi t-критерiїв Стьюдента вибираємо t0.95;3 = 3.18 i обчислюємо ймовiрну похибку середнього значення концентрацiї
0.95 = –0.00135 3.18 = 0.0043.
Таким чином, дiйсний вмiст H2SO4 у робочому розчинi в моль/л лежить в межах: 0.2058–0.0043 = 0.2015 < Cіст < 0.2101 = 0.2058+0.0043.
Ймовiрна вiдносна похибка складає:
0.95 = (0.0043/0.2058) 100% = 2.1%
6.7. Виявлення промахів.
Виявлення грубих помилок (промахiв) є достатньо делiкатним завданням, при виконаннi якого можна було б керуватися суб'єктивними оцiнками. Однак, i для такої процедури iснують строгi статистичнi критерiї. Для виявлення промахiв в ряду паралельних визначень при невеликому числi дослiдiв може бути використаний т.з. Q–
критерій:
Qp = (x1 – x2)/R, |
(6.14) |
де x1 – пiдозрiло велике (або мале) значення вимiру; x2 – сусiднє з ним за величиною значення вимiру; R = xmax – xmin – розмах варiювання (рiзниця мiж двома крайнiми за величиною значеннями вибiрки).
Розраховану за рiвнянням (6.14) величину Qp порiвнюють з табличним значенням
Q-критерiя при заданiй ймовiрностi p та числi ступенів свободи f. Якщо |
|
Qp > Qp;fT, |
(6.15) |
то пiдозрiлий результат є грубо помилковим i його треба виключити при розрахунках середнього арифметичного.
Приклад. У попередньому прикладi вiдносне вiдхилення складає 2.1 %, в той час як вiдносна похибка у визначеннi концентрацiї стандартного розчину не повинна перевищувати 1 %. Ще раз уважно переглянемо результати паралельних аналiзiв i побачимо, що серед них є рiзко вiдмiнне значення 0.2017 M. Перевiримо, чи можна його виключити як грубу помилку. Для цього розмiстимо концентрацiї у порядку зростання i розрахуємо Q-критерiй
46
Qp = (0.2068-0.2017)/(0.2075-0.2017) = 0.88.
З таблицi Q-критерiїв для p=0.95 i при f=4–1=3 вибираємо табличне значення
Q0.95;3Т=0.77. Так як
Qp = 0.88 > 0.77 = Q0.95;3Т,
то величину 0.2017 слiд вважати промахом i її не можна включати у розрахунки середньої концентрацiї. В такому випадку результати стандартизацiї будуть наступними:
_ |
|
|
0.2071 0.2075 0.2068 |
|
|
|
|
C |
|
|
0.2071 М; |
||||
|
|||||||
|
|
3 |
|
|
|
|
|
s |
02 0.00042 ( 0.0003) |
2 |
|
0.000354 ; |
|||
|
3 1 |
|
|
||||
|
|
|
|
|
|
||
_
sC 0.000354 / 
 3 0.000204; p 0.000204 4.3 0.000878.
3 0.000204; p 0.000204 4.3 0.000878.
Таким чином, дiйсний вмiст H2SO4 в розчинi (моль/л) знаходиться в межах: 0.2071–0.0009 = 0.2062 < C(1/2H2SO4) < 0.2080 = 0.2071+0.0009.
Тепер вiдносне вiдхилення у визначеннi стандартної концентрацiї робочого розчину складає
p = (0.000878/0.2071) 100% = 0.42%,
що цiлком задовільняє вимогу p < 1 %.
7. РОЗРАХУНКИ В ТИТРИМЕТРИЧНОМУ АНАЛIЗI. 7.1. Принцип еквівалентності.
Титриметричний аналiз заснований на принципi еквівалентності, у вiдповiдностi з яким речовини реагують мiж собою в еквівалентних кількостях.
Якщо визначувана речовина А реагує з розчином титранту В за стехiометричним рiвнянням
aA + bB Продукти реакцiї, (I) то еквiвалентними масами цих речовин будуть aM(A) та bM(B), де M(A) та M(B) –
молярнi маси речовин А i В, відповідно a i b – стехiометричнi коефiцiєнти. |
|
Рiвняння (I) можна записати у вигляді: |
|
A + (b/a)B Продукти реакцiї, |
(II) |
де переважно a > b i це означає, що одна частинка речовини А еквiвалентна b/a частинкам речовини В. Вiдношення b/a = fекв(В) називають фактором еквiвалентностi речовини В. Фактор еквiвалентностi є безрозмiрною величиною, рiвною або меншою від одиницi.
Величину М(fекв(B)В) називають еквівалентом або еквівалентною масою речовини В. Щоб уникнути будь-яких протирiч, всi реакцiї кислотно-основної взаємодiї слiд привести до єдиної спільної основи, якою може служити йон водню.
В окисно-вiдновних реакцiях кількості реагуючих речовин зручно пов'язати з числом електронів, що приймає або вiддає речовина в данiй пiвреакцiї. З наведеного випливає наступне визначення:
Еквівалентом називається деяка реальна або умовна частинка, яка може приєднувати, звільняти або бути яким-небудь іншим чином еквівалентна одному йону водню в кислотно-основних реакціях або одному електрону в окисно-відновних реакціях.
47
Пiд реальними частинками розумiють атоми, йони, молекули, електрони i т.д., а пiд умовними частинками – долi реальних частинок, наприклад: 1/5KMnO4, 1/2H2SO4, 1/3H3PO4, 1/2Pb i т.п.
При використаннi термiну “еквiвалент” або “фактор еквiвалентностi” завжди потрiбно вказувати, до якої конкретної реакцiї вiн вiдноситься. Наприклад, для реакцiї
2NaOH + H2SO4 = Na2SO4 + 2H2O
fекв(NaOH) = 1 та fекв(H2SO4) = 1/2, тому еквiвалентом H2SO4 в цiй реакцiї є
М(fекв(H2SO4)H2SO4) = М(1/2H2SO4); для реакцiї
KOH + H3PO4 = KH2PO4 + H2O fекв(H3PO4) = 1, звiдки М(fекв(H3PO4)H3PO4) = М(H3PO4), а для реакцiї
2KOH + H3PO4 = K2HPO4 + 2H2O fекв(H3PO4) = 1/2, тому М(fекв (H3PO4)H3PO4) = М(1/2H3PO4).
Важливою величиною для розрахункiв у титриметричному аналiзi є молярна маса еквівалента речовини, яка введена замiсть еквівалента речовини за старою термiнологiєю. Очевидно, позначення M(1/2H2SO4) означає молярну масу еквiвалента H2SO4, M(1/3H3PO4) – молярну масу еквiвалента H3PO4 i т.д.
Вiдношення кiлькостi речовини, вираженої в еквiвалентах, до об'єму розчину називають молярною концентрацією еквівалента
C( fекв ( A)A) |
n( fекв( A)A) |
|
|
|
. |
(7.1) |
|
|
|||
|
V |
|
|
Наприклад, C(1/2H 2 SO 4 ) = 0.1 моль/л означає, що в 1 л розчинено 0.1 моль або
0.1 М(1/2H2SO4) = 4.9039 г сульфатної кислоти.
Розчин, що мiстить 1 моль еквiвалентiв речовини А в 1 л, називають нормальним розчином i позначають буквою "н", наприклад, 1 н розчин H2SO4 означає, що розчин має C(1/2H2SO4) = 1 моль екв/л. Для розчинiв речовин, якi мають fекв = 1, вживають термiн "молярний" розчин замiсть "нормальний".
Для окисно-вiдновних реакцiй молярна маса еквiвалента речовини визначається масою частини моль, що еквiвалентна одному електрону в данiй реакцiї
5Na2C2O4 + KMnO4 + 8H2SO4 2MnSO4 + 10CO2 + 5Na2SO4 + K2SO4 + 8H2O.
З пiвреакцiй:
C2O42– – 2e– 2CO2;
MnO4– + 5e– + 8H+ Mn2+ + 4H2O;
видно, що при окисненнi молекула Na2C2O4 вiддає 2 електрони, тому f(Na2C2O4) = 1/2 i,
вiдповiдно, молярна маса еквiвалента M(f(Na2C2O4)Na2C2O4) = M(1/2 Na2C2O4) = 67.0000
г/моль. При вiдновленнi KMnO4 приєднується 5 електронiв, таким чином, fекв(KMnO4) = 1/5 i, вiдповiдно, M(fекв(KMnO4)KMnO4) = M(1/5KMnO4) = 31.6075 г/моль.
Молярну концентрацiю розчину, приготованого у мiрнiй колбi з точної наважки речовини А, розраховують за формулою:
C( fекв( A)A) |
m( A) |
, |
(7.2) |
|
M( fекв( А)А)V |
||||
|
|
|
де m(A) - наважка речовини А (г); M(fекв(A)A) – молярна маса еквiвалента речовини А (г/моль); V - місткiсть мiрної колби, л.

48
Дещо перетворену формулу (7.2) можна використати для iнших обчислень, наприклад, маси речовини А, потрiбної для приготування певного об'єму V(A) розчину
заданої концентрацiї C(fекв(A)A): |
|
m(A) = M(fекв(A)A) C(fекв(A)A) V(A). |
(7.3) |
Титр - один iз способiв вираження концентрацiї - число грамів розчиненої речовини в 1 мл розчину. Зв'язок мiж концентрацiєю речовини в моль/л i титром виражає формула:
TA = C(A) M(A)/1000, (г/мл). |
(7.4) |
Деколи вживають поняття титр стандартного розчину A за речовиною B: |
|
TA/B = C(A) M(B)/1000, (г В/мл р-ну А). |
(7.5) |
7.2. Розрахунок результатів прямого титрування.
При титруваннi з використанням реакцiї нейтралiзацiї, наприклад, NaOH + HCl H2O + NaCl
вточцi еквiвалентностi кiлькiсть кислоти n(HCl), витраченої на нейтралiзацiю, буде точно рiвна кiлькостi лугу n(NaOH) в аналізованому розчинi. Тодi єдиними продуктами
врозчинi будуть вода i сiль. Наведену вище умову можна виразити формулою:
n(HCl) = n(NaOH), |
(7.6) |
або
C(HCl)V(HCl)/1000 = C(NaOH) V(NaOH)/1000.
Звідси
C(HCl) V(HCl) = C(NaOH) V(NaOH), |
(7.7) |
а концентрацiя лугу
C(NaOH) = C(HCl)V(HCl)/V(NaOH).
Масу лугу m(NaOH) можна обчислити як
m(NaOH) = n(NaOH) M(NaOH) = M(NaOH) C(HCl) V(HCl)/1000, (7.8)
де M(NaOH) - молярна маса еквiвалента NaOH.
Крiм кислот та основ, методом прямого титрування можна визначати також вмiст солей, утворених анiонами слабких кислот та катiонами сильних основ, i навпаки. Наприклад, можна визначити вмiст карбонату натрію в розчинi, титруючи його стандартним розчином сильної кислоти:
Na2CO3 + 2HCl 2NaCl + H2CO3.
Тоді
m(Na2CO3) = С(HCl) V(HCl) M(1/2Na2CO3), |
(7.9) |
де C(HCl) – концентрацiя стандартного розчину хлоридної кислоти, моль/л; V(HCl) – об'єм цього розчину, що витратили на титрування, мл; M(1/2Na2CO3) = 52.99 г/моль – молярна маса еквiвалента карбонату натрію (соди); m(Na2CO3) – маса соди, мг.
Якщо вiдносна похибка при стандартизацiї розчину кислоти складає С = 1.5 %, похибка вимiрювання об'єму V = 0.1/V(HCl) 100% та похибка обчислення молярної маси еквiваленту M = 0.0018 %, то вiдносну похибку при визначеннi маси речовини можна знайти за формулою:
sm / m 
 C2 V2 M2 . (7.10) При C(HCl) = 0.2005 моль/л, V(HCl) = 23.6 мл
C2 V2 M2 . (7.10) При C(HCl) = 0.2005 моль/л, V(HCl) = 23.6 мл

49
m(Na2CO3) = 0.2005 23.6 52.99 = 250.74 мг Вiдповiдно, вiдносна похибка вимiрювання об'єму складе
V = 0.1/23.6 100% = 0.42% i вiдносна похибка при визначеннi маси
m sm / m 100% 
 1.52 0.482 0.00182 1.56%.
1.52 0.482 0.00182 1.56%.
При масi соди в пробi 250.74 мг абсолютна похибка складе sm = 250.74 1.56/100 = 3.91 мг.
Тодi кiнцевий результат аналiзу можна записати, як m(Na2CO3) = 251 4 мг,
тобто, при даних умовах зробити аналiз точнiше, нiж з відхиленнями до 4 мг, неможливо.
7.3. Розрахунок результату в методах зворотнього титрування.
Розглянемо методику розрахунку результатiв на прикладi зворотнього титрування хлориду: значний надлишок основного стандартного розчину AgNO3 доливають до проби, що мiстить йони Cl–, i потiм його залишок вiдтитровують допомiжним розчином
NH4SCN. Поскiльки AgNO3 витрачається на реакцiю з хлоридом та роданідом, то |
|
n(AgNO3) = n(AgCl) + n(AgSCN). |
(7.11) |
При вiдомому об'ємi основного стандартного розчину |
|
n(AgNO3) = C(AgNO3)V(AgNO3)/1000. |
(7.12) |
Молярна концентрацiя еквiвалента допомiжного розчину NH4SCN та його об'єм, затрачений на реакцiю із залишком AgNO3 пiсля осадження AgCl, також точно вiдомi,
тому: |
|
n(AgSCN) = C(NH4SCN) V(NH4SCN)/1000. |
(7.13) |
Кiлькiсть еквiвалентiв хлориду в аналiзованому розчинi рiвна |
кiлькостi |
еквiвалентiв AgCl, що випав в осад, тому з рiвняння (7.11), використовуючи вирази
(7.12) i (7.13), знаходимо
n(Cl–) = n(AgCl) = C(AgNO3)V(AgNO3)/1000 – C(NH4SCN) V(NH4SCN)/1000. (7.14)
Вiдповiдно, масу хлорид-iонiв обчислюють, як
m(Cl–)=n(AgCl) M(Cl)=[С(AgNO3) V(AgNO3)–C(NH4SCN)V(NH4SCN)] M(Cl), (7.15)
де M(Cl)=35.453 – молярна маса еквiвалента хлору, г/моль; m(Cl–) – маса хлорид-іонів, мг.
Можна обчислити похибку методу, користуючись правилами, що абсолютна похибка суми або рiзницi декiлькох величин рiвна:
sx,y,z2= sx2 + sy2 + sz2. (7.16)
Приклад. При визначеннi хлорид-iона користувалися стандартним розчином
AgNO3 з C(AgNO3)=0.2000 0.0002 моль/л, якого долили до проби V(AgNO3)=25 0.05 мл.
Згодом вiдтитрували надлишок цього розчину допомiжним титрантом з
C(NH4SCN)=0.1000 0.0005 моль/л, якого витрачено V(NH4SCN)=18.5 0.1 мл. Молярна маса еквiвалента хлору вiдома з точнiстю M(Cl)=35.4527 0.0009 г/моль. Обчислити масу хлорид-iона в пробi.
Розв'язок. Масу хлорид-iона обчислимо за формулою (7.15): m(Cl–) = (0.2 25 – 0.1 18.5) 35.4527 = 111.676 мг.

|
|
|
|
|
|
|
|
|
50 |
|
|
|
|
|
|
|
|||
Похибка першого добутку: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
s |
|
|
0.0002 2 |
0.05 2 |
2.236 10 3, |
||||||||||||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
0.2 25 |
|
|
|
|
|||||||||||||
|
|
|
|
|
0.2 |
25 |
|
|
|
||||||||||
похибка другого добутку: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
s |
2 |
|
|
|
|
0.0005 2 |
|
0.10 |
2 |
7.363 10 3, |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
0.1 18.5 |
|
|
0.1 |
18.5 |
|
|
|
|||||||||||
квадрат похибки рiзницi:
s32 = (2.236 10–3 0.2 25)2 + (7.363 10–3 0.1 18.5)2 = 3.105 10–4.
Тодi вiдносна похибка в обчисленнi маси складає
sm |
|
3.105 10 4 |
0.0009 |
2 |
5.594 10 |
3 |
, |
|
|
|
|
|
|
|
|
||
m |
0.2 25 0.1 18.5 2 |
35.4527 |
|
|||||
|
|
|
|
|
|
|||
а абсолютна похибка дорівнює
sm = 111.676 5.594 10–3 = 0.625 мг.
Таким чином, кiнцевий результат обчислення слiд записати m(Cl–) = 111.7 0.6 мг.
7.4. Розрахунок результатів титрування замісника (непрямого титрування).
Поскiльки в способi титрування замiсника вiдтитровується продукт взаємодiї первинної реакцiї (промiжний продукт), то його можна виключити з розрахункiв шляхом алгебраїчного додавання стехiометричних рiвнянь. Наприклад,
2Cu2+ + 4J– 2CuJ + J2;
J2 + 2Na2S2O3 Na2S4O6 + 2Na+ + 2J–;
___________________________________________
2Cu2+ + 2J– + 2Na2S2O3 2CuJ + Na2S4O6 + 2Na+.
З йонно-електронної форми сумарного рiвняння
Cu2+ + J– + e– CuJ |
2 |
2S2O32– – 2e– S4O62– |
1 |
__________________________________
2Cu2+ + 2J– + 2S2O32– 2CuJ + S4O62–
видно, що в цiй реакцiї молярна еквiвалентна маса мiдi M(Cu)= 63.546 г/моль, а молярна еквiвалентна маса тiосульфату натрiю також рiвна молекулярнiй масi M(Na2S2O3)=158.11 г/моль, так як від 2-х йонів S2O32– віднімають 2 електрони. Виходячи з стехiометричного рiвняння, можна записати
n(Cu) = n(J2 ) = n(Na2S2O3) = C(Na2S2O3)V(Na2S2O3)/1000. (7.17)
Таким чином, подальшi розрахунки нiчим не відрізняються вiд розрахункiв результату прямого титрування.
8.МЕТОДИ КИСЛОТНО-ОСНОВНОГО ТИТРУВАННЯ (ПРОТОЛІТОМЕТРІЯ)
8.1.Загальна характеристика методу кислотно-основного титрування.
Стандартні розчини.
Кислотно-основний метод (протолітометрія) оснований на реакціях взаємодії між протолітами - кислотами і основами, які у загальному вигляді можна записати як
