
лекції
.pdf61
Якщо реакцiя протiкає в кислому середовищi, то в ній приймають участь йони H+, які потрібно включати в рiвняння, якщо ж в лужному – OH––йони, в нейтральних середовищах можуть приймати участь молекули води.
Приклади: 1) Скласти рівняння реакції взаємодії Fe2+ з MnO4– в кислому середовищi з утворенням Fe3+ та Mn2+. Рiвняння пiвреакцiй запишемо наступним чином:
Fe2+ – 1e– Fe3+ |
5; |
|
|
MnO4–+ 8H+ + 5e– Mn2+ + 4H2O 1; |
|
|
|
_____________________________________ |
|
||
5Fe2+ + MnO4– + 8H+ Mn2+ + Fe3+ + 4H2O. |
(III) |
||
2) Скласти рівняння реакції взаємодії Cr3+ з Br2 в лужному середовищi з |
|||
утворенням CrO42– та 2Br–. Рівняння півреакцій матимуть вигляд: |
|
||
Cr3+ + 8OH–– 3e– |
CrO42– + 4H2O |
2; |
|
Br2 + 2e– 2Br– |
|
3; |
|
_________________________________________ |
|
||
2Cr3+ + 3Br2 + 16OH– 2CrO42– + 6Br– + 8H2O. |
(IV) |
||
3) Скласти рівняння реакції взаємодії MnO4– з Cr3+ в нейтральному середовищi з |
|||
утворенням MnO(OH)2 та Cr2O72–. Рівняння півреакцій матимуть вигляд: |
|
||
MnO4–+ 4H+ + 3e– MnO(OH)2 + H2O 2; |
|
||
2Cr3+ + 7H2O– 6e– |
Cr2O72– + 14H+ |
1; |
|
____________________________________________________________ |
|
||
2MnO4– + 2Cr3+ + 7H2O + 8H+ 2MnO(OH)2 + Cr2O72– + 2H2O + 14H+. |
|
||
Після скорочення в лівій та правій частині одержимо остаточне рівняння: |
|
||
2MnO4– + 2Cr3+ + 5H2O 2MnO(OH)2 + Cr2O72– + 6H+. |
(V) |
||
9.2. Окисно-відновні потенціали.
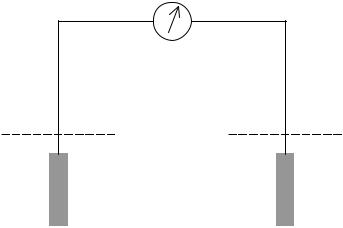
Роздiлення окисно-вiдновної реакцiї на двi пiвреакцiї – не лише формальний спосіб, що полегшує тлумачення процесу передачi електронiв або пiдбiр стехiометричних коефiцiєнтiв, воно має цiлком визначений фiзичний змiст. Розчиненi компоненти кожної напiвреакцiї (II) можна помiстити в рiзнi посудини (рис. 6) та з'єднати їх солевим містком (розчин KCl). Якщо в кожну посудину занурити інертнi (нерозчиннi) електроди, наприклад, вугiльнi або платиновi, i замкнути коло на гальванометр (Г), то прилад покаже наявнiсть струму. В посудинах на поверхнi електродiв почнуться реакцiї передачi електронiв: вiд відновника (наприклад, Fe2+) до електроду i вiд електроду до окисника (наприклад, Ce4+), що викличе потiк електронiв у зовнiшньому колi (через гальванометр) та через солевий мiсток. Пристрiй зображений на рис. 6 називають гальванічним елементом, а кожну з посудин, що мiстить розчин із зануреним електродом, – півелементом.
Внаслiдок протiкання реакцiї в гальванiчному елементi хімiчна енергiя перетворюється в електричну. Електрорушiйну силу (ЕРС) гальванiчного елемента вимiрюють компенсаційним методом за допомогою потецiометра, де вимiрювана ЕРС врівноважується відомою різницею потенціалів, що створюється допоміжним джерелом струму. Тоді при вимiрах в колi елемента протiкає дуже малий струм, тобто І 0.
62
Г
е–
– |
+ |
розчин KCl
|
Pt |
|
|
|
|
|
|
|
|
|
Pt |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Fe2+ – e– Fe3+ Ce4+ + e– Ce3+
Рис. 6. Схема гальванічного елемента.
ЕРС гальванічного елемента безпосередньо характеризує здатнiсть електронiв
вiдновника, наприклад, Fe2+ переходити до даного окисника (Ce4+) i є рiзницею: |
|
E = oк – відн, |
(9.1) |
де E – ЕРС гальванічного елемента, В; oк – потенцiал окисника, В; відн – потенцiал вiдновника, В.
Кожен пiвелемент складається з окисненої та відновленої форм даної речовини, яку називають окисно-відновною, або редокс-парою, наприклад, Fe3+/Fe2+, 2H+/H2, MnO4–
/Mn2+, Cr2O72–/2Cr3+ i т.д. Потенціал окисно-відновної пари позначають як (Fe3+/Fe2+),
(MnO4–/Mn2+), (2H+/H2) і т.д., а стандартні електродні потенціали позначують верхнiм iндексом (о), наприклад, o(Fe3+/Fe2+), o(MnO4–/Mn2+) i т.д..
Потенцiал електрода встановлюється по вiдношенню до розчину, а тому вимiряти
абсолютне значення потенцiалу окремої редокс-пари є неможливо. Однак, можна
вимiряти різницю потенціалів E двох електродiв у гальванiчному елементi. Якщо кожен електрод комбiнувати з одним i тим же електродом, умовно вибраним за стандартний, то одержимо вiдноснi окисно-вiдновнi потенцiали пар.
Можна створити стандартні умови для будь-якої окисно-вiдновної пари. Такi стандартнi умови є тодi, коли активності всiх реагентiв та продуктiв реакцiї рiвнi 1моль/л при t=25 oC і р=1.013 105 Па.
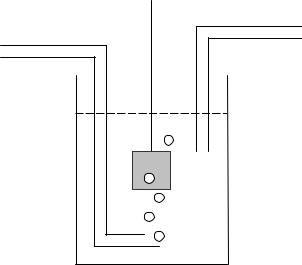
У ролі стандартного вибраний водневий електрод (рис. 7). Це електрод з платинованої пластини, який насичується газоподiбним воднем при стандартних умовах і занурений в розчин кислоти. Пластина, покрита черненою платиною, насичується воднем i дiє так, ніби електрод складається з газоподiбного водню, що знаходиться в
рiвновазi з йонами H+ в розчинi: |
|
H2(г) 2H+ + 2e–. |
(VI) |
63
солевий е– місток
Н2 (газ)
Pt
Рис. 7. Схема водневого електрода.
Потенцiал стандартного водневого електрода o(2H+/H2) умовно приймають рівним нулю при будь-якій температурі . Таким чином, потенцiал електрода, що знаходиться в парi з водневим, – це напруга гальванiчного елемента, складеного з даного та
стандартного водневого електродів, наприклад: |
|
Е = (Fe3+/Fe2+) – (2H+/H2), а при o(2H+/H2) = 0 |
|
Е = o(Fe3+/Fe2+). |
(9.2) |
Потенцiал окисно-вiдновної системи вважають додатним, коли система виступає окисником по вiдношенню до стандартного водневого електрода, або від’ємним, коли система виступає вiдновником по вiдношенню до цього електрода.
Величини стандартних окисно-вiдновних потенцiалiв ( o) деяких редокс-пар при 25 oC наведенi в таблиц 7:
|
|
|
Таблиця 7 |
Стандартні окисно–вадновні потенціали деяких окисно–відновних пар |
|||
Окислена форма |
Кiлькість електронів |
Вiдновлена форма |
o, В |
H2O2 + 2H+ |
2 |
2H2O |
+1.77 |
MnO4–+ 8H+ |
5 |
Mn2+ + 4H2 O |
+1.51 |
Ce4+ |
1 |
Ce3+ |
+1.44 |
Cl2 (г) |
2 |
2Cl- |
+1.359 |
Cr2O72- + 14H+ |
6 |
2Cr3+ + 7H2O |
+1.33 |
Cu2+ + J- |
1 |
CuJ |
+0.86 |
Fe3+ |
1 |
Fe2+ |
+0.771 |
O2 + 2H+ |
2 |
H2O2 |
+0.682 |
J2 |
2 |
2J- |
+0.536 |
Cu2+ |
1 |
Cu+ |
+0.153 |
S4O62- |
2 |
2S2O32- |
+0.09 |
2H+ |
2 |
H2 |
0.0000 |
2CO2(г) + 2H+ |
2 |
H2C2O4 |
-0.49 |
SO42- + H2O |
2 |
SO32- + 2OH- |
-0.93 |

64
Окисником в окисно-вiдновнiй реакцiї при стандартних умовах може бути лише та окиснена форма, стандартний потенцiал якої бiльший, нiж в окисненої форми вiдновника. Наприклад, MnO4– + 8H+ буде окиснювати йони Cl– до Cl2, однак Cl2 не зможе окиснювати Mn2+ до MnO4–, так як
o(MnO4–/Mn2+) = 1.51 > 1.359 = o(Cl2/2Cl–),
тобто реакцiя
2MnO4– + 10Cl– + 16H+ 2Mn2+ + 5Cl2 + 8H2O
повинна протiкати тiльки у вказаному стрiлкою напрямi. Окиснюватися може лише відновлена форма редокс-пари.
В результатi протiкання реакцiй зменшується т.з. вільна енергія системи (енергія Гіббса G). У гальванiчному елементi при стандартних умовах зменшення вiльної енергiї
G рiвне роботi по перенесенню заряду в електричному полi, тобто |
|
– G = nF o, |
(9.3) |
де n – число електронiв, що приймають участь в процесi; F = 96485 Кл/моль – число Фарадея.
Якщо ж одним з електродiв служить стандартний водневий електрод, то |
|
(Ок/Відн) = o(Ок/Відн) – o (2H+/H2) = o(Ок/Відн) |
|
i, вiдповiдно, |
|
o(Ок / Відн) Go . |
(9.4) |
nF |
|
9.3. Рівняння Нернста.
Якщо компоненти окисно-вiдновної пари не перебувають в стандартному станi, то змiна вiльної енергiї i величина окисно-вiдновного потенцiалу системи будуть залежати вiд активностi даної пари. Так, для реакцiї
Ок. + ne– Вiдн. (VII)
змiна вiльної енергiї системи описується рiвнянням
G Go |
RT ln |
aок |
, |
(9.5) |
|
||||
|
|
авідн |
|
|
де R=8.31441 Дж/(моль К) – унiверсальна газова постiйна; Т – абсолютна температура, К; аок, авідн– активностi окисненої та вiдновленої форм речовини. Якщо поділити праву i лiву частини рiвняння (9.5) на (–nF), то одержимо:
|
G |
Go |
RT |
aок |
. |
(9.6) |
|||
|
|
|
|
|
|
ln |
|
||
|
|
|
авідн |
||||||
|
nF |
nF |
nF |
|
|
||||
Згідно рівності (9.4) рівняння (9.6) можна переписати у вигляді: |
|
||||||||
(Ок / Відн) о(Ок / Відн) |
RT |
ln |
аок |
. |
(9.7) |
|
|
||||
|
nF |
авідн |
|
||
При температурі t = 25 оC (T = 298.16 K) та при переходi до десяткового логарифму ln(10)RT 2.303 8.31441 298.15 .
F 96485
Тому рiвняння (9.7) переважно записують у виглядi:

65
(Ок / Відн) о(Ок / Відн) |
0.059 |
lg |
аок |
. |
(9.8) |
|
|
||||
|
n |
авідн |
|
||
Цей вираз носить назву рівняння Нернста.
Якщо в окисно-вiдновнiй реакцiї приймають участь йони H+, OH– або будь-якi iншi частинки, то їх активностi у вiдповiдних ступенях також слiд включати в рiвняння
Нернста. Так, для стехiометричного рiвняння |
|
|
|
|
|
|
|
|
aОк + mH+ + ne– bВiдн + m/2H2O |
|
|
(VIII) |
|||||
ок / відн око / відн |
0.059 |
lg |
(аок )а(а |
Н |
|
)m |
|
|
|
|
|
|
. |
(9.9) |
|||
n |
(aвідн )b |
|
||||||
|
|
|
|
|
||||
У водних розчинах a(H2O) = const, тому її активність, як i активність твердих осадів, приймають рівною одиниці та в рiвняння Нернста не включають.
Переходячи вiд активностей до рiвноважних концентрацiй частинок в розчинi
aок = ок[Ок]; aвідн = відн[Відн] |
(9.10) |
у (9.8) одержимо: |
|
о |
0.059 |
lg |
ок |
|
0.059 |
lg |
[Ок] |
|
|
|
ок / відн ок / відн |
|
|
|
|
|
. |
(9.11) |
|||
n |
відн |
п |
[Відн] |
|||||||
|
|
|
|
|
|
*ок/відн = const
Постійну величину *ок/відн (в розчинi зі сталою йонною силою) називають формальним потенціалом. Формальний потенцiал характеризує систему, в якiй
концентрації (а не активностi) всіх учасників реакції рівні 1 моль/л.
Таким чином, формальний потенцiал залежить вiд коефiцiєнтiв активностi , тобто йонної сили розчину. Для розбавлених розчинiв їх йонною силою нехтують i часто
формальний потенцiал прирівнюють до стандартного.
Потенцiал окисно-вiдновної пари, обчислений за рiвнянням Нернста для будь-яких концентрацiй, називають рівноважним потенціалом.
Величина окисно-вiдновного потенцiалу залежить вiд природи речовини ( oок/відн), йонної сили розчину ( фок/відн), концентрацiї окисненої [Ок] та вiдновленої [Вiдн] форм речовини, рН середовища та температури.
9.4. Вплив кислотно-основного середовища, комплексоутворення та утворення малорозчинних сполук на величину редокс-потенціалу.
Про вплив концентрації йонів H+, OH– та інших, що входять в рiвняння напiвреакцiй, на редокс-потенцiал вказує пiдлогарифмiчний вираз рiвняння Нернста. Змiнюючи рН розчину, можна настiльки впливати на потенцiал редокс-пари, що реакцiя стане протiкати у зворотньому напрямку. Наприклад, реакцiя
HAsO42– + 2J– + 3H+ AsO2– + J2 + 2H2O, (IX)
судячи з величин стандартних потенцiалiв
o(HAsO42–/AsO2–) = +0.56 В > +0.54 В = o(J2/2J–),
протiкає злiва направо в сильнокислому ([H+] = 1 моль/л; рН = 0) середовищi. Однак, в розчинi NaHCO3, де рH 8, концентрацiя йонiв водню зменшиться до [H+] = 1 10–8 моль/л, що знизить потенцiал редокс-пари

|
|
66 |
|
|
HAsO42– + 3H+ + 2e– AsO2– + 2H2O |
||||
до ( HAsO42 / AsO2 ) 0.56 |
0.059 |
lg |
1 (1 10 8 )3 |
0.148 В. |
|
|
|||
2 |
1 |
|
||
Потенцiал редокс-пари J2 /2J– залишиться при цьому незмiнним i, так як
(HAsO42–/AsO2–) = –0.148 B < 0.54 B = o(J2/2J–),
то реакцiя (IX) буде протiкати справа налiво, тобто J2 буде окиснювати AsO2– до HAsO42– Кислотнiсть розчину впливає на форми існування йонiв, послаблюючи або посилюючи гiдролiтичнi процеси або iншi рiвноваги в розчинi. Наприклад, потенцiал системи Fe3+/Fe2+ при збiльшеннi рН зростає, так як йони H+ пригнiчують дисоцiацiю
аква-йону залiза
К
Fe(H2O)63+ Fe(H2O)5OH2+ + H+ i збiльшують його рiвноважну концентрацiю
|
|
|
|
|
|
|
|
|
|
[Fe( H |
2 |
O) OH |
2 ] |
|
|
|
|
||||||
|
|
|
[Fe( H |
2 |
O)3 |
] |
|
|
|
|
5 |
|
|
[H ], |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
K |
|
|
|
|
|
|
|
||
звiдки |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
2 |
|
o |
|
|
3 |
|
|
2 |
0.059 |
|
[Fe( H |
2 |
O) OH 2 |
] |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|||||||
( Fe |
|
/ Fe |
|
) |
|
(Fe |
|
/ Fe |
|
) |
|
|
|
lg |
|
|
|
|
|
|
[H ] . |
||
|
|
|
|
|
|
|
3 |
|
|
|
|
K |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Система Fe3+ + e– Fe2+ змiнює свiй редокс-потенцiал завдяки рiзнiй здатностi йонiв Fe3+ та Fe2+ до комплексоутворення. Бiльш стiйкi комплекснi сполуки утворює йон Fe3+. У присутностi речовин, здатних утворювати з цим йоном комплекснi сполуки, потенцiал пари Fe3+/Fe2+ понижується, наприклад, в розчинах: HCl до 0.53 В, H3PO4 до
0.41 В, EДТА до 0.12 В, NaF до –0.14 В, тоді як в чистiй водi вiн рiвний +0.771 B.
Суттєвий вплив на потенцiал та напрямок реакцiй в редокс-системах має утворення малорозчинних сполук. Типовим прикладом є реакцiя взаємодiї йонiв Cu2+ з J–, яка використовується для кiлькiсного аналiзу на вмiст мiдi:
2Cu2+ + 4I– 2CuI + I2.
Порiвняння стандартних потенцiалiв o(Cu2+/Cu+) = 0.159 B та o(J2/2J–) = 0.536 B показує, що йони Cu2+ не можуть окиснювати J– в розчинi. Однак, Cu+ та J– утворюють малорозчинну сполуку CuJ, що приводить до рiзкого зниження концентрацiї йонiв Cu+ (добуток розчинностi ДР(CuJ) = 1.1 10–12). Концентрацiю цих йонiв можна визначити як
[Cu+] = ДР(CuJ)/[J–].
Якщо пiдставити цю величину в рiвняння Нернста:
(Cu2 / Cu ) o(Cu2 / Cu ) 0.059lg |
[Cu2 ] |
, |
||||
|
||||||
|
|
[Cu ] |
|
|||
то одержимо |
|
|
|
|
|
|
(Cu2 / Cu ) o(Cu2 / Cu ) 0.059lg |
[Cu2 ] |
|
|
|||
ДР(CuJ ) |
||||||
|
|
|||||
o(Cu2 / Cu ) 0.059lg ДР(СuJ ) 0.059lg[Cu2 ][ J ].
o(Cu2+/CuJ) = const
67
o(Cu2+/CuJ) = 0.159 – 0.059lg(1.1 10–12) = 0.159 + 0.706 = 0.865 В.
Таким чином, стандартний потенцiал пари Cu2+/CuJ є набагато бiльшим від стандартного потенцалу пари J2 /2J– (0.536 B), тому йони Cu2+ легко окиснюють йони J–.
9.5. Окисно-відновні властивості води.
Так як багато окисно-відновних реакцій протікають у водних розчинах, то важливо знати межі стійкості різних окисників та відновників у таких розчинах. Окисна здатність води визначається потенціалом водневого електрода у чистій воді, де a(H+) = 1 10–7
моль/л і p(H2) = 1.013 105 Па, тому
2H+ + 2e– H2,
(2H+/H2) = (0.059/2)lg(1 10–7)2 = –0.413 В.
Таким чином, відновники, що мають o(Відн) < –0.413 В, можуть розкладати воду з виділенням водню.
Вода може проявляти також відновні властивості: 2H2O 4H+ + O2 + 4e–.
Стандартний окисно-відновний потенціал пари o(O2/2H2O) = 1.23 В, тому в чистій
воді
o(O2/2H2O) = 1.23 + (0.059/4)lg(1 10–7)4 = 0.82 В.
Таким чином, окисники, що мають o(Ок) > 0.82 В, можуть окиснювати воду з виділенням кисню.
Редокс-системи, окисно-відновні потенціали яких є за межами вказаних величин
–0.413 В > oок/відн > +0.82 B,
можуть розкладати воду, хоч вони часто на протязі тривалого часу залишаються у воді без змін у зв'язку з малою швидкістю реакції або іншими причинами.
9.6. Константи рівноваги окисно-відновних реакцій.
Напрям протiкання окисно-вiдновних реакцiй можна встановити за величинами стандартних окисно-вiдновних потенцiалів пар. Однак, для розрахунку повноти протiкання реакцiї потрiбно користуватися значеннями констант рiвноваги. Для будьякої окисно-вiдновної реакцiї
aОк1 + bВiдн2 aВiдн1 + bОк2 стан рiвноваги описується виразом
|
|
|
[Відн ]a [Ок |
2 |
]b |
||
K |
C |
|
1 |
|
|
, |
|
[Ок ]a |
[Відн |
|
|
||||
|
|
2 |
]b |
||||
|
|
|
1 |
|
|
|
|
де KC – концентраційна константа рівноваги.
Якщо представити цю реакцiю у виглядi двох пiвреакцiй потенцiали
(X)
(9.12)
та визначити їх
a Ок1 + be– Вiдн1 |
1 |
= o1 |
+ (0.059/b)lg[Ок1]/[Відн1] |
(9.13) |
–b Ок2 + ae– Вiдн2 |
2 |
= o2 |
+ (0.059/a)lg[Ок2]/[Відн2] |
(9.14) |
___________________________
aОк1 + bВiдн2 aВiдн1 + bОк2,
то в стані рiвноваги, 1 = 2. Прирiвнюючи (9.13) та (9.14), одержимо:
68
o |
|
0.059 |
lg |
[Ок1 ] |
|
o |
|
0.059 |
lg |
|
[Ок2 ] |
, |
|||||||||||||||
|
b |
[Відн ] |
|
|
|
|
|
|
|||||||||||||||||||
1 |
|
|
|
2 |
|
|
|
|
|
a |
[Відн |
2 |
] |
|
|||||||||||||
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
o |
|
|
o |
0.059 |
|
|
[Ок |
2 |
] |
|
|
|
|
|
|
[Ок ] |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
||||||
|
ab |
|
|
|
|
|
|
] alg [Відн ] |
|||||||||||||||||||
1 |
2 |
blg |
[Відн |
2 |
. |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|||||
Звiдcи |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
( o |
o |
)ab |
|
|
[Відн ]a [Ок |
2 |
]b |
|
|
|
||||||||||||||
|
|
1 |
2 |
|
lg |
|
|
|
1 |
|
|
|
|
|
|
. |
|
(9.15) |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
0.059 |
|
|
|
|
|
[Ок1 ]a [Відн2 ]b |
|
|
|
||||||||||||||
Вираз пiд логарифмом є константою рiвноваги (9.12) |
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
( o |
o |
)ab |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
lg KC |
|
1 |
|
|
2 |
|
, |
|
|
|
|
|
|
(9.16) |
||||||||
|
|
|
|
|
0.059 |
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
де ab=n – спiльне число електронiв, що передаються при протіканні окисно-відновної реакцiї.
З хiмiчної термодинамiки вiдома залежнiсть мiж змiною вiльної енергiї Гiббса та
константою рiвноваги: |
|
|
|
|
|
|
|
|
G = –RTlnKT, |
|
|
(9.17) |
|||
Як було показано в попереднiй лекцiї, G = –nF , звiдки: |
|
||||||
ln KT |
|
nF |
|
nF( 1o 2o |
) |
. |
(9.18) |
RT |
RT |
|
|||||
|
|
|
|
|
|
||
При переході до концентрацiйної константи рiвноваги КC можна скористатися формальними потенцiалами редокс-пар, тому:
|
n( |
Ф |
|
Ф ) |
|
|
lg KC |
|
1 |
|
2 |
. |
(9.19) |
|
0.059 |
|
||||
|
|
|
|
|
||
Якщо КС > 1 103, то реакцiя протiкає майже до кiнця злiва направо (практично незворотня), однак, якщо КС < 1 103, то реакцiя злiва направо практично не протiкає. При промiжних значеннях KС реакцiя до кiнця не протiкає, тобто при рiвновазi в розчинi присутнi в помiтнiй кiлькостi як вихiднi речовини, так i продукти реакцiї.
Обчислена за рiзницею стандартних потенцiалiв редокс-пар константа рiвноваги дозволяє вирішити питання, чи доцiльно використовувати таку реакцiю для кiлькiсного визначення, чи, можливо, необхідно створити, умови вiдмiннi вiд стандартних, щоб реакцiя протiкала з необхiдною повнотою, чи може вiдмовитися вiд її застосування для кiлькiсного аналiзу.
Чим бiльша константа рiвноваги, тим повнiше буде протiкати реакцiя злiва направо при всiх iнших рiвних умовах, однак достатня величина константи не гарантує високої швидкостi її протiкання, тобто неможливо передбачити, як швидко ця рiвновага наступить.
9.7. Вплив різних чинників на швидкість окисно-відновних реакцій.
Швидкість окисно-вiдновних реакцiй в значнiй мiрi залежить вiд природи реагуючих речовин, концентрації, температури, присутності каталізаторів або інгібіторів, протікання індукованих або супряжених реакцій.
69
Збiльшення концентрації вихiдних речовин у розчинi, як це вiдзначалося раніше, прискорює реакцiю в цiлому пропорцiйно константi швидкостi та концентрацiям у вiдповiдних ступенях.
Стехiометричнi рiвняння реакцiй окиснення-вiдновлення не вiдбивають справжнього механiзму їх протiкання. Цi рiвняння є сумою окремих стадiй, де утворюються та витрачаються промiжні продукти, а швидкiсть сумарної реакцiї буде визначатися швидкістю протiкання найповiльнiшої стадiї.
Пiдвищення температури на 10 оC прискорює реакцiю в 2-4 рази, що часто використовують в аналiзі. Наприклад, при титруваннi оксалату натрiю перманганатом калiю реакційну суміш попередньо нагрiвають до 80-90 оC.
Дуже великий вплив на швидкiсть окисно-вiдновних реакцiй мають каталізатори, пiд дiєю яких швидкiсть може зростати в десятки й сотнi разiв. Наприклад, пероксид водню окиснює йодиди в розчинi дуже повiльно
H2O2 + 2J– + 2H+ J2 + H2O,
однак, введення незначних добавок сполук молiбдену та деяких iнших елементiв прискорює цю реакцiю в сотнi раз. Дуже повiльно протiкає реакцiя окиснення арсенiту церiєм
HAsO2 + 2Ce4+ + 2H2O HAsO42– + 2Ce3+ + 4H+,
яка в присутностi найменших слiдiв осмiєвої кислоти рiзко прискорюється. Каталiзатором може служити i продукт самої реакцiї окиснення, наприклад,
реакцію окиснення оксалату натрiю перманганатом калiю
2MnO4– + 5C2O42– + 16H+ 2Mn2+ + 10CO2 + 8H2O
каталiзують йони Mn2+, якi утворюються внаслiдок вiдновлення MnO4–. Це т.з.
автокаталітична реакція.
Суттєве ускладнення при аналiзi може викликати утворення в процесі реакцiї промiжних сполук, що мають пiдвищену хiмiчну активнiсть. Вони переважно вступають в побiчнi реакцiї, що приводить до завищених результатiв аналізів. Так, при визначеннi залiза перманганатометричним методом в солянокислому розчинi частина перманганату витрачається на окиснення йона Cl–
2MnO4– + 10Cl– + 10H+ 2Mn2+ + 5Cl2 + 8H2O.
При при вiдсутностi йонiв феруму Cl–-іони не окиснюються, хоча згiдно величин стандартних потенцiалiв ( o(MnO4–/Mn2+) = 1.51 B i o(Cl2/2Cl–) = 1.36 B) така реакцiя
повинна протiкати. При взаємодiї MnO4– з Fe2+ утворюються нестiйкi сполуки мангану промiжних ступенiв окиснення: Mn6+, Mn5+, Mn4+ та Mn3+, якi окиснюють йони Fe2+,
однак, маючи високу хiмiчну активнiсть, також реагують з Cl–-йонами, перетворюючи їх в Cl2. Розчинений хлор окиснює йони Fe2+ поряд з перманганатом, але газоподiбний хлор вивiтрюється i частково втрачається. В результатi витрати MnO4– на побiчну реакцiю з Cl– одержимо завищений результат по вмiсту феруму. Реакцiї такого типу Н.А.Шилов назвав супряженими або індукованими.
Індукованими реакціями називають дві реакції, які протікають в гомогенному середовищі, з яких перша протікає самочинно (первинна реакція), а друга протікає тільки в присутності першої (вторинна, індукована реакція).
У наведеному прикладi речовина (MnO4–), яка приймає участь в первиннiй та iндукованiй реакцiї, називається актором. Речовина (Fe2+), яка приймає участь тiльки в

70
первинній реакцiї, називається індуктором, а речовина (Cl–), яка приймає участь тiльки в iндукованiй реакцiї, – акцептором.
Для попередження iндукованої реакцiї перманганату з Cl–-йоном при титруваннi Fe2+ рекомендують вводити в розчин невелику кiлькiсть MnSO4; йони Mn2+ окиснюються найбiльш активними сполуками мангану легше, нiж Cl–, що знешкоджує iндуковану реакцiю. Тому, незважаючи на перебiг промiжних реакцiй, кiнцевий результат буде вiдповiдати сумарнiй стехiометричнiй реакцiїї
MnO4– + 5Fe2+ + 8H+ Mn2+ + 5Fe3+ + 4H2O.
9.8. Редокс-індикатори.
Окисно-відновними, або редокс-індикаторами, називаються речовини, якi змінюють свій колір в залежності від окисно-відновного потенціалу системи.
У розчинi редокс-iндикатор може iснувати в окисненiй та вiдновленiй формi, мiж якими встановлюється рiвновага:
Indок + ne– Indвідн (XI)
де Indок, Indвідн – окиснена та вiдновлена форми iндикатора; n – число електронiв, що приймають участь в окисно-вiдновному процесi.
Потенцiал iндикаторної системи може бути визначений з рiвняння Нернста:
(Indок |
/ Indвідн ) |
о |
(Indок |
/ Indвідн ) |
0.059 |
lg |
[Indок ] |
|
|
|
|
|
. |
(9.20) |
|||||
|
n |
|
|||||||
|
|
|
|
|
|
[Indвідн ] |
|
||
Приймаючи до уваги те, що змiну кольору око сприймає, коли концентрацiя однiєї з забарвлених форм у 10 разiв перевищує концентрацiю iншої форми, визначимо iнтервал переходу забарвлення:
10 |
[Indок ] |
0.1 |
або 1 lg |
[Indок ] |
1 |
[Indвідн ] |
|
||||
|
|
|
[Indвідн ] |
||
Пiдставляючи значення останнього виразу в рiвняння Нернста, знайдемо iнтервал зміни забарвлення iндикатора:
( Indок |
/ Indвідн ) о(Indок |
/ Indвідн |
) |
0.059 |
. |
(9.21) |
|
||||||
|
|
|
|
n |
|
|
Одним з найбiльш широко вiдомих iндикаторiв є дифеніламін. Пiд дiєю окисникiв дифенiламiн за незворотньою реакцiєю спочатку утворює дифенiлбензидин:
2 |
–N– |
–2е– |
|
–N– |
–N– |
+ 2Н+ |
.(XII) |
|
Н |
|
|
Н |
Н |
|
|
|
Далі безбарвний дифенiлбензидин зворотньо окиснюється до дифенiлбензидину |
||||||
фiолетового, забарвленого в iнтенсивний синьо-фiолетовий колiр: |
|
|
|||||
–N– |
–N– |
–2е– |
–N= |
= |
=N– |
+2Н+ |
Н |
Н |
|
|
|
|
|
безбарвний синьо-фіолетовий
Стандартний окисно-вiдновний потенцiал дифеніламіну, що характеризує останню реакцiю та iнтервал переходу при [H+] = 1 моль/л, рівний
(Indок/Indвідн) = 0.76 + 0.029 B.
