
лекції
.pdf51
НВ + А НА+ + В–.
В залежності від того, які використовуються стандартні розчини, в кислотноосновному методі можна виділити:
1)алкаліметрію – визначення кислот за допомогою стандартних розчинів лугів
(NaOH, KOH);
2)ацидиметрію – визначення основ за допомогою стандартних розчинів сильних кислот (НС1, H2S04);
3)галометрію – визначення солей за допомогою стандартних розчинів кислот або
лугів.
Концентровані розчини вихідних кислот НС1, H2S04 та тверді луги NaOH, KOH не відповідають вимогам, які висуваються до первинних стандартів (вихідних речовин). Тому стандартні розчини кислот та лугів виготовляють з фіксаналів або готують розчини приблизної концентрації, а потім стандартизують їх за первинними стандартами.
Розчини кислот стандартизують за допомогою бури Na2B4O7 l0H2O: Na2B4O7 + 5H2O + 2НС1 4НзВОз + 2NaC1,
або соди Na2CO3.
Для стандартизації лугів використовують оксалатну кислоту Н2С2О4 2Н2О або біфталат калію НООС–С6Н4–СООК:
НООС–С6Н4–СООК + NaOH NaOOC–C6Н4–COOK + Н2О.
Точку еквівалентності в методі кислотно-основного титрування встановлюють за допомогою індикаторів.
8.2. Кислотно-основні індикатори.
Якщо при досягненні точки еквівалентності в колбі для титрування не спостерігається видимих змін, фіксують точку еквівалентності за допомогою індикаторів.
Індикаторами називаються речовини, котрі, при внесенні в невеликих кількостях в аналізований розчин, дозволяють встановити кінець титрування за зміною забарвлення, утворенням каламуті, флуоресценцією розчину тощо.
Індикатори поділяються на:
-внутрішні, які вводяться в розчин;
-зовнішні, які змішуються з краплиною розчину за межами реакційної суміші;
-оборотні, які здатні змінювати забарвлення в обох напрямках;
-необоротні, які змінюють забарвлення тільки один раз, оскільки їх молекули руйнуються.
За типом реакцій, які використовуються для аналізу, індикатори поділяються на:
-кислотно-основні;
-окисно-відновні;
-комплексонометричні (металохромні);
-адсорбційні.
Кислотно-основнi iндикатори змiнюють свiй колiр в залежностi вiд зміни рН розчину. За хiмiчною природою кислотно-основні індикатори є слабкими органічними кислотами або основами, якi частково дисоцiюють в розчинi, наприклад
52
HInd H+ + Ind–, |
(I) |
де HInd – недисоцiйована молекула; Ind– – анiон iндикатора. |
|
До кислотно-основних індикаторів висуваються такі вимоги: |
|
-забарвлення обох форм індикатора повинно різко відрізнятися;
-забарвлення індикатора повинно бути інтенсивним;
-зміна забарвлення індикатора повинна відбуватися у вузькому інтервалі рН;
-кількість реагента, яка приводить до зміни кольору індикатора, повинна бути мінімальною;
-бажано, щоб індикатор був оборотним.
Існує кілька теорій, які пояснюють зміну кольору кислотно-основних індикаторів. Найважливішими з них є: йонна, хромофорна та йонно-хромофорна теорії індикаторів.
Iндикатор є органiчним барвником i за теорiєю йонних забарвлень Оствальда
недисоцiйованi молекули HInd та анiони Ind– мають різний колір.
Виходячи зі схеми дисоцiацiї (I), концентрацiйну константу дисоцiацiї iндикатора KНInd можна записати як
|
KHInd |
[H ][Ind ] |
. |
(8.1) |
|||
|
|||||||
|
|
|
|
[HInd ] |
|
||
З рiвняння (8.1), переписаному у формi |
|
|
|
|
|
|
|
|
KHInd |
|
|
[Ind ] |
, |
|
(8.2) |
|
[H ] |
[HInd ] |
|
||||
|
|
|
|
|
|||
видно, що iз зростанням концентрацiї iонiв водню вiдношення [Ind–]/[HInd] повинно зменшуватися. Інтенсивнiсть забарвлення, зумовленого кольором Ind–, також буде зменшуватися, а iнтенсивнiсть забарвлення, зумовленого кольором HІnd, зростатиме.
Прологарифмувавши рiвняння (8.2), одержимо вираз
pH pKHInd lg |
[Ind |
] |
(8.3) |
|
|
[HInd]
i встановимо межi змiни вiдношення [Ind–]/[HInd], при якому буде помiтною змiна кольору iндикатора.
Людське око здатне зафiксувати появу в забарвленому розчинi частинок iншого кольору, якщо їх вмiст буде складати не менше 10% вiд загальної кiлькостi забарвлених частинок, тобто, якщо вiдношення [Ind–]/[HInd] буде змiнюватися в межах вiд 1/10 до 10/1.Наприклад, для iндикатора метилового червоного при [Ind–]/[HInd] 10 колiр розчину буде сприйматися як чисто жовтий, а при [Ind–]/[HInd] 0.1 – як чисто червоний. В межах 10 [Ind–]/[HInd] 0.1 розчин буде мати перехiдний оранжевий колiр.
Інтервал pH, в якому індикатор змінює свій колір, називають інтервалом переходу індикатора. Щоб знайти цей iнтервал, пiдставимо в рiвняння (8.3) межi переходу:
[Ind–]/[HInd] = 10 та 0.1. |
|
pHп = pKНInd + lg10 = pKНInd + 1, |
|
pHк = pKНInd + lg0.1 = pKНInd – 1, |
|
де pHп – початок та pHк – кінець зміни забарвлення. |
|
Або в загальному вигляді: |
|
pHInd = pKInd 1 |
(8.4) |

53
Середина областi переходу pH = pKInd, як бачимо, визначається величиною pKInd. Для метилового оранжевого pKInd = 3.46 i з рiвняння (8.4) виходить, що змiна його кольору відбуватиметься в межах рН вiд 2.46 до 4.46. Однак, експериментально встановлено, що цей перехiд спостерiгається в межах рН вiд 3.1 до 4.4. Це зумовлено рiзною спектральною чутливістю ока та рiзницею в інтенсивності забарвлення кислої та лужної форм індикатора.
Для iндикаторів, якi є багатоосновними кислотами, спостерiгається декiлька iнтервалiв переходу, наприклад, у тимолового синього pK1(H2Ind) = 1.65 та pK2(H2Ind) = 9.20, тому перший перехiд (червоне – жовте) лежить у кислiй дiлянцi рН вiд 1.2 до 2.8, а другий (жовте – синє) – у лужнiй дiлянцi рН вiд 8.0 до 9.6.
Змiна кольору iндикатора пов'язана із суттєвою змiною його молекулярної структури. У вiдповiдностi з хромофорною теорією, забарвлення сполуки пов'язане з наявнiстю в її молекулi т.з. хромофорних груп, до яких вiдносяться –NO2, –N=N–, –NO i
т.д. та ауксохромних груп –NH2, –OH, –NR2, –R, –Cl i iн., що мiстять неподiленi
електроннi пари i пiдсилюють забарвлення. Структурнi змiни в молекулi метилового оранжевого при змiнi рН можна представити схемою:
(CH3)2N– |
|
–N=N– |
|
–SO3– + H+ (CH3)2N+= |
|
=N–NH– |
|
|
–SO3– |
|
|
|
|
||||||
|
|
Ind– (жовтий) |
|
|
HInd (червоний) |
|
|||
Змiшуванням декiлькох iндикаторiв одержують т.з. універсальний індикатор, який змiнює свої кольори в широкому iнтервалi рН та використовується для грубого визначення рН розчинiв.
Якщо iндикатор є слабкою основою, то його взаємодiю з протоном можна описати схемою:
Ind + H+ |
KInd |
|
HInd+, |
(ІІI) |
з якої можна вивести вiдповiдне рiвняння рiвноваги, аналогiчне (8.2), та рiвняння для обчислення iнтервалу переходу забарвлення iндикатора:
pH pKInd lg |
[Ind ] |
|
, |
(8.5) |
|
[HInd |
] |
||||
|
|
|
Механiзм дiї такого iндикатора аналогiчний до дiї iндикаторiв – слабких кислот. Суттєвий вплив на рКInd, iнтервал переходу, спектральнi та iншi властивостi
iндикатора мають також зовнiшнi фактори:
-температура (впливає на константу рiвноваги);
-присутнiсть нейтральних електролiтiв (солевий ефект);
-наявнiсть неводних розчинникiв, колоїдiв i т. п.;
-кiлькiсть доданого iндикатора та порядок титрування.
Важливою характеристикою iндикатора є показник титрування pT:
pT |
pHn pHк |
, |
(8.6) |
|
2 |
||||
|
|
|
тобто середина iнтервалу переходу iндикатора, де спостерiгається найбiльш чiтка змiна забарвлення. При такому рН закiнчують титрування i на практицi фiксують точку кінця реакції, яка з деяким наближенням вiдповiдає точцi еквiвалентностi.
54
8.3. Методи вибору індикаторів.
Правильнiсть кiлькiсного титриметричного аналiзу залежить вiд правильного вибору iндикатора. Цей вибiр можна здiйснити наступними способами:
-розрахунком рН в точцi еквiвалентностi;
-шляхом побудови кривих титрування та їх аналiзу;
-за величиною iндикаторних похибок титрування.
8.4. Вибір індикатора за розрахунком pH в точці еквівалентності.
Найбiльш простим способом вибору iндикатора є розрахунок величини рН в точцi еквiвалентностi та пiдбiр такого iндикатора, показник титрування якого рТ наближено
спiвпадає з рН в точцi еквiвалентностi (т.е.): |
|
рТ рНт.е. |
(8.7) |
Наприклад, при титруваннi розчину карбонату натрію стандартним розчином |
|
хлоридної кислоти |
|
Na2CO3 + 2HCl H2CO3 + 2NaCl |
(IV) |
по закiнченнi реакцiї в розчинi знаходяться карбонатна кислота та хлорид натрiю. В момент закiнчення титрування, внаслiдок дисоцiацiї слабкої карбонатної кислоти, середовище буде слабокислим, рН якого можна розрахувати за вiдомою формулою:
pHт.е. = 1/2pK1(H2CO3) – 1/2lgC(H2CO3). Нехай C(H2CO3) = 0.1 моль/л, pK1(H2CO3) = 6.35, тодi
pHт.е. = 6.35/2 – 1/2lg 0.1 = 3.68.
Найкраще пiдходить для цього випадку iндикатор – метиловий оранжевий з pT = (3.1 + 4.0)/2 = 3.55,
так як
pT = 3.55 3.675 = pHт.е.
Недолiком цього методу є те, що вiн дозволяє вибирати лише один iндикатор, який не завжди наявний в лабораторiї.
8.5. Вибір індикатора за кривою титрування.
Другий спосiб, оснований на побудові кривих титрування, бiльш складний, однак бiльш зручний та дозволяє робити вибiр з декiлькох iндикаторiв.
Кривi титрування – це графічне зображення залежнiсті зміни рН розчину, який титрують, вiд об'єму прилитого титранту.
Для побудови кривої титрування достатньо розрахувати величини рН:
-до точки еквiвалентностi (т.е.);
-в точці еквівалентності;
-пiсля точки еквівалентності.
Для повноти картини можна розрахувати рН розчину до початку приливання титранту.
Приклад. Розрахуємо криву титрування 0.1 М розчину HCl 0.1 M розчином NaOH. Для спрощення розрахункiв допустимо, що об'єм розчину HCl складає 100 мл, що цей об'єм в процесi титрування не змiнюється i, що рiзниця мiж концентрацiєю та активнiстю реагентiв несуттєва.
55
Розраховуємо рН вихiдного розчину; тобто 0.1 М розчину HCl. Це розчин сильної кислоти, яка повнiстю дисоцiює, а тому [H+] = C(HCl) = 0.1 M i, вiдповiдно, рН = 1. При додаваннi 10.0 мл розчину лугу в реакцiю вступить 10 % кислоти, а в розчинi залишиться 90 % невiдтитрованої HCl. Вiдповiдно її концентрацiя, концентрацiя йонiв H+ та рН розчину будуть рівні: C(HCl) = [H+] = 0.1 90/100 = 0.09 M, pH = 1.05.
Доливання все бiльшої кiлькостi лугу приводить до зниження концентрацiї HCl та [H+] i росту рН розчину. Проведемо для них розрахунки за наведеною методикою i результати запишемо в таблицю 5:
|
Розрахунок [H+] та рН розчину при титруванні |
Таблиця 5 |
||
|
|
|
||
|
|
0.1 М розчину HCl 0.1 M розчином NaOH |
|
|
V(NaOH), мл |
|
[H+], [OH–], моль/л |
рН |
|
0 |
|
0.1 |
1 |
|
10 |
|
0.1 90/100 = 0.09 |
1.05 |
|
50 |
|
0.1 50/100 = 0.05 |
1.30 |
|
90 |
|
0.1 10/100 = 0.01 |
2.0 |
|
99 |
|
0.1 1/100 = 0.001 |
3.0 |
|
99.9 |
|
4.0 |
|
|
|
0.1 0.1/100 = 0.0001 |
|
||
|
|
|
|
|
100 |
|
[H+] = [OH–] = 1 10-7 |
7.0 |
|
100.1 |
|
[OH–]=0.0001, [H+]=1 10-10 |
10.0 |
|
101 |
|
[OH–]=0.1 1/100=0.001, [H+]=10-11 |
11.0 |
|
110 |
|
[OH–]=0.1 10/100=0.01, [H+]=10-12 |
12.0 |
|
120 |
|
[OH–]=0.1 20/100=0.02, [H+]=10-13 |
12.3 |
|
В точцi еквiвалентностi, коли вся кислота повнiстю прореагує з лугом, рН розчину буде визначатися автопротолiзом води i стане рiвним pH = 7.0.
Після точки еквiвалентностi рН розчину буде визначатися надлишком прилитого лугу, який також повнiстю дисоцiює. Якщо додано 100.1 мл розчину лугу, то надлишок складе 0.1 мл, а його концентрацiя в розчинi C(NaOH) = [OH–] = 0.1 0.1/100 = 0.0001 M та, вiдповiдно, [H+] = 1 10–14 /1 10–4 = 1 10–10 i рН = 10.
Доливання все бiльшого надлишку лугу приведе до зростання концентрацiї ОН– i, вiдповiдно, росту рН. Результати цих обрахункiв занесемо в таблицю 5:
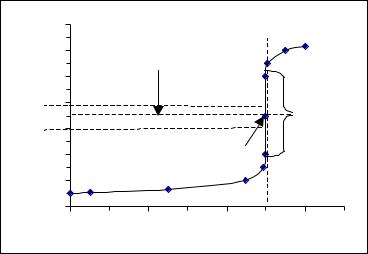
За цими даними будуємо криву титрування в координатах рН – V(NaOH) (рис. 4). Точку перетину кривої титрування з лiнiєю еквiвалентності називають точкою еквівалентност, а перетин кривої титрування з лiнiєю нейтральностi називають точкою нейтральності (т.н.). При титруваннi сильної кислоти лугом та навпаки ці точки спiвпадають.
Різку зміну pH в межах точки еквівалентності називають стрибком титрування.
Стрибок титрування – це зміна рН розчину поблизу т.е., коли розчин на 0.1 % недотитрований і на 0.1 % перетитрований порівняно з еквівалентною кількістю, що пов'язано з похибкою титриметричного методу 0.1 %. Це найбiльш суттєва частина кривої титрування, яка використовується для вибору iндикатора.
|
|
|
56 |
|
рН 14 |
|
Лінія еквівалентності |
||
|
12 |
Лінія нейтральності |
|
|
|
10 |
|
|
Стрибок |
рНк |
8 |
|
|
|
|
|
титру- |
||
|
6 |
|
|
|
рНп |
|
Т.е., т.н. |
вання |
|
|
4 |
|
|
|
|
2 |
|
|
|
|
0 |
|
|
|
|
0 |
40 |
80 |
120 V, мл |
Рис. 4. Крива титрування 0.1 М розчину НС1 0.1 М розчином NaOH.
Величина стрибка титрування при наших спрощеннях складає pH = 6 одиниць. Насправдi стрибок рН дещо менший через розведення розчину титрантом. При V(NaOH) = 99.9 мл загальний об'єм розчину складе 100 + 99.9 = 199.9 мл i концентрацiя [H+]=0.1 0.1/199.9=5 10–5 моль/л, звiдки pH=4.3, а при V(NaOH)=100.1 мл загальний об'єм складе 200.1 мл i концентрацiя [OH–]=0.1 0.1/200.1=5 10–5 моль/л, звiдки pOH=4.3 i pH=9.7. Вiдповiдно стрибок титрування з врахуванням розведення складе pH=9.7–4.3 =5.4 одиницi, а не 6.
Величина стрибка залежить також вiд концентрацiй реагуючих речовин у розчинах. Так, для 0.01 M розчинiв кислоти i титранта (стандартного розчину лугу) стрибок складе тiльки pH = 4 одиницi (вiд 5.0 до 9.0).
Пiдвищення температури викликає збiльшення йонного добутку води, що також вплине на величину стрибка титрування. Так, при 80 oС KW =2.4 10–13, вiдповiдно точка нейтральностi буде при рН = 6.31, а концентрацiя iонiв водню з врахуванням розведення
V(NaOH) = 100.1 мл, [H+] = 2.4 10–13/5 10–5 = 4.8 10–9 i рН = 8.32. Таким чином, в
даному випадку стрибок титрування складе лише pH = 8.32 – 4.3 = 4.02 одиниць. Крива титрування сильної основи кислотою може бути розрахована аналогiчно, i є
симетричним вiдображенням кривої титрування сильної кислоти лугом вiдносно лiнiї еквiвалентностi.
Кислотно-основнi iндикатори змiнюють своє забарвлення в межах iнтервалу переходу незалежно вiд того, досягнута, чи не досягнута точка еквiвалентностi. Для вибору iндикатора за кривою титрування з графiком цiєї кривої співставляють iнтервал переходу iндикатора. (див. рис. 4). У правильно вибраного індикатора інтервал переходу повністю або частково повинен співпадати із стрибком титрування.
Порівняємо з графiком кривої титрування інтервали переходу декiлькох iндикаторiв:
|
рНп |
рНк |
забарвлення |
дифенілоранж |
1.3 |
3.2 |
червоне – жовте |
метиловий оранжевий |
3.1 |
4.4 |
червоне – оранжевожовте |

57
бромтимоловий синій |
6.0 |
7.6 |
жовте – синє |
фенолфталеїн |
8.2 |
10.0 |
безбарвне – пурпурне |
Як бачимо, що інтервал |
переходу |
дифенiлоранжу |
є поза межами стрибка |
титрування i цей індикатор непридатний для титрування. Інтервал переходу метилового оранжевого частково захоплює межу стрибка i ще може бути застосований для цього титрування, однак, для титрування 0.01 M розчинiв вiн явно не пiдходить. Найкращим iндикатором буде бромтимоловий синiй, інтервал переходу якого співпадає з точкою еквiвалентностi в усiх випадках. Фенолфталеїн також може бути використаний в усiх випадках, так як його інтервал переходу частково захоплює стрибок титрування.
Правило вибору iндикатора: індикатор придатний для даного титрування, якщо його pT лежить в межах стрибка титрування.
8.6. Крива титрування слабкої основи сильною кислотою та слабкої кислоти сильною основою.
При титруваннi слабких кислот та основ є деякi вiдмiнностi, якi можна достатньо висвiтлити на наступному прикладi. Розрахуємо криву титрування 100 мл 0.1 M розчину
NH4OH 0.1 н. розчином HCl.
До приливання титранту (стандартного розчину кислоти) рН розчину в колбi буде
визначатися константою дисоцiацiї слабкої основи (K(NH4OH) = 1.76 10–5):
NH4OH NH4+ + OH–. (V)
Як було показано ранiше, концентрацiю йонiв OH– в розчинах слабких основ можна обчислити за формулою:
[OH ] |
K( NH |
OH )C( NH OH ) |
|
(8.8) |
4 |
4 |
|
|
|
i, вiдповiдно, |
|
|
|
|
pH = 14 – 1/2pK(NH4OH) + 1/2lgC(NH4OH), |
(8.9) |
|||
що при наших вихiдних даних дає |
|
|
|
|
pH = 14 – 4.755/2 + (–1)/2 = 11.1. |
|
|||
При доливаннi до цього розчину титранту протiкає реакцiя NH4OH + H+ NH4+ + H2O,
в результатi чого одержують еквiвалентну кiлькiсть йонiв амонiю (солi NH4Cl), якi в парi з гiдроксидом амонiю утворюють буферну сумiш. рН основних буферних розчинiв обчислюють за вiдомою спрощеною формулою:
pH 14 pK( NH4OH ) lg |
C( NH4OH ) |
|
|
|
. |
(8.10) |
|
|
|||
|
C( NH4Cl ) |
|
|
Таким чином, величина рН розчину аж до точки еквiвалентностi буде визначатися спiввiдношенням концентрацiй або кiлькостей вiльної основи та її солi. При поступовому доливаннi V(T) мл титранту з концентрацiєю C(T) кiлькiсть утвореної солi можна визначити за формулою n(NH4Cl)=C(T)V(T)/1000, а кiлькiсть NH4OH, що залишилася, за формулою n(NH4OH)=[100C(T)–V(T)C(T)]/1000. Тодi спiввiдношення кількостей NH4Cl до NH4OH в одному i тому ж об'ємi розчину (або концентрацiй) будуть визначатися як

58
C( NH4Cl ) |
|
n( NH4Cl ) |
|
V(T ) |
||
|
|
|
|
, |
||
C( NH4OH ) |
n( NH4OH ) |
|
||||
|
|
100 V(T ) |
||||
а формула для розрахунку рН до точки еквiвалентностi прийме вигляд:
pH pKW pK( NH4OH ) lg V(T ) . 100 V(T )
Наприклад, при доливаннi 10 мл титранту рН розчину стане рiвним pH = 14 - 4.755 + lg(10/(100-10)) = 10.2.
Обчислимо рН розчину, який титрують, для iнших об'ємiв титранта запишемо в таблицю 6:
Розрахунок [H+] та рН розчину при титруванні 0.1 М розчину NH4OH 0.1 M розчином HCl
(8.11)
(8.12)
i результати
Таблиця 6
V(HCl), мл |
[H+], моль/л |
pH |
0 |
7.56 10–12 |
11.1 |
10 |
6.31 10–11 |
10.2 |
30 |
2.51 10–10 |
9.6 |
50 |
5.62 10–10 |
9.25 |
70 |
1.32 10–9 |
8.88 |
90 |
5.13 10–9 |
8.29 |
99 |
5.62 10–8 |
7.25 |
99.9 |
5.62 10–7 |
6.25 |
100 |
5.33 10–6 |
5.27 |
100.1 |
5.00 10–5 |
4.30 |
101 |
4.98 10–4 |
3.30 |
105 |
2.44 10–3 |
2.61 |
110 |
4.76 10–3 |
2.32 |
В точцi еквiвалентностi розчин складається з солi слабкої основи i сильної кислоти та води. Така сiль гiдролiзує, а тому для обчислення рН використаємо вже вiдому формулу:
pH = 7 – 1/2pK(NH4OH) – 1/2lgC(NH4Cl). |
(8.13) |
||
Концентрацiю солi в точцi еквiвалентностi можна прийняти рiвною концентрацiї |
|||
вихiдної основи (без врахування розведення) або обчислити за формулою: |
|
||
C( NH4Cl ) |
C( HCl )V(HCl ) |
, |
(8.14) |
|
|||
V( HCl ) V( NH4OH ) |
|
||
де V(NH4OH) – початковий об'єм розчину NH4OH; V(HCl) – об'єм розчину титранта в точцi еквiвалентностi.
У нашому випадку C(NH4Cl)=0.1 100/(100+100)=0.05 моль/л i pH=7–4.755/2–1/2lg(0.05)=5.27.
Після точки еквiвалентностi рН розчину визначається надлишком долитого титранту, внаслiдок чого концентрацiя йонiв H+ може бути обчислена як
[H ] C(HCl ) |
(V( HCl ) 100)C(HCl ) |
. |
(8.15) |
|
V(HCl ) 100
Наприклад, для надлишку V(HCl) = 100.1 мл
[H+]=(100.1–100) 0.1/(100.1+100)=0.00005 моль/л.
59
Обчислимо рН для iнших об’ємiв надлишку титранта i занесемо результати в таблицю 6:
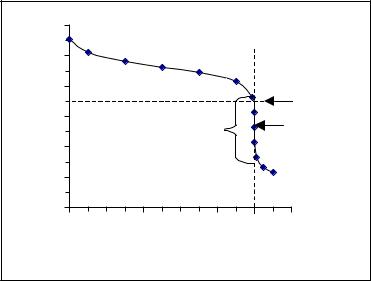
З побудованої за цими точками кривої титрування (рис. 5) видно, що точка еквiвалентностi (рН = 5.27) знаходиться при рН 7 (в ділянці кислого розчину) та не спiвпадає з точкою нейтральностi рН = 7, а стрибок титрування складає лише pH = 6.25 – 4.3 = 2.15 одиниць, що набагато менше вiд стрибка титрування сильної основи сильною кислотою (6 одиниць). Якщо побудувати кривi титрування для ще бiльш слабких основ, то побачимо, що стрибок титрування зменшується iз зменшенням KB основи. При KB < 1 10–8 на кривiй титрування спостерiгається лише слабкий перегин.
рН 12 |
|
Лінія еквівалентності |
|
10 |
|
||
|
|
|
|
8 |
Лінія нейтральності |
Т.н. |
|
6 |
|
|
|
|
Стрибок |
Т.е. |
|
4 |
|
||
титрування |
|
||
2 |
|
|
|
0 |
|
|
|
0 |
40 |
80 |
120 |
|
|
|
V (HCl), мл |
Рис. 5. Крива титрування 0.1 М розчину NH4OH 0.1 М розчином НС1.
Якщо нанести на криву титрування інтервали переходу ранiше запропонованих iндикаторiв, то побачимо, що в межі стрибка титрування потрапляють лише частково інтервали переходу метилового оранжевого та бромтимолового синього. Інтервал переходу фенолфталеїну лежить вище стрибка титрування, а інтервал переходу дифенiлоранжу нижче стрибка i, вiдповiдно, вони не можуть бути застосованi при титруваннi даної слабкої основи кислотою.
Аналогiчним чином можна побудувати криву титрування слабкої кислоти стандартним розчином сильної основи (лугу). Точка еквiвалентностi при цьому буде розмiщена в лужному середовищі (рНт.е. > 7) через гiдролiз солi, утвореної сильною основою та слабкою кислотою.
8.7. Вибір індикатора за індикаторною похибкою титрування.
Придатнiсть того чи iншого iндикатора для даного титрування можна кiлькiсно охарактеризувати індикаторною похибкою титрування, яка виникає через неспiвпадання рТ індикатора та рНт.е..
Існують наступні види похибок:
1. Воднева похибка ( Н+) спостерігається при надлишку в розчині йонів гідроксонію, коли рТ < рНт.е.
60
H |
|
|
10 |
pT V2 |
100%, |
(8.16) |
|
|
|
|
|
||||
CV1
де V1 – початковий об'єм кислоти (лугу); V2 – об'єм розчину в кінці титрування; С – концентрація сильної кислоти (лугу).
2. Гідроксильна похибка ( ОН–) спостерігається при надлишку в розчині йонів ОН–, коли рТ > рНт.е.:
|
OH |
|
|
10рТ 14V2 |
100% . |
(8.17) |
|
|
CV1 |
||||
|
|
|
|
|
|
|
3. |
Кислотна похибка ( НА) спостерігається, коли в розчині є в надлишку слабка |
|||||
кислота. |
|
|
|
|
|
|
|
НА = 10рК–рТ 100%. |
(8.18) |
||||
4. |
Основна похибка ( В) спостерігавться при надлишку в розчині слабкої основи. |
|||||
|
В = 10рК+рТ–14 100%. |
(8.19) |
||||
Якщо розчин недотитрований, то похибка має знак "–", |
якщо перетитрований – |
|||||
знак "+".
Якщо розрахована величина індикаторної похибки задовільняє вимоги до точності аналізу (0.1 %), то індикатор придатний для даного титрування.
9. МЕТОДИ ОКИСНО-ВIДНОВНОГО ТИТРУВАННЯ. 9.1. Загальна характеристика окисно-відновних реакцій.
Характерною рисою реакцiй окиснення-вiдновлення є обмiн електронами мiж реагуючими частинками. Частинку, яка приймає електрони, називають окисником, а ту,
яка віддає електрони – відновником. Наприклад, в реакцiї
Fe2+ + Ce4+ Fe3+ + Ce3+ (I)
електрони вiд Fe2+ (вiдновника) переходять до Ce4+ (окисника), в результатi чого ступiнь окиснення йона Ce4+ зменшується, а йона Fe2+ збiльшується. Таким чином, процес
окиснення однiєї речовини нерозривно пов'язаний із відновленням iншої, тому реакцiї
цього типу називаються окисно-відновними.
Кожну окисно-вiдновну реакцiю можна зобразити як алгебраїчну суму двох пiвреакцiй:
Fe2+ – 1e– Fe3+ |
1 – півреакція процесу окиснення; |
|
Ce4+ + 1e– Ce3+ |
1 – півреакція процесу відновлення; |
|
______________________ |
|
|
Fe2+ + Ce4+ Fe3+ + Ce3+. |
(II) |
|
При сумуваннi потрiбно передбачити, щоб у відповідності з |
законом |
|
електронейтральності розчину, загальне число електронів, що віддають частинки відновника, було рівним загальному числу електронів, що прий мають частинки окисника. На цьому оснований електронно–йонний метод пiдбору стехiометричних коефiцiєнтiв в окисно-вiдновних реакцiях.
