
лекції
.pdf11
2.2. Класифікація методів аналізу.
Сучасна аналітична хімія використовує більше 50 різноманітних методів аналізу. Різноманітність методів змушує вчених систематизувати їх за певними спiльними ознаками, наприклад:
-характер процесiв, що лежать в основi одержання чи виявлення аналiтичного сигналу;
-кiлькiсть речовини, яка необхiдна для проведення аналiзу;
-спосiб виконання аналiтичних операцiй;
-природа вимiрюваної величини i т.п.
Якщо в основi процесу, що служить для одержання аналiтичного сигналу, лежить хімiчна реакцiя, що супроводжується помiтним зовнiшнiм ефектом (змiна забарвлення, випадання осаду, видiлення газу, одержання кристалiв характерної форми), то такі методи аналізу називають хімічними методоми.
Восновi фізичних методiв аналiзу лежить вимiрювання характерної фiзичноi властивостi визначуваного компонента (емiсiйного чи абсорбцiйного спектру, маси атома, розсiювання рентгенiвських променiв, електропровiдностi розчинiв, густини розчину i т.п.).
Широке розповсюдження одержали так званi фізико-хімічні методи аналiзу, в основi яких лежить вимiрювання деяких фiзичних параметрiв хімiчної системи, якi залежать вiд природи компонентiв системи та змiнюються в процесi протiкання хімiчноi реакцiї (потенцiометрiя, полярографiя, кулонометрiя, колориметрiя i т.п.).
Взалежностi вiд кiлькостi речовини, яка використовується для аналiзу, розрiзняють наступнi методи (таблиця 1).
Класифікація методів аналізу за кількістю речовини. |
Таблиця 1 |
||||
|
|||||
Стара назва |
Нова назва |
Кількість досліджуваної речовини |
|||
|
|
|
г |
|
мл |
Макроаналіз |
Грам–метод |
0.1 |
– 1 |
|
10 – 100 |
Напівмікроаналіз |
Сантиграм–метод |
0.01 |
– 0.1 |
|
1 – 10 |
Мікроаналіз |
Міліграм–метод |
10–3 – 10–2 |
|
0.1 – 1.0 |
|
Ультрамікроаналіз |
Мікрограм–метод |
10–6 – 10–4 |
|
10–4 – 10–2 |
|
Субмікроаналіз |
Нанограм–метод |
10–9 – 10–7 |
|
10–7 – 10–5 |
|
Субультрамікроаналіз |
Пікограм–метод |
< 10–10 |
|
< 10–8 |
|
Найчастiше в класичнiй аналiтичнiй хімiї використовується напiвмiкроаналiз, який має ряд переваг:
-економiя часу та реагентiв,
-висока надiйнiсть та детальна розробка методик,
-наявнiсть специфiчних та високочутливих реакцій і реагентiв.
За способом виконання операцiй розрiзняють методи, що виконуються "сухим" та "мокрим" способом. "Сухий" спосіб полягає у проведенні реакцiй мiж твердими речовинами (розтирання, зтоплювання, спiкання, прожарювання, спалювання). Цi методи широко використовуються при проведеннi геохімiчних аналiзiв у польових умовах, для "розпечатування" проби силiкатiв, гiрських порiд, вогнетривiв i т.п.
"Мокрий" спосiб, оснований на проведеннi реакцiй в розчинах, використовується частіше, тому він широко впроваджений в аналітичну практику.
12
За природою вимірюваної величини розрізняють фізичні та фізико-хімічні методи аналізу, наприклад, емісійний (вимірювання довжини хвилі та інтенсивності електромагнітного випромінювання), потенціометрія (вимірювання потенціалу електрода), кондуктометрія (вимірювання електропровідності розчину) і т.п.
2.3. Дробний та систематичний (сірководневий та безсірководневі) методи якісного аналізу катіонів.
У систематичному якісному аналізі використовується принцип розділення складної суміші речовин на певні групи (йонів) при хімічній взаємодії з груповими реагентами.
Найбільш поширеним методом систематичного аналізу катіонів є сірководневий метод аналізу, який заснований на реакціях утворення нерозчинних сульфідів, хлоридів та карбонатів. Теорія та практика сірководневого методу добре відпрацьована, метод характеризується чітким розділенням компонентів та високою чутливістю специфічних реакцій, що використовуються. Метод легко поєднується з дробним та іншими способами аналізу. Йому належить вирішальна роль у формуванні та розвитку хімічного мислення.
Недоліки методу:
-сірководень – дуже отруйний газ, який має неприємний запах, тому робота з H2S потребує доброї вентиляції або спеціально обладнаного приміщення;
-для одержання газоподібного H2S потрібна відповідна апаратура, а також
необхідно дотримуватися особливих пересторог.
В останні роки все ширшого застосування набувають безсірководневі методи аналізу, в яких для виявлення окремих груп йонів або зовсім виключається застосування сполук, що містять сульфідну сірку, або допускається обмежене їх використання. В цих методах повністю зберігається принцип систематичного ходу аналізу. Безсірководневі методи також засновані на реакціях осадження, окиснення-відновлення, комплексоутворення і т.п.
Серед безсірководневих методів найбільш відомі:
-кислотно-основний (лужний) - заснований на різній розчинності хлоридів, сульфатів та гідроксидів, а також на утворенні аміачних комплексних сполук ряду катіонів;
-аміачно-фосфатний - заснований на різній розчинності фосфатів у воді, кислотах, лугах та водному розчині аміаку;
-сульфідно-лужний - заснований на малій розчинності хлоридів, сульфідів та гідроксидів ряду катіонів;
-тіоацетамідний - заснований на застосуванні як групового реактива тіоацетаміду CH3CSNH2, який у водних розчинах внаслідок гідролізу призводить до утворення
сірководню, що робить метод подібним до сірководневого: CH3CSNH2 + H2O CH3COO– + NH4+ + H2S;
- хроматографічні методи аналізу - засновані на розділенні катіонів при транспортуванні проби через хроматографічну колонку, наприклад, на катіоніті КУ-2 в H+-формі або оксиді алюмінію у формі [(Al2O3)xAlO2-]Na+, де протікає обмін:
[RSO3–]H+ + MeA RSO3Me + HA або [(Al2O3)xAlO2–]Na+ + MeA [(Al2O3)xAlO2–]Me+ + NaA.
13
Серед інших методів аналізу катіонів за способом виконання операцій слід назвати раніше згадувані - дробний, крапельний, мікрокристалоскопічний.
2.4. Аналітична класифікація катіонів за сірководневим методом аналізу та її зв'язок з періодичною системою елементів Д.І.Менделєєва.
У сірководневому методі якісного аналізу всі катіони (загальна кількість яких сягає 80) поділяють на 5 аналітичних груп..
До першої належить група катіонів (NH4+, Na+, K+, Mg2+ та інші), яка складається з елементів головної підгрупи першої групи періодичної системи Д.І.Менделєєва (Li, Na, K, Rb, Cs). Сюди ж відносяться йони гідроксонію (H3O+) та амонію (NH4+), а також катіон магнію (Mg2+), який є аналогом Li+ за діагональним напрямком в таблиці Д.І.Менделєєва. Через подібність будови зовнішнього рівня електронної оболонки (...s1) всі катіони лужних металів однаково взаємодіють з багатьма реагентами, але групового реагента не мають, так як більшість їх солей добре розчинні у воді. Катіони І-ої групи відкривають у розчині дробним методом за допомогою специфічних реакцій, наприклад:
|
нагр. |
|
|
|
|
NH4+ + NaOH NH3 + H2O; |
|
||
|
2н. |
запах |
|
|
2K+ + |
Na3[Co(NO2)6] |
|
K2Na[Co(NO2)6] + 2Na+; |
|
|
гексанітрокобальтат натрію |
|
яскраво-жовтий осад |
|
|
Na+ + Zn(UO2)3.(CH3COO)8 + CH3COOH + 6H2O |
|||
|
цинкуранілацетат |
|
|
|
|
NaZn(UO2)3.(CH3COO)9.6H2O |
+ H+; |
||
|
характерні тетраедричні кристали |
|
||
Mg2+ + HPO42– + NH4OH MgNH4PO4 (білий осад) + H2O.
Друга аналітична група катіонів (Ca2+, Sr2+, Ba2+) містить йони лужно-земельних металів, які входять в головну підгрупу другої групи періодичної системи та мають на зовнішньому рівні електронної оболонки два електрони (...s2). Їх карбонати, сульфати, фосфати та оксалати мають малу розчинність.
Груповим реагентом на ІІ групу катіонів служить карбонат амонію (NH4)2CO3 в присутності амонійного буферного розчину (NH4Cl + NH4OH), який створює pH = 9.2. Груповий реагент у розчині піддається гідролізу
NH4+ + CO32– + H2O HCO3– + NH4OH
і реакція, яка відбувається при осадженні катіонів ІІ групи, описується рівнянням:
Me2+ + HCO3– + NH4OH MeCO3 + NH4+ + H2O, де Me2+ = Ca2+, Sr2+, Ba2+.
Катіон Mg2+, який міг би випадати в осад у вигляді основного карбонату магнію, добре розчинний у надлишку (NH4)2CO3 та NH4Cl і тому залишається в розчині разом з катіонами І аналітичної групи:
(MgOH)2CO3 + 4NH4+ + H2O 2Mg2+ + 4NH4OH + CO2 ;
Розчинність карбонатів, гідроксидів, сульфатів, оксалатів та фосфатів цих елементів визначається наступними величинами добутків розчинності (ДР) цих солей (таблиця 2):
14
|
|
|
|
Таблиця 2 |
|
Добутки розчинності солей катіонів ІІ аналітичної групи. |
|||
Назва |
|
|
Добуток розчинності |
|
солей |
|
Са2+ |
Sr2+ |
Ba2+ |
Карбонати |
|
4.8·10–9 |
1.1·10–10 |
5.1·10–9 |
Гідроксиди |
|
5.5·10–6 |
3.2·10–4 |
5.0·10–3 |
Сульфати |
|
2.37·10–5 |
3.2·10–7 |
1.1·10–10 |
Оксалати |
|
2.3·10–9 |
5.6·10–8 |
1.1·10–7 |
Фосфати |
|
2.0·10–29 |
1.0·10–31 |
6.03·10–39 |
Зверніть увагу на різну розчинність сульфатів кальцію і барію, що використовується для їх розділення, та на розчинність оксалату кальцію, що використовується
для ідентифікації Ca2+ за специфічною реакцією.
Третя аналітична група катіонів (Al3+, Cr3+, Mn2+, Fe2+, Fe3+, Zn2+, Co2+, Ni2+)
складається з елементів, які належать до різних груп періодичної системи, однак містять на зовнішньому енергетичному рівні два (...4s2) або три електрони, як йон Al3+ (...3s23p1), Cr3+ (...3d54s1), Fe3+ (...3d64s2). Вони осаджуються груповим реагентом - сульфідом амонію (NH4)2S у середовищі з pH = 9.2, тобто в присутності амонійного буферного розчину (NH4Cl + NH4OH):
2NH4+ + S2– + H2O NH4+ + HS– + NH4OH.
Третю групу катіонів можна поділити на 2 підгрупи:
- катіони, що утворюють нерозчинні гідроксиди (Al3+, Cr3+, Be2+, Ti4+ та інші), наприклад,
Al3+ + 3S2– + 3H2O Al(OH)3 + 3HS–;
- катіони, що утворюють нерозчинні сульфіди (Mn2+, Zn2+, Fe2+, Fe3+, Co2+, Ni2+ та інші), наприклад,
Fe2+ + S2– FeS .
Розчинність тих чи інших сполук визначається добутками розчинності (ДР), які наведені в таблиці 3.
|
Добутки розчинності солей катіонів ІІІ аналітичної групи. |
Таблиця 3 |
|||||
|
|
||||||
Назва |
|
|
Добуток розчинності |
|
|
||
солей |
Al3+ |
Cr3+ |
Mn2+ |
Fe2+ |
Fe3+ |
Ni2+ |
Zn2+ |
Сульфіди |
– |
– |
2·10–10 |
5·10–18 |
– |
3·10–19 |
2·10–24 |
Гідроксиди |
1·10–32 |
6·10–31 |
2·10–13 |
8·10–16 |
6·10–38 |
2·10–15 |
1·10–17 |
Фосфати |
6·10–19 |
1·10–17 |
– |
– |
1·10–22 |
2·10–13 |
9·10–33 |
Карбонати |
– |
– |
2·10–11 |
3·10–11 |
– |
1·10–7 |
1·10–11 |
Якщо розчинність (ДР) сульфіду більша, ніж гідроксиду, то випадає нерозчинний гідроксид.
Деякі катіони ІІІ групи можуть перебувати в різних ступенях окиснення, тому для їх виявлення широко використовуються окисно-відновні реакції. При аналізі катіонів ІІІ
групи слід звертати увагу на гідроліз їх солей, амфотерність гідроксидів та здатність до комплексоутворення. Наприклад, катіон Al3+ під дією NaOH утворює білий осад
Al3+ + 3OH– Al(OH)3 ,
який розчинний в кислотах
Al(OH)3 + 3H+ Al3+ + 3H2O
15
та лугах (прояв амфотерності)
Al(OH)3 + 3OH– [Al(OH)6]3– або Al(OH)3 + 3NaOH Na3AlO3 + 3H2O.
Для катіонів Fe2+ і Fe3+ характерні реакції комплексоутворення: 3Fe2+ + 2[Fe(CN)6]3– Fe3[Fe(CN)6]2 ;
(турнбулева синь) 4Fe3+ + 3[Fe(CN)6]4– Fe4[Fe(CN)6]3 .
(берлінська блакить). Характерною для катіона Mn2+ є окисно-відновна реакція:
2Mn2+ + 5PbO2 + 4H+ 2MnO4– + 5Pb2+ + 2H2O.
малиново-фіолетовий колір розчину Сульфіди катіонів ІІІ групи легко розчиняються в розведених кислотах (HCl,
H2SO4) з виділенням сірководню.
Катіони четвертої аналітичної групи (Cu2+, Cd2+, Hg2+, Bi3+, Sn2+, Sn4+, Sb3+, Sb5+, As3+, As5+) осаджують сірководнем у кислому середовищі при pH = 0.5. Їх також можна поділити на дві підгрупи:
-підгрупу міді (Cu2+, Cd2+, Hg2+, Bi3+), сульфіди яких нерозчинні в надлишку розчину Na2S або (NH4)2S;
-підгрупу арсену (Sn2+, Sn4+, Sb3+, Sb5+, As3+, As5+), сульфіди яких розчиняються в надлишку розчину Na2S або (NH4)2S з утворенням тіосолей, наприклад,
As2S3 + 3Na2S 3Na3AsS3 (тіоарсеніт натрію)/
Сульфіди катіонів ІV групи нерозчинні в розведених HCl і H2SO4, але легко розчиняються в HNO3.
Катіони п'ятої аналітичної групи (Ag+, Hg22+, Pb2+) осаджують концентрованою HCl, яка є груповим реагентом. В розчині протікають реакції:
Ag+ + Cl– AgCl |
ДР = 1.78·10–10; |
(білий осад) |
|
Hg22+ + 2Cl– Hg2Cl2 |
ДР = 1.3·10–18; |
(каломель) (білий осад) |
|
Pb2+ + 2Cl– PbCl2 |
ДР = 1.6·10–5. |
(білий осад)
Порядок виконання якісного аналізу суміші катіонів у розчині за сірководневим методом показано схемою, наведеною нижче.
2.5. Класифікація аніонів.
Розмаїтість аніонів (~230) значно перевищує кількість катіонів. Однак класифікація аніонів, як і катіонів, пов'язана з положенням відповідних елементів у періодичній системі Д.І.Менделєєва. Найбільш типові і поширені аніони утворюють в основному елементи IV-VII груп та елементи побічних підгруп від Ti до Mn, від Zr до Tc, від Ta до
Re.
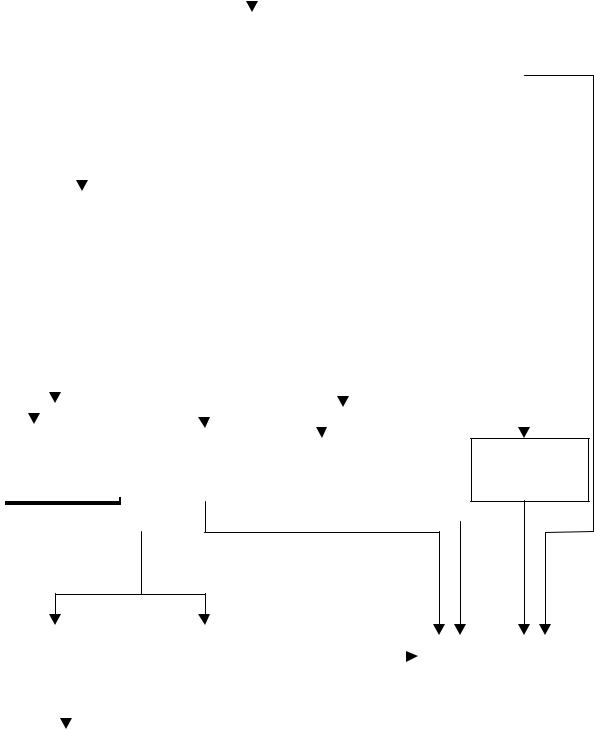
16
Схема якісного систематичного аналізу катіонів.
|
|
|
|
|
|
|
|
|
|
|
Розчин для аналізу |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6н. HCl |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Розчин ( |
|
катіони |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
Осад (V |
група) |
|||||||
|
|
|
I – IV групи) |
|
|
|
|
|
|
|
|
AgCl, PbCl2, Hg2Cl2 |
|||||||
|
|
|
|
|
2н. NH3 + |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
0.6н. HCl + H2S |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
Розчин (катіони |
|
|
|
Осад (IV група) |
|
||||||||||||
|
|
|
I – III групи) |
|
|
|
CuS, CdS, HgS, Bi2S3, |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SnS, SnS2, Sb2S3, Sb2S5 |
|
||||
|
|
|
|
|
|
|
NH4Cl + NH4OH + |
|
|
|
H2O2 (3%–ний), |
||||||||
|
|
|
|
|
|
|
+ (NH4)2S |
|
|
|
кип’ятіння, |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Na2S+ NaOH |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Осад (III група) |
|
|
|
|
|
Розчин |
|
|
Осад (група IVa) |
||||
|
(катіони |
|
Cr(OH)3, Al(OH)3, |
|
CuS, HgS, CdS, |
|||
|
I, IІ групи) |
|
FeS, NiS, CoS, MnS |
|
Bi2S3 |
|||
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Розчин
(група IVб) SnS32–, SbS43–
NH4Cl + NH4OH +
+ (NH4)2CO3
|
Розчин |
|
Осад (II група) |
|
|
|
|
|
|
|
|
Осади розчиняють і |
|||
|
(катіони І гр.) |
|
BaCO3, SrCO3, |
|
|
||
|
|
|
|
аналізують на вміст |
|||
|
Na+, K+, Mg2+, |
|
CaCO3 |
|
|
||
|
NH4+ |
|
|
|
|
окремих катіонів за |
|
|
|
|
|||||
|
|
|
|
|
|
|
специфічними |
|
|
|
|
|
|||
Аналіз за специфічними реакціями |
|
|
реакціями |
||||
17
Різноманітність хіміко-аналітичних властивостей аніонів ускладнює розробку їх класифікації. Серед аніонів розрізняють:
-елементні аніони – Cl–, Br–, I–, F–, S2– і т.п.;
-кисневмісні аніони – SO42–, CO32–, SiO32–, PO43– і т.п.;
-аніони органічних кислот – HCOO–, CH3COO–, C6H4(COO)22–, C2O42–;
-аніони, які в своєму складі містять нітроген, сульфур, ферум, кобальт та інші елементи – CN–, [Fe(CN)6]4–, SCN–, [Co(NO2)6]3–;
Переважно аніони є складовими частинами кислот та відповідних солей. Один і
той же елемент може утворювати декілька аніонів, які суттєво відрізняються за своїми властивостями. Наприклад, сірка утворює аніони: S2–, SO32–, SO42–, S2O32– та інші. В залежності від сполуки, до складу якої входить аніон, його властивості також можуть відрізнятися, наприклад, SO42– в сульфатній кислоті може бути окисником, а в складі солей – окисної здатності не проявляє, однак легко осаджується.
Стан аніонів в розчині залежить від рН середовища (розчину):
-деякі аніони розкладаються під дією сильних кислот з виділенням відповідних газів: CO2 з СO32–, SO2 з SO32–, H2S з S2–, NO2 з NO3– та ін.;
-при дії розбавлених кислот аніони MoO42–, SiO32–, WO42– утворюють нерозчинні у
воді кислоти H2MoO4, H2SiO3, H2WO4;
- аніони слабких кислот (СO32–, PO42–, SiO32–, S2–) у водних розчинах частково або
повністю гідролізують , наприклад:
S2– + H2O HS– + OH–;
- аніони, що утворені елементами із змінною валентністю, при дії окисників або відновників змінюються, змінюючи ступінь окиснення елемента, наприклад
S2– SO2 SO32– SO42–;
NO3– NO2 NO N2 NH3.
Вищезгадані властивості аніонів можна використовувати для їх якісного аналізу. Реагенти за своєю дією на аніони можна розділити на наступні групи:
-реактиви, що розкладають речовини з виділенням газів (мінеральні кислоти такі,
як HCl, H2SO4);
-реактиви, що осаджують аніони з розчинів як малорозчинні солі:
а) BaCl2 в нейтральному середовищі або в присутності Ba(OH)2 при рН 7 осаджує
SO42–, SO32–, S2O32–, СO32–, PO42–, B4O72–, SiO32–, AsO43–, AsO2–, CrO42–, F–, C2O42– і т.д.; б) AgNO3 в 2 н. HNO3 осаджує Cl–, Br–, I–, S2–, CNS–, CN–, ClO–, [Fe(CN)6]4–,
[Fe(CN)6]3–, BrO3–, IO3– і т.д.;
–реактиви–відновники (KI);
–реактиви–окисники (KMnO4, розчин I2 в KI, конц. HNO3).
Аніони при аналізі в основному не заважають один одному при їх виявленні, тому групові реагенти застосовують не для розділення, а для перевірки наявності або відсутності тієї чи іншої групи аніонів.
За В.М.Алексеєвим аніони поділяють на 3 аналітичні групи:
–І група осаджується BaCl2 при рН 7 (SO42–, SO32–, СO32–, SiO32–, PO43–);
–II група осаджується AgNO3 в 2 н. HNO3 (Cl–, Br–, I–);
–III група (NO3–, NO2–, CH3COO–, MnO4–, ClO3– та інші) групового реагента не має
іаніони можуть бути виявлені специфічними реакціями.
18
Аналіз суміші аніонів проводять в основному дробним методом за допомогою специфічних реакцій. Систематичний аналіз аніонів проводять дуже рідко.
2.6. Аналіз речовин невідомого складу.
Якісний аналіз речовин невідомого складу проводять поетапно в декілька стадій. Якщо не рахувати стадії відбору проби та підготовки її до аналізу, то можна виділити 3 етапи:
–попередні випробування зразка;
–систематичний аналіз катіонів сірководневим методом;
–аналіз аніонів дробним методом.
Попередні випробування дозволяють виявити деякі елементи у пробі, а також відмітити деякі властивості, що непрямо вказують на присутність цих елементів.
В результаті попередніх випробувань встановлюють:
–зовнішній вигляд речовини (кристали, аморфний порошок і т.п.);
–колір речовини;
–наявність кристалізаційної води або розкладу речовини при нагріванні в тугоплавкій пробірці;
–колір полум'я при внесенні речовини в полум’я газового пальника;
–розчинність у воді, кислотах, лугах (виділення газу);
–визначення рН розчину при розчиненні у воді (та гідролізі);
–визначення окисників (досліджуваний р-н + KI + H2SO4 I2);
–визначення відновників (досліджуваний р-н + KMnO4 + H2SO4 Mn2+).
Систематичний аналіз на катіони починають з виявлення в окремих порціях
досліджуваного розчину йонів NH4+, Fe2+, Fe3+ та Mn2+ дробним методом. Потім виявляють груповими реагентами катіони V, IV,III та II групи за вищенаведеною схемою (наступну групу виявляють тільки після осадження та відокремлення попередньої !!!). Аналіз катіонів всередині кожної групи ведуть за методами, згаданими раніше та детально описаними у відповідних підручниках та методичних вказівках.
Якщо в розчині є катіони ІІ – V аналітичних груп, то перед проведенням реакцій на аніони ці катіони необхідно видалити, оскільки вони будуть заважати відкриттю аніонів. Для цього порцію досліджуваного розчину кип'ятять з розчином соди Na2CO3. При цьому протікає осадження всіх "важких" металів у вигляді карбонатів, а аніони залишаються в розчині як добре розчинні солі натрію, де вони можуть бути легко виявлені дробним методом. Наприклад:
BaSO3 + Na2CO3 BaCO3 + 2Na+ + SO32–;
2CuSO4 + Na2CO3 + H2O (CuOH)2CO3 + 2Na+ + 2SO42– + 2H+.
Перед проведенням вказаної операції необхідно виявити спочатку аніон CO32–, подіявши кислотою на сухий зразок (див. попередні випробування).
Очевидно, що результати попередніх випробувань не повинні заперечуватись даними про елементний склад речовини.

19
3.ОСНОВНІ ЗАКОНОМІРНОСТІ ПРОТІКАННЯ ХІМІЧНИХ РЕАКЦІЙ.
3.1.Розчин як середовище для проведення аналітичних реакцій.
Переважна більшість хімічних реакцій, які застосовуються в гравіметричних,
титриметричних та багатьох фізико-хімічних методах аналізу, протікають в розчинах. Це реакції:
–кислотно-основної взаємодії;
–окиснення-відновлення;
–осадження малорозчинних сполук;
–комплексоутворення та деякі інші.
Для більшості аналітичних задач застосовуються реакції, що протікають швидко, кількісно та стехіометрично.
За застосуванням з аналітичною метою реакції поділяють на:
–реакції розділення (відокремлення), наприклад, з груповим реагентом;
–реакції виявлення (відкриття, ідентифікації), тобто якісного аналізу;
–реакції для кількісного вимірювання (визначення).
Для запису хімічних реакцій в аналітичній хімії використовують:
– молекулярні рівняння, наприклад,
2NaOH + H3PO4 Na2HPO4 + 2H2O;
– йонні рівняння, наприклад,
H+ + OH– H2O;
–йонно-електронні рівняння, наприклад, 2 Mn2+ + 4H2O – 5е– MnO4– + 8H+;
5 BiO3– + 2e– + 6H+ Bi3+ + 3H2O;
Mn2+ + 5BiO3– + 14H+ 2MnO4– + 5Bi3+ + 7H2О.
Закономірності, що лежать в основі керування цими реакціями, є найбільш важливою складовою частиною теоретичних основ хімічних (титриметричних та гравіметричних) і деяких фізико-хімічних методів аналізу. В зв'язку з цим, вивчення теоретичних основ аналітичної хімії починають з розгляду процесів у розчинах.
3.2. Стехіометрія і закон збереження маси.
Кожна хімічна реакція протікає з певною швидкістю і закінчується після досягнення певного стану рівноваги. Стан рівноваги, тобто ситуацію, коли в системі при даній температурі та постійності інших зовнішніх умов встановлюються незмінні в часі рівноважні концентрації реагентів, вивчає хімічна термодинаміка. Швидкість протікання хімічної реакції або швидкість її наближення до стану рівноваги вивчає хімічна кінетика. Більшість реакцій аналітичної хімії протікають в розчинах з великою швидкістю, а тому рівновага наступає за короткий час.
Запишемо стехіометричне рівняння деякої хімічної реакції в загальному вигляді: aA + bB cC + dD ( І )
де a, b, c, d – стехіометричні коефіцієнти; A, B – вихідні речовини; C, D – продукти реакції.
Згідно закону збереження маси сумарна маса утворених речовин C і D повинна бути рівна сумарній масі перетворених речовин A і B. Оскільки в хімічних реакціях
20
речовини витрачаються й утворюються в мольних співвідношеннях, то для матеріального балансу більш зручно користуватися їх мольними кількостями: n(A), n(B), n(C) і n(D). Якщо маси речовин позначити m(A), m(B), m(C) та m(D) [г, кг], а їх молекулярні маси – M(A), M(B), M(C) і M(D) [г/моль, кг/моль], то кількості речовин (моль) будуть виражатися як:
n(A) = m(A)/M(A); n(B) = m(B)/M(B); n(C) = m(C)/M(C); n(D) = m(D)/M(D) (3.1)
Виходячи з початкових кількостей вихідних речовин no(A) і no(B), для простої реакції (І) матеріальний баланс можна виразити наступними рівностями:
|
no( A) n( A) |
no( B) n(B) |
n(C ) |
n(D ) |
|
|||||
|
|
|
|
|
|
|
|
|
. |
(3.2) |
|
|
|
|
|
||||||
|
|
a |
b |
c |
d |
|
||||
При проведенні |
реакцій в розчинах невисокої |
концентрації об'єм |
розчину |
|||||||
практично не змінюється (V = const), тому в рівностях (3.2) кількості речовини в моль можна замінити на їх концентрації C в моль/л, що визначаються так:
C0(A) = n0(A)/V; C(A) = n(A)/V; C0(B) = n0(B)/V і т.д. (3.3)
Коли процес взаємодії розчинених речовин між собою (деколи і з розчинником) дійде до стану рівноваги, в розчині встановляться рівноважні концентрації.
Для позначення рівноважної концентрації в літературі використовують квадратні дужки [ ], в які заключають хімічну формулу речовини, наприклад, [CH3COOH], [H+], [A] = n(A)/V, [B] = n(B)/V і т.п.
Тепер матеріальний баланс при досягненні рівноваги можна представити наступними рівностями:
|
Co( A) [ A] |
|
Co(B) [B] |
|
[C] |
|
[D] |
. |
(3.4) |
|
a |
b |
c |
d |
|||||||
|
|
|
|
|
|
де C0(A) і C0(B) - початкові (вихідні) концентрації речовин A і B; [A], [B], [C] і [D] – рівноважні концентрації речовин A, B, C і D.
Якщо деяка з речовин розпадається на йони і в розчині встановлюється рівновага між усіма формами існування цієї речовини, то сума концентрацій всіх рівноважних форм буде рівна її загальній концентрації. Наприклад, у водному розчині H2S встановлюється рівновага між молекулами H2S та йонами HS– і S2–. Очевидно, рівняння
матеріального балансу цього процесу матиме вигляд: |
|
C0(H2S) = [H2S] + [HS–] + [S2–]. |
(3.5) |
Для розчину повинна справджуватися також умова |
електронейтральності: |
сумарний заряд усіх йонів рівний нулю. Наприклад, у водному розчині сірководню внаслідок дисоціації H2S та самоасоціації води існують йони H+, HS–, S2– і OH–, тому умову електронейтральності за концентраціями можна записати:
[H+] + [HS–] + 2[S2–] + [OH–] = 0. |
(3.6) |
Для розчину соди, яка розпадається на йони: Na2CO3 2Na+ + CO32–
і частково гідролізує:
CO32– + H2O HCO3– + OH–;
HCO3– + H2O H2CO3 + OH–;
H2O H+ + OH–
