
лекції
.pdf101
їх концентрацiя зменшиться до C1 = CoVo/(Vo + V), а при повторнiй промивцi – до C2 = =C1Vo/(Vo + V) = Co[Vo/(Vo + V)]2. Пiсля n промивок концентрацiя домiшок в маточному розчинi складе
|
|
V |
o |
n |
|
|
Cn |
|
|
|
Co , |
(12.7) |
|
|
|
|||||
|
|
|
|
|||
|
Vo V |
|
|
|||
де n – число промивань; Vo – об'єм маточного розчину, що залишився в осадi пiсля фiльтрацiї; Сo – концентрацiя забруднюючих домiшок в цьому розчинi, г/мл; V – об'єм промивної рiдини для одного промивання.
Як промивну рiдину переважно застосовують воду. Іноді беруть розчин солi амонiю, що має спiльний йон з осадом, щоб зменшити втрати при промиваннi. Треба враховувати також можливiсть гiдролiзу при промиваннi та схильнiсть осаду до пептизацiї (утворення колоїдного розчину). Осади, що можуть гiдролiзуватися, промивають розчином реагенту, що пригнiчує гiдролiз або неводним розчинником (часто спиртом), а схильнi до пептизацiї осади – розчином солi амонiю або iншим електролiтом. Як промивний розчин деколи застосовують насичений розчин сполуки, що випала в осад, наприклад, осади PbSO4 промивають насиченим розчином цiєї сполуки.
12.5. Вимоги до гравiметричної форми.
Гравiметричну форму – сполуку придатну для зважування, одержують внаслiдок висушування або прожарювання осаду. Критерiєм досягнутої повноти перетворення форми осадження в гравiметричну форму є наближення до постiйної маси, тобто повнота видалення летких домiшок – розчинника, адсорбованих солей амонiю, продуктiв розкладу.
Основнi вимоги до гравiметричної форми:
-необхiднiсть точної вiдповiдностi її складу певнiй хiмiчнiй формулi, так як тiльки тодi за масою осаду можна розрахувати вмiст аналiзованого компоненту в пробi;
-бути стiйкою в деякому iнтервалi температур при прожарюваннi та залишитися стiйкою на повiтрi при кiмнатнiй температурi, тобто не бути гiгроскопiчною, не вступати в реакцiї з CO2 та О2 оточуючої атмосфери;
-бажана велика вiдносна молярна маса сполуки, щоб забезпечити вiдповiдно низький фактор перерахунку, або гравiметричний фактор f.
12.6. Розрахунки в гравiметричному аналiзi .
а) Розрахунок величини проби.
Наважку проби mo, необхідної для виконання аналізу, розраховують, виходячи з рекомендованої маси гравiметричної форми, яка рiвна:
-для кристалiчних осадiв до 0,5 г;
-для аморфних осадiв ~ 0,1 г.
Враховуючи стехiометрiю перетворення аналізованої речовини (АР) в гравіметричну форму (ГФ)
aAР bГФ,

102
молярнi маси аналізованої речовини М(АР) та гравiметричної форми М(ГФ), а також можливу масову частку її в наважцi (%), величину наважки (в г) для кристалічних осадів, знаходимо як:
mo |
0.5aM( AP) |
|
100 |
, |
(12.8) |
|
|
||||
|
bM( ГФ) |
|
|||
де a, b - стехіометричні коефіцієнти, або для аморфних осадів за формулою: |
|
||||
mo |
0.1aM( AP) |
|
100 |
. |
(12.9) |
|
|
||||
|
bM( ГФ) |
|
|||
Наважку проби зважують на аналiтичних терезах в бюксах, на годинниковому склi, в ампулах i т.п.
б) Визначення кiлькостi розчинника.
Як розчинник проби використовують воду, розчини кислот або лугiв, сумiшi кислот. Якщо форма осадження кристалiчна, то розбавляють пробу для одержання ~ 0.1 М розчину, тобто об'єм розчинника знаходять як:
V |
mo1000 |
, мл |
(12.10) |
|
|||
|
M( AP)0.1 |
|
|
Якщо ж форма осадження має аморфну структуру, то наважку розчиняють в мiнiмальнiй кiлькостi розчинника з метою одержання концентрованого розчину.
в) Розрахунок кiлькостi осаджувача.
Об'єм розчину осаджувача розраховують, виходячи з можливого максимального вмiсту визначуваного компоненту в пробi за стехiометричними рiвняннями. Осаджувач беруть у 1.5-кратному надлишку від розрахованого.
г) За масою гравiметричної форми m(ГФ) можна обчислити вмiст визначуваного компоненту т(АР), користуючись молярними масами та стехiометричними коефiцiєнтами, наприклад, вмiст сiрки в гравiметричнiй формi BaSO4:
m(BaSO4) – m(S), M(BaSO4) – M(S)
Вiдповiдно, маса чистої сiрки
m(S ) m( BaSO4 ) |
M(S ) |
, |
|
(12.11) |
|
|
|
||||
|
M(BaSO4 ) |
|
|||
В загальному випадку: |
|
||||
т(ГФ) – т(AР), |
|
||||
М(ГФ) – рM(АР), |
|
||||
m(AP) m(ГФ) |
pМ(АР) |
, |
(12.12) |
||
|
|||||
|
|
М(ГФ) |
|
||
де f( AP) pМ( АР) – гравiметричний фактор (величина постiйна).
М( ГФ)
Гравіметричний фактор рівний відношенню молярної (атомної) маси визначуваного компоненту до молярної маси гравіметричної форми з врахуванням множників еквівалентності (p). Тому
103
m(AР) = f(AР)m(ГФ), |
(12.13) |
||
( AP) f( AP)m( ГФ) |
100 |
%. |
(12.14) |
|
|||
mо
Наприклад, для гравіметричної форми Fe2O3 при визначенні чистого заліза
Fe2O3 2Fe
f(Fe) = 2M(Fe)/M(Fe2O3) = 2 55.847/159.694 = 0.6994,
відповідно,
m(Fe) = 0.6994m(Fe2O3).
13. КОМПЛЕКСОНОМЕТРИЧНI МЕТОДИ АНАЛIЗУ
Реакцiї комплексоутворення широко використовуються в аналiтичнiй хімiї як для якiсного виявлення катiонiв та анiонiв, так i для їх кiлькiсного визначення.
Комплексними сполуками вважають речовини, утворені двома або більшим числом частинок, здатних до самостiйного iснування в розчинi. Однiєю з частинок переважно є додатнiй йон металу, що називається центральним йоном, або комплексоутворювачем.
Безпосередньо з центральним атомом зв'язанi лiганди (йони з вiд’ємним зарядом або нейтральнi молекули), якi складають внутрішню координаційну сферу сполуки.
Крiм внутрiшньої сфери, iснує також i зовнішня координаційна сфера, яку складають зовнiшнi йони з додатним або вiд’ємним зарядом, наприклад, K4[Fe(CN)6], K3[Fe(CN)6], K2[HgJ4], [Ag(NH3)2]Cl, [Cu(NH3)4]SO4, Na3[Co(NO2)6] та iншi.
Важливою характеристикою координацiйної сполуки є координаційне число, яке показує, скiльки атомiв або атомних груп зв'язано з центральним атомом (найчастiше 6
та 4, рiдше – 2, 8, іноді – 3, 5).
Лiганди характеризуються детантністю (detantus – зубчатий), тобто, здатнiстю займати певне число координацiйних мiсць бiля центрального йона. Монодетантнi лiганди: OH–, F–, NH3 та iншi; бiдетантнi лiганнди: етилендiамiн, диметилглiоксим, C2O42– та iншi. Iснують п'ятита шестидетантнi лiганди та лiганди з ще вищою детантнiстю.
Полiдентатнi лiганди при реакцiях з йоном металу переважно утворюють координацiйнi сполуки, що мiстять цикл, наприклад,
Cu2+ + NH2CH2COO- |
|
Cu |
O |
|
|
|
|
|
C |
|
O |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
||||
|
+ |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
CH2 |
|
||||
гліцинат |
|
|
N H2 |
|
|
|
|
|
||||
|
|
|
|
|
|
|||||||
Нерiдко в молекулi координацiйної сполуки є два, три або бiльше циклiв. Особливо мiцнi координацiйнi сполуки утворюють лiганди, що мiстять п'ятиабо шестичленнi цикли, утворенi молекулами органiчних сполук. Для аналiзу такi сполуки були застосованi Iльїнським М.А., який запропонував ще в 1884 р. –нiтрозо– –нафтол для виявлення йонів кобальту. Фундаментальнi дослiдження в цiй галузi провiв Л.А.Чугаєв, який в 1905 р. запропонував органiчний реагент – диметилглiоксим, що досi є кращим реагентом для аналiзу йонів нiкелю.
104
Згодом координацiйнi сполуки з одним або декiлькома циклами почали називати хелатними (chelate – клешня), або просто хелатами. Типовими хелатами є сполуки йонiв з комплексонами, якi мають широке застосування в сучаснiй аналiтичнiй хімiї.
Комплексонами називають похідні полiамiнополiкарбонових кислот, найпростiшим представником яких є iмiнодіоцтова кислота:
HOС(O)CH2–NH–CH2C(O)OH.
У водному розчинi вона має бетаїнову структуру, тобто, iснує у виглядi бiполярного, так званого цвіттер-йона:
HOС(O)CH2–N+H2–CH2C(O)O– + Н+ HOС(O)CH2–N+H2–CH2C(O)OH.
В кислому розчинi бiполярний цвiттер-йон перетворюється в позитивно заряджений йон.
Комплексоном I називають нiтрилтриоцтову кислоту (НТА): |
|
|
(HOC(О)CH2)3N |
H3Y. |
|
Широко вiдомим представником комплексонiв є етилендiамiнтетраоцтова кислота |
||
(ЕДТО), або комплексон II: |
|
|
(HOC(О)CH2)2NCH2CH2N(CH2C(O)OH)2 |
|
H4Y, |
який у водному розчинi також iснує як цвiттер-йон: |
|
|
–(OC(О)CH2)(HOC(О)CH2)NCH2CH2N(CH2C(O)OH)(CH2C(O)O)– |
H2Y2– |
|
i при пiдкисленнi переходить в шестиосновний катiон. Застосовується також динатрiєва сiль ЕДТО, вiдома пiд назвою трилон Б або комплексон III.
ЕДТО (H4Y) – безбарвна, погано розчинна в водi та етанолi речовина, яка з бiльшiстю йонiв металiв утворює розчиннi у водi стiйкi комплекснi сполуки.
Сiль ЕДТО (Na2H2Y) або етилендіамінтетрацетат натрію (ЕДТА) – бiла, дрiбнокристалiчна речовина, добре розчинна у водi, розчинах лугiв та сильних кислот. Хімiкоаналiтичнi властивостi солi ЕДТА iдентичнi властивостям її кислотної форми. Через кращу розчинність у водi провідна роль у практицi неорганiчного аналiзу належить комплексону III, тому всi питання комплексонометрiї будемо розглядати на прикладi використання цього реактиву.
Рiвноваги в розчинах комплексонiв мають досить складний характер. У водному
розчинi ЕДТО мають мiсце наступні рiвноваги: |
|
|
||
H4Y H+ + H3Y– |
K1 = 1 10–2 |
pK1 = 2, |
||
H3Y– H+ + H2Y2– |
K2 |
= 1.74 10–3 |
pK2 |
= 2.76, |
H2Y2– H+ + HY3– |
K3 |
= 6.92 10–7 |
pK3 |
= 6.16, |
HY3– H+ + Y4– |
K4 |
= 5.50 10–11 |
pK4 |
= 10.26. |
Як показують розрахунки, при будь-якому значеннi рН в межах 0.5 – 3.0 у розчинi одночасно присутнi в помiтних кiлькостях 3-4 частинки i частка жодної з них не перевищує 50 %.
13.1. Комплексота комплексонометричнi методи титрування.
Титриметричнi методи аналiзу, основанi на реакцiях утворення комплексних сполук, називають комплексометричними методами. Як i в iнших методах, хімiчнi реакцiї, що використовуються в комплексометрiї, повиннi задовільняти наступним вимогам:
-повинна протiкати тільки одна реакцiя, яка вiдповiдає певнiй стехiометрiї;
-реакцiя повинна протiкати досить швидко;
-комплексна сполука, що утворюється, повинна мати велику стiйкiсть, тобто реакцiя повинна мати достатньо велику константу рiвноваги.
105
Реакцiї комплексоутворення з неорганiчними лiгандами дуже рiдко задовільняють наведеним вимогам. Найбiльше поширення одержали наступнi методи комплексометричного титрування:
1) Меркуріметрія, основною реакцiєю якої є взаємодiя: Hg2+ + 2X– HgX2,
де Х = Cl–, Br–, SCN– та деякi iншi йони.
Стандартним розчином у методi меркурiметрiї є розчин Hg(NO3)2, точну концентрацiю якого встановлюють за розчином NaCl. Як iндикатор застосовують нiтропрусид натрiю Na2[Fe(CN)5NO], який з йоном Hg2+ утворює бiлий дрiбнокристалiчний осад Hg[Fe(CN)5NO] з ДР = 1 10–9. Ефективними iндикаторами в меркурiметрiї також є дифенiлкарбазид та дифенiлкарбазон, якi утворюють з Hg2+ синьо-фiолетовий барвник.
2) Комплексонометрія (хелатометрія), розпiзнавальною особливiстю якої є здатнiсть до утворення циклiчних комплексних сполук (хелатiв) з йонами рiзних металiв.
В молекулах комплексонiв мiстятся групи, якi мають основнi та кислотнi властивостi. До груп з основними властивостями належать: третинна N, первинна –NH2, iмiно- =NH, оксимна =N–OH, карбонiльна =C=O та iншi групи, якi здатнi утворювати з йонами металiв донорно-акцепторнi зв'язки за рахунок неподiлених електронних пар атомiв нітрогену чи оксигену. Кислотнi групи мiстять йони H+, якi здатнi замiщуватися на йони металу за рахунок головної валентностi. Це карбоксильна група –C(O)OH, а також сульфоксильнi –SO3H, гiдроксильнi –OH та iншi групи.
При утвореннi хелатної сполуки йон металу утворює зв'язки, одночасно замiщуючи йон водню та координуючись за рахунок неподiлених електронних пар донорних атомiв таким чином, щоб найкраще задовольнити координацiйнi та геометричнi вимоги йону металу.
ЕДТА мiстить 4 карбоксильні групи (–COO–) та 2 групи з атомами нітрогену, тому координацiйна сфера йонiв металiв з координацiйними числами 4 та 6 може бути повнiстю заповнена.
Реакцiї взаємодiї рiзних катiонiв з ЕДТА в розчинi протiкають за рiвняннями: Ca2+ + H2Y2– CaY2– + 2H+,
Bi3+ + H2Y2– BiY– + 2H+,
Zr4+ + H2Y2– ZrY + 2H+.
Як бачимо, незалежно вiд заряду катiона в реакцiї комплексоутворення приймає участь один аніон ЕДТА та утворюється 2 йони водню. Склад утвореної сполуки завжди Ме:L = 1:1, тому молярні маси еквівалента титранта та визначуваного катіона завжди рiвнi їх молярним масам.
З наведених вище рiвнянь випливає, що ступiнь протiкання реакцiй залежить вiд рН розчину. Вплив кислотностi розчину особливо помiтний при титруваннi катiонiв, що утворюють порiвняно малостiйкi комплекси (Mg2+, Ca2+ та iншi): їх можна вiдтитрувати лише в лужному середовищi. Багато з катiонiв вiдтитровуються в амiачному буферному розчинi, а катiони, що утворюють дуже стiйкi комплекси, наприклад Fe3+, можуть бути вiдтитрованi в досить кислому середовищi.
Комплексонати металiв мiстять рiзне число хелатних циклiв. Так йони Zn2+, Cd2+, Ca2+ та iнших металiв з координацiйним числом = 4 мiстять по три пятичленних цикли:
106
HOOCCH2 CH2CH2 CH2COOH
|
|
|
+ |
2 |
+ |
|
|
|
|
|
||
|
H2C |
N |
Me2+ |
N |
||||||||
|
1 |
|
3 |
|
|
CH2 |
||||||
|
||||||||||||
O |
|
C |
|
O |
O |
|
|
|
|
|
|
O |
|
|
C |
|
|||||||||
|
|
|
|
|||||||||
|
|
|
|
|
||||||||
|
|
|
|
|
||||||||
Для дво-, трита чотиривалентних металiв з координацiйним числом = 6 (Al3+, Co2+, Fe3+ та iнших) число хелатних циклiв рiвне 5:
|
|
|
|
|
|
|
|
H C |
|
CH2 |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
2 |
1 |
|
|
|
|
|
|
|
|
|
|
|
||
|
H2C |
|
|
|
+ |
|
|
+ |
|
|
|
|
|
|
|
||||||
|
|
|
|
N |
|
|
|
N |
|
|
|
CH |
|||||||||
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
H2C |
3 |
|
Ce4+ |
2 |
CH2 |
2 |
|
|||||||||
|
|
|
4 |
|
|
5 |
|
|
|
||||||||||||
|
|
|
O C |
|
O |
|
|
O |
|
C O |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
||||||||||||||
O |
|
C |
|
|
|
O |
|
O |
|
|
|
|
|
|
C |
|
O |
||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Бiльше число хелатних циклiв в комплексонатах та пов'язаний з цим хелатний ефект є однiєю з головних причин високої стiйкостi цих сполук.
Iснує просте правило, яке дозволяє вибирати орiєнтовне значення рН розчину, необхiдне для здiйснення реакцiї комплексоутворення йона металу з комплексонами:
чим легше йон металу піддається гідролізу, тим в більш кислому середовищі протікає його взаємодія з ЕДТА.
Наприклад, йон Fe3+, що гiдролiзується при рН = 2, взаємодiє з ЕДТА в кислому середовищi; йон Ni2+, що слабо гiдролiзується вже в нейтральному середовищi, реагує з ЕДТА в нейтральному середовищi, а йон Ca2+, що практично не пiддається гiдролiзу, реагує з ЕДТА в лужному середовищi.
13.2. Рiвноваги в розчинах координацiйних сполук.
Важливою характеристикою комплексонатiв є їх стійкість. З метою порiвняння стiйкостi хелатiв рiзних металiв розглянемо рiвновагу гiпотетичної реакцiї комплексоутворення йонiв цих металiв з повнiстю депротонованим анiоном ЕДТА:
Men+ + Y4– MeYn–4.
Константа рiвноваги цiєї реакцiї комплексоутворення називається константою стійкості комплексної сполуки:
MeY |
|
[MeY n 4 |
] |
|
. |
(13.1) |
|
[Men ][Y |
4 |
] |
|||||
|
|
|
|
Константи стiйкостi деяких комплексонатiв наведенi в таблицi 8.
Таблиця 8
Константи стiйкостi деяких комплексонатiв.
Комплексонат |
lg MeY |
Комплексонат |
lg MeY |
NaY |
1.79 |
CdY |
16.46 |
BaY |
7.78 |
NiY |
18.62 |
MgY |
9.12 |
CuY |
18.80 |
CaY |
10.59 |
TiY |
21.30 |
FeY |
14.20 |
HgY |
21.80 |
107
CoY |
16.31 |
FeY |
25.10 |
AlY |
16.13 |
ThY |
25.30 |
CeY |
16.10 |
ZrY |
29.50 |
Як бачимо, стiйкi комплексонати утворюють майже всi йони металiв, крiм лужних. В реальних умовах ЕДТА чотиризарядний анiон Y4– наявний тiльки в сильнолужних розчинах з рН = 10 – 12. При менших рН в станi Y4– буде перебувати тiльки частина з усiєї присутньої в розчинi кiлькостi ЕДТА. Якщо загальну концентрацiю всiх форм ЕДТА, що знаходяться в розчинi, позначити як C(EДТА), то з матерiального
балансу випливає:
С(ЕДТА) = [Y4–] + [HY3–] + [H2Y2–] + [H3Y–] + [H4Y]. |
(13.2) |
Ефективна концентрацiя анiонiв Y4– може бути виражена через загальну концентрацiю ЕДТА за допомогою спiввiдношення:
Y,H |
C(ЕДТА) |
, |
(13.3) |
|
|||
|
[Y4 ] |
|
|
де Y,H – коефіцієнт побічної реакції ЕДТА.
Величини lg Y,H для ЕДТА залежать вiд рН розчину i наведенi в таблицi 9.
Таблиця 9
|
Залежність величини lg Y,H |
для ЕДТА від рН розчину. |
|
|
||||||||||
рН |
1 |
2 |
3 |
4 |
5 |
6 |
|
7 |
8 |
9 |
10 |
11 |
12 |
13 |
lg Y,H |
18.0 |
13.5 |
10.6 |
8.4 |
6.5 |
4.7 |
|
3.3 |
2.3 |
1.3 |
0.45 |
0.007 |
0.01 |
0 |
Користуючись коефiцiєнтами побiчної реакцiї Y,H та константами стiйкостi MeY, можна кiлькiсно охарактеризувати рiвновагу комплексоутворення при заданiй величинi рН розчину. Константа рiвноваги, що характеризує цей процес, називається умовною
константою рівноваги MeYум: |
|
|
|
|
MeY |
ум |
MeY |
. |
(13.4) |
|
||||
|
|
Y,H |
|
|
За допомогою умовних констант стiйкостi досить добре описується реальна рiвновага в системi йон металу – комплексон при заданому значенні рН розчину.
13.3. Кривi комплексонометричного титрування.
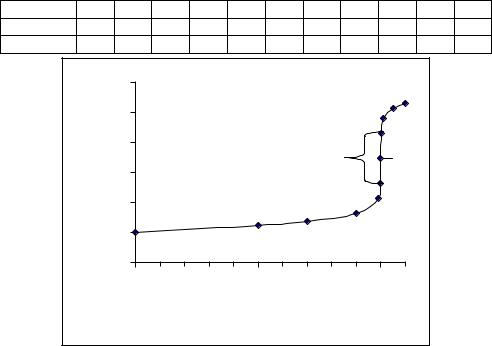
Змiну концентрацiї йонiв металу в процесi титрування комплексонами, наприклад, ЕДТА, вiдображає крива титрування, яку будують в координатах рМe – VY, де рМe = – lg[Men+]; VY – об'єм прилитого титранту.
Розрахуємо криву титрування 100 мл 0.01 M розчину FeCl3 розчином ЕДТА такої ж
концентрацiї (рис. 9). Як видно з рiвняння
Fe3+ + H2Y2– = FeY– +2H+,
при титруваннi видiляються йони водню, вiд концентрацiї яких залежить Y,H. Константа стiйкостi FeY– (lg FeY- = 25.10).
В початковiй точцi кривої титрування, коли титрант ще не прилитий, pFe = –lg 0.01 = 2.00.
При доливаннi 50 мл 0.01 M H2Y2– концентрацiя утвореного комплексонату FeY– стане рiвною:

108
[FeY ] 0.01 50 x 0.00333 x, 100 50
де x = [Y4–] – концентрацiя лiганда, не зв'язаного в FeY–.
Концентрацiя йонiв водню, згiдно стехiометричного рiвняння, буде приблизно у 2 рази бiльшою (при цьому малою величиною х можна знехтувати):
[H+] = 0.00333 2 = 0.0666; |
pH = 2.18. |
Концентрацiю йонiв залiза, що залишилися у розчинi, з врахуванням розведення знаходимо як
[Fe3 ] 0.01 100 (0.00333 x) 0.00333 x . 150
З таблицi 9 iнтерполюванням знаходимо lg Y,H = 12.94 при рН = 2.18; вiдповiдно,
lg FeY-ум = 25.10 – 12.94 = 12.16; |
FeY-ум = 1.46 1012. |
|
||
Пiдставляючи концентрацiї [FeY–], [Fe3+] та [Y4–] у вираз (13.4) |
для умовної |
|||
константи стiйкостi |
|
|
|
|
|
0.00333 x |
1.46 1012 , |
|
|
|
(0.00333 x)x |
|
||
|
|
|
|
|
знаходимо x = 6.85 10–13 моль/л. Вiдповiдно, концентрацiя йонiв залiза
[Fe3+] = 0.00333 + 6.85 10–13 = 0.00333 M; pFe = 2.48.
Аналогiчним способом розраховуємо pFe для iнших точок: 70, 90, 99 та 99.9 мл титранта i заносимо результати в таблицю 10.
В точцi еквiвалентностi [Fe3+] = [Y4–] = x, а концентрацiя йонiв водню буде у 2 рази бiльшою, нiж [FeY–].
[H+] = 2[FeY–] |
0.01 100 |
2 = 0.01; |
pH = 2 |
|
200 |
||||
|
|
|
i надалi буде залишатися практично сталою.
З таблицi 9 iнтерполюванням знаходимо вiдповiдний коефiцiєнт побiчної реакцiї lg Y,H = 13.516 при рН = 2 i lg FeY-ум = 25.10 – 13.516 = 11.584; FeY-ум = 3.84 1011.
Пiдставляючи значення концентрацiй [FeY–]=(0.005 – x) у вираз умовної константи стiйкостi
FeY-ум = 3.84 1011 = 0.005 x , x2
знаходимо x = [Fe3+] = 1.14 10–7 моль/л та pFe = 6.94.
Пiсля точки еквiвалентностi надлишок прилитого ЕДТА збiльшує концентрацiю йонів Y4–, що буде приводити до пониження [Fe3+]. Наприклад, для надлишку 0.1 мл
С(ЕДТА) = 0.1 0.01/200 = 5 10–6 M
i згiдно (13.2)
[Y4–] = 5 10–6 M.
Пiдставляючи вiдомi значення [Y4–], [FeY–] 0.01/2 = 0.005 M та невiдому концентрацiю йонів Fe3+ в рiвняння умовної константи рівноваги
FeY-ум = 3.84 1011 = |
0.005 |
|
, |
|
5 10 6 [Fe3 |
] |
|||
|
|
знаходимо [Fe3+], розв'язуючи наведене рівняння:
109
[Fe3+] = 2.61 10–9 моль/л; pFe = 8.58.
Аналогiчним чином обчислюємо концентрацiю йонiв Fe3+ для бiльших надлишкiв прилитого титранту 1, 5 i 10 мл. Результати обчислень заносимо в таблицю 10.
Таблиця 10
VY, мл |
Залежність рН і pFe від об’єму прилитого титранту |
|
|||||||||
0 |
50 |
70 |
90 |
99 |
99.9 |
100 |
100.1 |
101 |
105 |
110 |
|
pH |
7.0 |
2.18 |
2.08 |
2.02 |
2.00 |
2.00 |
2.00 |
2.00 |
2.00 |
2.00 |
2.00 |
pFe |
2.0 |
2.48 |
2.75 |
3.28 |
4.30 |
5.30 |
6.94 |
8.58 |
9.58 |
10.28 |
10.58 |
|
pFe |
12 |
|
|
|
Лінія еквівалентності |
|
|
|||
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
8 |
|
|
|
Стрибок |
|
т.е. |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
6 |
|
|
титрування |
|
|
|
|||
|
|
|
|
|
|
|
|
||||
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
50 |
|
|
100 |
|
|
|
|
|
|
|
|
|
|
|
|
V Y, мл |
|
|
Рис. 9. Крива титрування 0.01 М розчину FeCl3 стандартним розчином ЕДТА. Поблизу точки еквiвалентностi спостерiгається стрибок титрування:
pFe = 8.58 – 5.30 = 3.28.
Як специфiчні iндикатори можуть бути використанi роданiди або салiцилати, що дають з Fe3+ забарвленi продукти.
З металохромних iндикаторiв найкращим буде ксиленоловий оранжевий, який буде змiнювати забарвлення вiд червоного до жовтого.
Величина стрибка титрування залежить вiд багатьох факторiв:
-концентрацiї йонiв металу;
-концентрацiї допомiжних комплексоутворювачiв;
-рН розчину;
-константи стiйкостi комплексонату.
Наприклад, при титруваннi Ca2+ розчином ЕДТА найбiльший стрибок спостерiгається при рН = 12, так як в цьому випадку lg -ум =10.58, тобто найбiльший.
13.4. Способи фiксування точки еквiвалентностi.
Якщо до нейтрального розчину солi металу долити надлишок стандартного розчину ЕДТА, то згiдно рiвняння реакцiї розчин стане кислим:
Men+ + H2Y2– MeYn–4 + 2H+
110
i кислоту, що утворилася, можна вiдтитрувати лугом iз звичайними кислотно-основними iндикаторами. Цiлком зрозумiло, що така методика може бути застосована для невеликої групи йонiв, якi утворюють стiйкi комплексонати в кислому середовищi.
Можна використовувати iнструментальнi методи (чутливi електроди) для реєстрацiї змiни рМe в процесi титрування.
Бурхливий розвиток комплексонометрiї привiв до вiдкриття т.з. металоіндикаторів – речовин, що утворюють з йонами металiв iнтенсивно забарвленi сполуки. Забарвлення таких сполук повинно рiзко вiдрiзнятися вiд забарвлення вiльних молекул iндикатора.
Якщо в розчин з йонами визначуваного металу ввести металоiндикатор, то утвориться комплексна сполука i розчин забарвиться у певний колiр, наприклад,
Me2+ + 2HInd |
|
MeInd2 + 2H +. |
синій |
|
вишневий |
При титруваннi такого розчину ЕДТА утворюється бiльш стiйка комплексна сполука MeY2–, нiж MeInd2, тому невеликий надлишок ЕДТА руйнує металоiндикаторний комплекс з вивiльненням вихiдних молекул, що призводить до встановлення початкового забарвлення розчину:
MeInd2 + H2Y2– 2HInd + MeY2–.
вишневий синiй
Важливо, щоб металоiндикатор та його комплекс з йоном металу були розчиннi у
водi.
Чiтке i правильне встановлення точки еквiвалентностi можливе при дотриманнi таких умов:
-комплекс iндикатора з iонами металу повинен мати достатню стiйкiсть,
(MeInd2)ум > 10–4;
-комплексонат йона металу з титрантом повинен бути набагато мiцнiшим, нiж
його комплекс з iндикатором,
(MeY2–)ум/ (MeInd2)ум > 102C(Me)C(ЕДТА)
-добавка iндикатора не бiльше 1 % вiд концентрацiї визначуваного йона повинна забезпечувати iнтенсивне забарвлення розчину;
-змiна забарвлення iндикатора в точцi еквiвалентностi повинна протiкати чiтко i швидко.
Найчастiше як металоiндикатори використовуються азобарвники (ерiохромовий чорний Т), барвники трифенiлметанового ряду (ксиленоловий оранжевий, пiрокатехiновий фiолетовий) та сполуки, якi дають вибiрковi кольоровi реакцiї з деякими iонами металiв (мурексид, тайрон, тiосечовина та iншi).
Еріохромовий чорний Т (ЕХЧ-Т) мiстить о,о-диоксiазофункцiональну аналiтичну групу i здатний утворювати хелати з йонами рiзних металiв:
