
Киреев Оптические методы детектирования долгоживусчих изотопов ёда 2010
.pdf
Глава 5. Флуоресценция диоксида азота
Диоксид азота был получен путем разложения нитрата свинца Pb(NO3)2 при нагревании свыше 200 ОС:
Pb(NO3)2 ® PbO2 + 2NO2
Далее диоксид азота подвергался двойной очистке посредством перегонки через слои фосфорного ангидрида(P2O5) и кварцевой ваты для поглощения паров воды при одновременной откачке газообразных примесей (в основном О2) при перегреве:
3PbO2 ® Pb3O4 + O2
1
2
Рис. 5.2. Зависимости величины ln(I0/I) от давления диоксида азота на длинах волн 0,44 (1) и 0,63 мкм (2)
Для измерений концентрацииNO2 флуоресцентным методом, прежде всего, необходимо определить величину его коэффициента резонансного поглощения на длинах волн излучения используемых лазеров. Поскольку применялось лазерное излучение относительно небольшой мощности, величину коэффициента поглощения можно считать независимой от интенсивности лазерного излучения, и в этом приближении описывать поглощение законом Бугера:
I = I0 ×exp(-σ×[NO2 ]×L) ,
где I0, I – мощности лазерного излучения до и после измерительной ячейки соответственно; L – длина ячейки.
151

Глава 5. Флуоресценция диоксида азота
Из этого выражения следует, что:
σ = |
1 |
|
ln(I0 |
/ I ) . |
|
[NO2 ]×L |
|||||
|
|
|
|||
Для определения коэффициентов и сечений поглощения исследовались зависимости интенсивностей лазерного излучения, прошедшего через ячейку, от давления NO2 (рис. 5.2).
Определенные по наклону данных зависимостей значения сечений поглощения диоксида азота составили9,9·10-21 см2 на длине волны 0,63 мкм и 2,1·10-20 см2 на длине волны 0,44 мкм.
Следующим шагом в исследовании флуоресценции диоксида азота было изучение влияния буферных газов на величину коэффициентов поглощения NO2. С этой целью проводились измерения прошедшей через ячейку интенсивности лазерного излучения при напуске в нее атмосферного воздуха при постоянной концентрации диоксида азота. Полученные результаты представлены на рис. 5.3 и 5.4.
Рис. 5.3. Зависимость коэффициента поглощения NO2 на длине волны 0,63 мкм от давления воздуха (давление NO2 = 1 Торр)
152

Глава 5. Флуоресценция диоксида азота
Рис. 5.4. Зависимость коэффициента поглощения NO2 на длине волны 0,44 мкм от давления воздуха (давление NO2 = 1,7 Торр)
Как видно, зависимости ведут себя по-разному. Так, на длине волны 0,63 мкм величина коэффициента поглощения диоксида азота a = s·[NO2] уменьшается более чем в2 раза при увеличении давления воздуха до 250 Торр, а на длине волны 0,44 мкм значения a практически не меняются до давлений порядка 300 Торр, и лишь затем начинают медленно уменьшаться– при атмосферном давлении воздуха в ячейке величина снижения сечения поглощения составляет приблизительно 25%.
Такое различие в поведениях коэффициентов поглощения диоксида азота связано, по-видимому, с существенно более высокой плотностью взаимоперекрывающихся линий поглощения в синей области спектра (по сравнению с красной), дающих интегральный усредненный вклад в суммарное поглощение, слабозависящий от уширения отдельной линии поглощения при изменении давления буферного газа.
153

Глава 5. Флуоресценция диоксида азота
При этом полученный на длине волны 0,44 мкм результат существенно отличается от результатов для молекулярного йода, для которого значения коэффициентов поглощения сильно зависят от давления (для различных линий поглощения йода значениеa может увеличиваться или уменьшаться в несколько раз).
Аналогичные измерения были проведены и с другими буферными газами, которые впоследствии использовались для исследования процессов безызлучательной релаксации диоксида азота.
5.3. Исследование процессов безызлучательной релаксации возбужденных состояний NO2
Определив сечения поглощения диоксида азота, можно перейти к измерению констант скоростей процессов безызлучательной релаксации NO2, знание которых необходимо для определения концентрации диоксида азота флуоресцентным методом. Рассмотрим вначале случай отсутствия буферных газов.
В отличие от йода, для которого ранее были измерены коэффициенты отдельных колебательно-возбужденных состояний, в случае диоксида азота, как уже отмечалось, излучением лазера возбуждается сразу большое количество близко расположенных колебательных уровней В-состояния.
Существенным является также следующее обстоятельство. Особенностью молекулы NO2 является аномально большое естественное время жизни возбужденных уровней(~ 10-4 – 10-5 с), обусловленное возмущениями этих уровней уровнями основного состояния диоксида азота [277, 282]. По этой причине столкновительный перенос энергии с возбужденных уровнейNO2, заселяемых лазером, происходит с большой эффективностью, и при давлениях буферных газов ≥ 100 мТорр распределение молекул по возбужденным уровням полностью определяется каскадными процессами переноса.
Вследствие этого для диоксида азота оказывается возможным измерить величины лишь эффективных констант, характеризующих процессы скоростей безызлучательной релаксации всей совокупности возбужденных энергетических состояний.
154

Глава 5. Флуоресценция диоксида азота
5.3.1. Самотушение флуоресценции NO2
Для определения коэффициентов самотушения флуоресценции диоксида азота исследовались зависимости интенсивности флуоресценции от давленияNO2 в измерительной ячейке на длинах волн 0,63 и 0,44 мкм и далее строились зависимости Штерна – Фольмера (см. гл. 2), приведенные на рис. 5.5 и 5.6.
Рис. 5.5. Экспериментальная зависимость Штерна – Фольмера на длине волны 0,63 мкм (P – давление диоксида азота,
F – интенсивность флуоресценции)
Определенные из этих зависимостей значения коэффициентов самотушения диоксида азота составили: 1,5×10-15 см3 на длине волны 0,63 мкм и 3,6×10-16 см3 на длине волны 0,44 мкм.
155

Глава 5. Флуоресценция диоксида азота
Рис. 5.6. Экспериментальная зависимость Штерна – Фольмера на длине волны 0,44 мкм (P – давление диоксида азота,
F – интенсивность флуоресценции)
5.3.2. Тушение флуоресценции NO2
Для определения констант тушения kB флуоресценции диоксида для различных буферных газов были получены зависимости коэффициента ослабления интенсивности флуоресценции D от концентрации буферного газаnB при заданной концентрации диоксида
азота nNO2 :
D(n |
|
|
α0 |
æ |
|
|
kB nB |
ö |
, |
||
|
) = |
|
ç1+ |
|
|
÷ |
|||||
|
|
|
1 |
+ k n |
|||||||
|
B |
|
α(n |
B |
) ç |
÷ |
|
||||
|
|
|
|
è |
|
|
s NO2 |
ø |
|
||
где a0 и a(nB) – коэффициенты поглощения NO2 при наличии и в отсутствие буферного газа соответственно, а введение в качестве множителя их отношения позволяло учесть зависимость коэффициента поглощения от давления в измерительной ячейке.
156
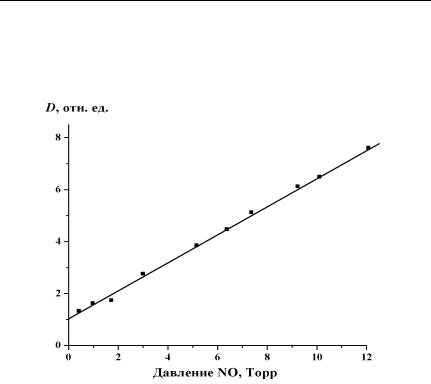
Глава 5. Флуоресценция диоксида азота
Исследования проводились на длине волны возбуждающего излучения 0,44 мкм. Полученные зависимости приведены на рис. 5.7 и 5.8.
Значения коэффициентов тушения флуоресценции приведены в табл. 5.1.
Рис. 5.7. Зависимость величины D от давления оксида азота на длине волны 0,44 мкм.
Давление диоксида азота составляет 1,8 Торр
Как и в случае тушения флуоресценции возбужденных состояний молекулярного йода, значения kB диоксида азота существенно различаются для разных буферных газов. Это различие можно объяснить, в частности, таким фактором, как характер взаимодействия сталкивающихся частиц. Поскольку частицы NO2 и буфера электрически нейтральны, то взаимодействие имеет характер диполь– диполь [260]. Таким образом, значения kB могут зависеть от параметров, определяющих дипольный момент буфера– собственного дипольного момента и поляризуемостиa, которая в случае отсутствия собственного дипольного момента приводит к возникновению наведенного дипольного момента.
157

Глава 5. Флуоресценция диоксида азота
В частности, для инертных газов, как следует из рис. 5.9, с возрастанием a интенсивность тушения флуоресценции увеличивается. Однако для других неполярных молекул (О2, Н2, N2), а также для полярных молекул эта зависимость нарушается.
Воздух
Рис. 5.8. Зависимость величины D от давления буферных газов на длине волны 0,44 мкм.
Давление диоксида азота составляет 1,8 Торр
Таблица 5.1
Газ |
Не |
Ne |
N2 |
Ar |
Воздух |
2 О |
|
Н2 |
NO |
Хе |
NO2 |
kB, 10-16 |
0,7 |
0,8 |
1,0 |
1,1 |
1,2 |
1,6 |
|
1,9 |
2,2 |
2,3 |
3,6 |
см3 |
|
||||||||||
sB, A2 |
1,4 |
2,6 |
4,4 |
4,2 |
5,0 |
7,4 |
|
3,9 |
8,6 |
13,8 |
18 |
158

Глава 5. Флуоресценция диоксида азота
о
А
Рис. 5.9. Зависимость коэффициентов тушения флуоресценции NO2 буферными газами от поляризуемости a молекул буфера
Кроме того, некоторые заключения качественного характера относительно эффективности тушения флуоресценцииNO2 различными буферными газами могут быть сделаны на основании
анализа возможных каналов тушения флуоресценции. В результате |
|
||
неупругого столкновения молекул диоксида азота и буфера, оче- |
|
||
видно, происходит |
энергетический обмен между |
двумя- |
мо |
лекулами, причем |
с возрастанием эффективности такого |
обмена |
|
вероятность тушения возбужденного уровняNO2 увеличивается. В этом отношении многоатомные молекулы отличаются от -одно атомных тем, что в процессе взаимодействия с молекулой NO2 мо-
гут изменять не только свою поступательную энергию, но и коле- бательно-вращательную (что является дополнительным каналом тушения флуоресценции). Вклад того или иного канала в суммарное тушение будет зависеть от ряда параметров: симметрии моле-
159

Глава 5. Флуоресценция диоксида азота
кулы и соответствующих правил отбора, а также величины колебательных и вращательных квантов энергии.
Таким образом, можно предположить, что относительная эффективность тушения флуоресценции NO2 буферными газами будет возрастать с увеличением количества атомов в молекуле буфера. Полученные результаты подтверждают приведенные выше рассуждения. Роль симметрии молекулы можно проследить, в частности, на примере молекул N2 и NO. Для молекулы азота, которая обладает колебательно-вращательными степенями свободы, константа тушения соответствует случаю одноатомных газов. Это свя-
зано, очевидно, с тем, что центрально-симметричная молекула N
2
не обладает собственным дипольным моментом, а, значит, соответствующие колебательно-вращательные переходы запрещены в дипольном приближении. В то же время молекула NO обладает небольшим дипольным моментом и, как следует из полученных результатов, степень тушения флуоресценцииNO2 оксидом азота примерно в 2,2 раза выше, чем у N2, что можно объяснить вкладом колебательно-вращательных каналов в тушение.
В заключение следует отметить хорошее согласие между константами тушения, вычисленными для кислорода, азота и атмосферного воздуха. Так, значение константы тушения для атмосферного воздуха, вычисленное на основании результатов измере-
ния соответствующих констант для О и N и известного процент-
2 2
ного содержания этих газов в атмосфере, в пределах погрешности совпало с величиной, наблюдающейся в эксперименте с атмосферным воздухом.
Измеренные значения kB были |
использованы для определения |
||
сечений тушения sB: |
|
|
|
σB = τ0kB |
mB |
, |
|
8πkT |
|||
|
|
||
где mB – приведенная масса молекул NO2 и буфера; t0 = 44 мкс (по данным [266]) – естественное время жизни возбужденного состояния NO2.
Соответствующие значения сечений тушения для рассматриваемых буферных газов представлены в табл. 5.1.
160
