
- •Государственное бюджетное образовательное учреждение высшего профессионального образования
- •Содержание
- •Список сокращений
- •Введение
- •І. Тема: белки
- •1. Строение и биологическая роль аминокислот, пептидов, белков
- •Аспарагиновая кислота (асп)
- •Лизин (лиз)
- •Серин (сер)
- •1.1. Первичная структура белка
- •1.2. Варианты вторичной структуры белка
- •1.3. Третичная структура белка
- •1.4. Четвертичная структура белка – высший уровень организации
- •Свойства протеинов
- •2.1. Физико - химические свойства биополимеров
- •2.2. Особенности биологических свойств белков
- •3. Методы очистки и выделения белков
- •4. Классификация белков
- •4.1. Простые белки
- •4.1.1. Глобулярные белки
- •4.1. 2. Фибриллярные белки
- •4.2. Сложные белки
- •Отличительные особенности строения углеводсодержащих белков
- •Характеристика липопротеиновых частиц
- •5. Биологическая роль протеинов
- •Вопросы для самоконтроля
- •Тестовые задания для оценки уровня знаний
- •Ситуационные задачи
- •II. Тема: ферменты
- •1. Особенности строения ферментов
- •1.1. Энзим – сложный белок
- •1.1.1. Природа и роль кофермента
- •Витамины – компоненты коферментов
- •1.1.2. Апофермент и его значение
- •1.2. Функциональные центры фермента
- •2. Энзимы как биокатализаторы
- •2.1. Теории, объясняющие механизм действия ферментов
- •I стадия. Образование es-комплекса
- •II стадия. Активация es-комплекса
- •III стадия. Образование eр-комплекса
- •IV стадия. Распад eр-комплекса
- •2.2. Специфичность действия энзимов
- •2.3. Кинетика ферментативных реакций
- •2.3.1. Зависимость скорости реакции от содержания субстрата
- •2.3.2. Влияние концентрации фермента на скорость реакции
- •2.3.3. Эффект колебаний температуры
- •2.3.4. Связь интенсивности процесса с величинами рН среды
- •3. Классификация, номенклатура ферментов
- •3.1. Классификация
- •2.1.1. Характеристика отдельных классов ферментов
- •4. Положительная и отрицательная регуляции работы ферментов
- •4.1. Механизмы аллостерической регуляции
- •4.2. Последствия белок - белкового взаимодействия
- •4.3. Регуляция путём ковалентной модификации
- •4.4. Частичный протеолиз как способ активации зимогена
- •Особенности конкурентного ингибирования
- •5. Использование ферментов в медицине
- •5.1. Энзимопатии
- •Энзимодиагностика
- •Энзимотерапия
- •Вопросы для самоконтроля
- •Тестовые задания для оценки уровня знаний:
- •Ситуационные задачи
- •Приложение № 1
- •Варианты правильных ответов на контрольные тесты
- •Список литературы
4. Классификация белков
Часть белков включает только аминокислоты, но обычно из-за их лигандности в организме формируются более сложные структуры. Поэтому их и классифицируют следующим образом (рис. 9):
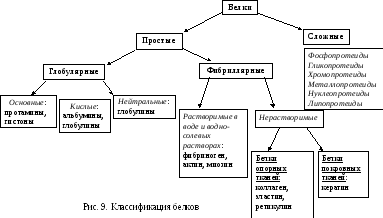
4.1. Простые белки
Простые белки – это биополимеры, состоящие только из аминокислот.
По форме они подразделяются на глобулярные и фибриллярные.
4.1.1. Глобулярные белки
Они довольно сложно организованы, имеют третичную структуру, поэтому растворимы в воде. Из-за направленности заряда их делят на:
Основные. В этих белках содержится много основных аминокислот (аргинина и лизина), что позволяет им приобретать положительный заряд, облегчая растворимость.
Наиболее яркие представители:
Протамины - самые маленькие низкомолекулярные белки (Мr 5000 Д), впервые выявлены в зрелой сперме некоторых рыб. Включают до 85% аргинина. Являются основными компонентами нуклеопротеидов хроматина ядра спермиев, а также полирибосом, что сохраняет и регулирует передачу генетической информации при делении клеток и между особями.
Г истоны
–белки
с большей, чем у протаминов, молекулярной
массой от 11 до 21 тыс. Д. Вклад основных
аминокислот лизина и аргинина меньше
и составляет от 20 до 30%. Это гетерогенная
фракция. Различают 5 классов гистонов:
Н1,
Н2а,
Н2b,
Н3,
Н4.
Их молекулы (кроме Н1)
легко взаимодействуют друг с другом,
образуя мультимеры – октамеры.
В свободном виде они не встречаются, а
входят в состав сложных белков –
нуклеопротеидов
(рис. 10), выполняя следующие функции:
структурную и регуляторную. Первая
заключается в формировании и стабилизации
пространственной компановки молекулы
ДНК. Вторая обусловлена тем, что –
находясь в связи с этим хранителем
информации, они блокируют её передачу
на РНК.
истоны
–белки
с большей, чем у протаминов, молекулярной
массой от 11 до 21 тыс. Д. Вклад основных
аминокислот лизина и аргинина меньше
и составляет от 20 до 30%. Это гетерогенная
фракция. Различают 5 классов гистонов:
Н1,
Н2а,
Н2b,
Н3,
Н4.
Их молекулы (кроме Н1)
легко взаимодействуют друг с другом,
образуя мультимеры – октамеры.
В свободном виде они не встречаются, а
входят в состав сложных белков –
нуклеопротеидов
(рис. 10), выполняя следующие функции:
структурную и регуляторную. Первая
заключается в формировании и стабилизации
пространственной компановки молекулы
ДНК. Вторая обусловлена тем, что –
находясь в связи с этим хранителем
информации, они блокируют её передачу
на РНК.
Кислые. Это широко распространённые белки в основном, внеклеточных жидкостей. Наиболее богаты ими плазма крови, лимфа, ликвор, молоко и т.д. Из-за преобладания в них кислых аминокислот (глутамата и аспартата) растворы имеют кислый характер.
К ним относят:
Альбумины. Их Мr = 40-70 тыс.Д. Молекулы представляют одну полипептидную цепь небольших размеров. Из-за высокого содержания глутаминовой кислоты имеют солидный отрицательный заряд. Это сильно гидратированные белки (с огромной гидратной оболочкой), поэтому осаждаются только при большой концентрации водоотнимающих средств, а также устойчивы к нагреванию.
Характерным свойством альбуминов является их способность связывать лиганды и адсорбировать на своей поверхности вещества, перенося их с током биологической жидкости. Таким способом в комплексе с ними плазмой крови доставляются к клеткам гормоны, липиды, витамины, лекарства, яды, катионы металлов и т.д.; кроме того эти протеины обеспечивают онкотическое давление плазмы крови и являются её составляющей буферной системы.
Глобулины – это белки с большой молекулярной массой свыше 150 тыс. Д. По сравнению с альбуминами в их составе меньше кислых аминокислот. В отличие от них это слабо гидратированные мицеллы, поэтому легко высаливаются. Кроме того они гетерогенны, что подтверждается при электрофорезе на бумаге, после разгонки регистрируют пять фракций: 1, 2, β1, β2, . Последняя (нейтральные глобулины) является самой крупной и наиболее разнообразной. В ней сосредоточены некоторые факторы свёртывания крови и различные антитела (иммуноглобулины). Отсюда следует, что глобулины выполняют не только функции, подобные альбуминам, но и предохраняют организм от неадекватных кровопотерь и участвуют в его иммунной защите. Они являются составляющей сложных белков – гликопротеинов и липопротеинов.
Соотношение величин альбуминов и глобулинов в плазме крови называется белковым коэффициентом ().

В норме он сохраняется на постоянном уровне и составляет 1,5 – 2,3. Данный параметр изучают с целью диагностики различных патологических состояний. Например: при инфекционных заболеваниях после разделения белков плазмы крови оценивают соотношение величин альбуминов и глобулинов и находят белковый коэффициент (). Если организм борется с инфекцией, то закономерно повышается уровень иммунных защитников -глобулинов в крови, что снижает значения дроби: белковый коэффициент 1,5. Если не борется (что плохо), то величины остаются в пределах нормы, следовательно, врачебная тактика должна быть более активной: требуется дополнительное введение иммуностимуляторов (веществ, усиливающих образование антител) или готовых -глобулинов.
