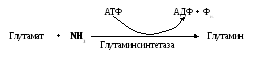- •Государственное бюджетное образовательное учреждение высшего профессионального образования
- •Содержание
- •Список сокращений
- •Введение
- •І. Тема: белки
- •1. Строение и биологическая роль аминокислот, пептидов, белков
- •Аспарагиновая кислота (асп)
- •Лизин (лиз)
- •Серин (сер)
- •1.1. Первичная структура белка
- •1.2. Варианты вторичной структуры белка
- •1.3. Третичная структура белка
- •1.4. Четвертичная структура белка – высший уровень организации
- •Свойства протеинов
- •2.1. Физико - химические свойства биополимеров
- •2.2. Особенности биологических свойств белков
- •3. Методы очистки и выделения белков
- •4. Классификация белков
- •4.1. Простые белки
- •4.1.1. Глобулярные белки
- •4.1. 2. Фибриллярные белки
- •4.2. Сложные белки
- •Отличительные особенности строения углеводсодержащих белков
- •Характеристика липопротеиновых частиц
- •5. Биологическая роль протеинов
- •Вопросы для самоконтроля
- •Тестовые задания для оценки уровня знаний
- •Ситуационные задачи
- •II. Тема: ферменты
- •1. Особенности строения ферментов
- •1.1. Энзим – сложный белок
- •1.1.1. Природа и роль кофермента
- •Витамины – компоненты коферментов
- •1.1.2. Апофермент и его значение
- •1.2. Функциональные центры фермента
- •2. Энзимы как биокатализаторы
- •2.1. Теории, объясняющие механизм действия ферментов
- •I стадия. Образование es-комплекса
- •II стадия. Активация es-комплекса
- •III стадия. Образование eр-комплекса
- •IV стадия. Распад eр-комплекса
- •2.2. Специфичность действия энзимов
- •2.3. Кинетика ферментативных реакций
- •2.3.1. Зависимость скорости реакции от содержания субстрата
- •2.3.2. Влияние концентрации фермента на скорость реакции
- •2.3.3. Эффект колебаний температуры
- •2.3.4. Связь интенсивности процесса с величинами рН среды
- •3. Классификация, номенклатура ферментов
- •3.1. Классификация
- •2.1.1. Характеристика отдельных классов ферментов
- •4. Положительная и отрицательная регуляции работы ферментов
- •4.1. Механизмы аллостерической регуляции
- •4.2. Последствия белок - белкового взаимодействия
- •4.3. Регуляция путём ковалентной модификации
- •4.4. Частичный протеолиз как способ активации зимогена
- •Особенности конкурентного ингибирования
- •5. Использование ферментов в медицине
- •5.1. Энзимопатии
- •Энзимодиагностика
- •Энзимотерапия
- •Вопросы для самоконтроля
- •Тестовые задания для оценки уровня знаний:
- •Ситуационные задачи
- •Приложение № 1
- •Варианты правильных ответов на контрольные тесты
- •Список литературы
2.3.2. Влияние концентрации фермента на скорость реакции
С корость
любой каталитической реакции
непосредственно зависит от содержания
фермента (рис. 19). Линейная зависимость
между этими величинами, когда интенсивность
процесса прямопропорциональна количеству
присутствующего энзима.
корость
любой каталитической реакции
непосредственно зависит от содержания
фермента (рис. 19). Линейная зависимость
между этими величинами, когда интенсивность
процесса прямопропорциональна количеству
присутствующего энзима.
2.3.3. Эффект колебаний температуры
И нтенсивность
химических реакций зависит и от
температуры, поэтому катализируемые
ферментами процессы также чувствительны
к её изменениям. Установлено, что скорость
большинства биохимических взаимодействий
увеличивается в 2 раза при повышении
температуры на 10°С и, наоборот, в такой
же степени уменьшается при равном
похолодании. Этот показатель получил
названиетемпературного
коэффициента.
Однако вследствие белковой природы
биокатализатора неадекватный рост
температуры будет снижать эффективную
концентрацию энзима с параллельным
замедлением скорости реакции. Оптимальной
для действия большинства ферментов
теплокровных животных является
температура 38-39°С. При увеличении её до
42-43°С интенсивность процесса подавляется,
потому что число эффективных столкновений
молекул субстрата и фермента уменьшается
(рис. 20). При падении температуры
замедляется движение частиц, а
следовательно сокращается число
образующихся энзим-субстратных
комплексов, и скорость реакции идёт на
спад.
нтенсивность
химических реакций зависит и от
температуры, поэтому катализируемые
ферментами процессы также чувствительны
к её изменениям. Установлено, что скорость
большинства биохимических взаимодействий
увеличивается в 2 раза при повышении
температуры на 10°С и, наоборот, в такой
же степени уменьшается при равном
похолодании. Этот показатель получил
названиетемпературного
коэффициента.
Однако вследствие белковой природы
биокатализатора неадекватный рост
температуры будет снижать эффективную
концентрацию энзима с параллельным
замедлением скорости реакции. Оптимальной
для действия большинства ферментов
теплокровных животных является
температура 38-39°С. При увеличении её до
42-43°С интенсивность процесса подавляется,
потому что число эффективных столкновений
молекул субстрата и фермента уменьшается
(рис. 20). При падении температуры
замедляется движение частиц, а
следовательно сокращается число
образующихся энзим-субстратных
комплексов, и скорость реакции идёт на
спад.
2.3.4. Связь интенсивности процесса с величинами рН среды
Д ля
каждого энзима характерны оптимальные
значения рН среды. Ферменты животных
тканей обычно наиболее активны в пределах
узкой зоны концентрации водородных
ионов, соответствующей в основном
выработанным в процессе эволюции
физиологическим значениям рН среды
(6,0–8,0). При графическом изображении, на
кривой колоколообразной формы имеется
определенная точка, в которой биокатализатор
максимально эффективен; эту точку
называютоптимумом
рН среды для
действия данного фермента (рис. 21). Даже
незначительные (в сотых долях) изменения
показателя приводят к глубоким сдвигам
в соотношениях нуклеофильных и
электрофильных группировок активного
центра, что резко сказывается на
комплементарности к субстрату и
впоследствии - на его эффективности.
ля
каждого энзима характерны оптимальные
значения рН среды. Ферменты животных
тканей обычно наиболее активны в пределах
узкой зоны концентрации водородных
ионов, соответствующей в основном
выработанным в процессе эволюции
физиологическим значениям рН среды
(6,0–8,0). При графическом изображении, на
кривой колоколообразной формы имеется
определенная точка, в которой биокатализатор
максимально эффективен; эту точку
называютоптимумом
рН среды для
действия данного фермента (рис. 21). Даже
незначительные (в сотых долях) изменения
показателя приводят к глубоким сдвигам
в соотношениях нуклеофильных и
электрофильных группировок активного
центра, что резко сказывается на
комплементарности к субстрату и
впоследствии - на его эффективности.
3. Классификация, номенклатура ферментов
3.1. Классификация
Согласно Международной классификации (IUPAC), биокатализаторы делят на шесть главных классов, в каждом из которых выделяют несколько подклассов: 1) оксидоредуктазы; 2) трансферазы; 3) гидролазы; 4) лиазы; 5) изомеразы; 6) лигазы (синтетазы). В основу принятого деления положен тип катализируемой реакции, который является специфичным для действия любого фермента.
Название же энзима обычно строится по следующей схеме:

Например, лактатдегидрогеназа, пируваткарбоксилаза, но для гидролаз существует исключение; построение термина упрощено: к названию субстрата добавляют лишь окончание (аргиназа, липаза, фосфатаза и т.д.); в название же синтаз включают не субстрат, а продукт реакции.
2.1.1. Характеристика отдельных классов ферментов
1. Оксидоредуктазы. К этому классу принадлежат ферменты, катализирующие окислительно-восстановительные реакции. Как известно, окисления вещества можно добиться присоединением кислорода, отщеплением водорода, отдачей протонов и электронов, что позволяет выделить соответствующие подклассы оксидоредуктаз.
Оксигеназы производят присоединение к субстрату атома кислорода из его молекулы. Например, реакция синтеза катехоламинов:

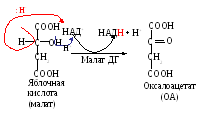
Дегидрогеназы катализируют реакции дегидрирования (отщепления молекулы водорода). В качестве их акцепторов используют коферменты НАД+, НАД+Ф, ФАД, ФМН. Все ферменты этой группы обладают субстратной специфичностью. Примером подобной реакции может служить получение оксалоацетата из малата в цикле трикарбоновых кислот (ЦТК):
Оксидазы переносят электроны и протоны на молекулярный кислород. Такие реакции протекают в процессе клеточного дыхания:
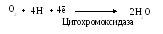
2. Трансферазы отвечают за межмолекулярный перенос функциональных групп. В реакцию вступают 2 субстрата и получаются 2 продукта реакции. В зависимости от природы переносимой группы ферменты подразделяются на: аминотрансферазы, ацилтрансферазы, метилтрансферазы, гликозилтрансферазы, фосфотрансферазы (киназы, если вторым субстратом служит АТФ). Пример:

3. Гидролазы, естественно, осуществляют процесс гидролиза различных сложных соединений. Подразделяют их в зависимости от характера расщепляемой связи: сложно-эфирная (эстеразы, фосфатазы, липазы), пептидная (протеазы), гликозидная (гликозидазы) и т.д.

4. Лиазы – группа ферментов, представляющих по механизму действия «сборную солянку». Они отщепляют от субстрата низкомолекулярные соединения (Н2О, СО2, NН3, Н2S) или присоединяют чаще молекулу воды по двойной связи. Например:
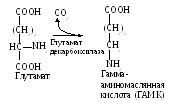

Кроме того, это единственный класс энзимов, способных разрушать – С–С – связь. Например – альдолаза, производя подобный эффект, разделяет молекулу фруктозо – 1,6 – дифосфата на два триозофосфата.
5. Изомеразы в отличие от трансфераз, осуществляющих межмолекулярную перестановку атомов, способствуют их внутримолекулярному переносу.
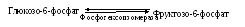
Если фермент переносит группу атомов или остаток вещества внутри молекулы, то его называют мутазой.

6. Лигазы (синтетазы) катализируют реакции синтеза веществ, которые кроме ферментов, требуют дополнительной энергии АТФ или других макроэргических соединений.