
- •Государственное бюджетное образовательное учреждение высшего профессионального образования
- •Содержание
- •Список сокращений
- •Введение
- •І. Тема: белки
- •1. Строение и биологическая роль аминокислот, пептидов, белков
- •Аспарагиновая кислота (асп)
- •Лизин (лиз)
- •Серин (сер)
- •1.1. Первичная структура белка
- •1.2. Варианты вторичной структуры белка
- •1.3. Третичная структура белка
- •1.4. Четвертичная структура белка – высший уровень организации
- •Свойства протеинов
- •2.1. Физико - химические свойства биополимеров
- •2.2. Особенности биологических свойств белков
- •3. Методы очистки и выделения белков
- •4. Классификация белков
- •4.1. Простые белки
- •4.1.1. Глобулярные белки
- •4.1. 2. Фибриллярные белки
- •4.2. Сложные белки
- •Отличительные особенности строения углеводсодержащих белков
- •Характеристика липопротеиновых частиц
- •5. Биологическая роль протеинов
- •Вопросы для самоконтроля
- •Тестовые задания для оценки уровня знаний
- •Ситуационные задачи
- •II. Тема: ферменты
- •1. Особенности строения ферментов
- •1.1. Энзим – сложный белок
- •1.1.1. Природа и роль кофермента
- •Витамины – компоненты коферментов
- •1.1.2. Апофермент и его значение
- •1.2. Функциональные центры фермента
- •2. Энзимы как биокатализаторы
- •2.1. Теории, объясняющие механизм действия ферментов
- •I стадия. Образование es-комплекса
- •II стадия. Активация es-комплекса
- •III стадия. Образование eр-комплекса
- •IV стадия. Распад eр-комплекса
- •2.2. Специфичность действия энзимов
- •2.3. Кинетика ферментативных реакций
- •2.3.1. Зависимость скорости реакции от содержания субстрата
- •2.3.2. Влияние концентрации фермента на скорость реакции
- •2.3.3. Эффект колебаний температуры
- •2.3.4. Связь интенсивности процесса с величинами рН среды
- •3. Классификация, номенклатура ферментов
- •3.1. Классификация
- •2.1.1. Характеристика отдельных классов ферментов
- •4. Положительная и отрицательная регуляции работы ферментов
- •4.1. Механизмы аллостерической регуляции
- •4.2. Последствия белок - белкового взаимодействия
- •4.3. Регуляция путём ковалентной модификации
- •4.4. Частичный протеолиз как способ активации зимогена
- •Особенности конкурентного ингибирования
- •5. Использование ферментов в медицине
- •5.1. Энзимопатии
- •Энзимодиагностика
- •Энзимотерапия
- •Вопросы для самоконтроля
- •Тестовые задания для оценки уровня знаний:
- •Ситуационные задачи
- •Приложение № 1
- •Варианты правильных ответов на контрольные тесты
- •Список литературы
1. Строение и биологическая роль аминокислот, пептидов, белков
Гетерофункциональные соединения, молекулы которых содержат одновременно амино- и карбоксильную группы, называются аминокислотами (а/к). Общее число, встречающихся в природе аминокислот, достигает 100. При этом в организме человека их найдено около 70, из которых 20 входят в состав белков. Ф.Крик назвал их “магической двадцаткой”. Только они шифруются генетическим кодом. Эти вещества относятся к -аминокислотам (, потому что NH2 - расположена у -С атома по рациональной номенклатуре) и называются протеиногенными (Приложение 1):

Существуют различные классификации аминокислот, входящих в состав белков, в зависимости от признака, положенного в основу их деления. По химической природе боковой цепи выделяют алифатические (ациклические), ароматические, гетероциклические. По количеству функциональных групп: моноаминомонокарбоновые, диаминомонокарбоновые, моноаминодикарбоновые, диаминодикарбоновые. От наличия иных функциональных групп в радикале различают: включающие гидрокси- (окси)аминокислоты, амидо-, серо- и иминосодержащие. В зависимости от вариантов происхождения аминокислоты бывают незаменимые, не способные синтезироваться в организме, отсюда должны поступать с пищей (вал, лей, иле, лиз, тре, мет, фен, три) и заменимые – которые могут и содержаться в продуктах питания, и образовываться при необходимости в клетках. При некоторых, чаще всего наследственных заболеваниях, перечень незаменимых кислот расширяется. Так при фенилкетонурии нарушены реакции, с помощью которых создаётся тирозин (отсюда – условнозаменимые а/к).
По отношению к воде (растворимости их радикалов) подразделяются на:

По степени ионизации их можно рассматривать как кислые, основные и нейтральные. В организме все полярные радикалы гидрофильных кислот находятся в диссоциированном состоянии, что обеспечивает им заряд. Он обусловлен соотношением кислотных и основных центров в молекуле. Если преобладают первые (асп, глу) – заряд будет отрицательным; если - основные (арг, лиз, гис) – положительным. В формировании данного параметра важную роль играет рН среды, в которой соединение растворено. В нейтральной среде аминокислоты, содержащие дополнительную карбоксильную группу, имеют суммарный отрицательный заряд и называются кислыми:
Аспарагиновая кислота (асп)
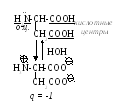
В радикале основных дополнительно содержится положительно заряженная аминогруппа:
Лизин (лиз)

Если же радикал неполярный (—СН2ОН), то заряд молекулы в целом равен нулю:
Серин (сер)
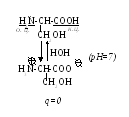
Любые сдвиги рН среды приводят к изменению заряда молекулы. Та величина показателя, при которой значение общего заряда а/к стремится к нулю, называется изоэлектрической точкой (ИЭТ, рІ). В ИЭТ растворимость вещества минимальна и оно способно выпадать в осадок:

Особенностью - аминокислот является их способность взаимодействовать друг с другом, с образованием пептидов:
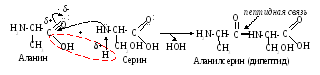
Между аминокислотами образуется новая связь – пептидная (амидная), довольно прочная, химически устойчива, в том числе к гидролизу. Поэтому белки in vitro подвергаются этой реакции только в присутствии кислого или щелочного катализатора при длительном кипячении:
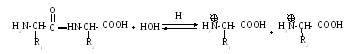
Гораздо быстрее протекает ферментативный гидролиз в щелочной среде, продуктами которого являются соли аминокислот.
Количество мономеров в пептидах может сильно варьировать. Цепь, состоящая из двух аминокислот – дипептид, трёх – трипептид, из нескольких – олигопептид (olygo - мало), из большого числа – полипептид (Рис.1).

Простейшими представителями подобных соединений являются дипептиды. Примером могут служить: карнозин (от лат. carnosus - мясной) и ансерин. Они находятся в митохондриях, предотвращая их набухание, тем самым способствуют сохранению функций субклеточных образований.
Пептиды, включающие до 10 аминокислот, называются олигопептидами. Число звеньев в молекуле отражается в её названии: трипептид, пентапептид и т.д. Например: трипептид – глутатион, один из важнейших восстановителей в антиоксидантной системе организма, которая регулирует свободно-радикальные процессы.
Вазопрессин и окситоцин - гормоны задней доли гипофиза, состоят из 9 а/к; регулируют баланс ионов в организме. Вазопрессин (антидиуретический гормон, АДГ) усиливает реабсорбцию воды в почках, контролирует осмотическое давление плазмы крови и водный баланс. Служит гормоном верности и моногамности. А окситоцин вызывает сокращение гладких мышц матки и в меньшей степени − мышц мочевого пузыря и кишечника, стимулирует отделение молока молочными железами. Его ещё называют гормоном счастья, нежности.
Пептиды, содержащие более 10 а/к, называют полипептидами. Например: АКТГ - гормон передней доли гипофиза, состоит из 39 аминокислотных остатков; усиливает секрецию глюкокортикостероидов корой надпочечников; способствует обучению; обеспечивает долговременную память, улучшает адаптацию к изменяющимся условиям окружающей среды.
Пептиды - полярные молекулы и находятся в ионизированном состоянии, следовательно, имеют заряд и способны изменять его при сдвиге рН среды. При ацидозе (смещении рН в кислую) или алкалозе (соответственно в щелочную сторону) растворимость биополимеров будет уменьшаться, что мешает выполнению ими своих функций.

Полипептиды, включающие более чем 50 аминокислотных остатков, называют белками. Их многообразие обусловлено различным сочетанием ≈ 20-ти аминокислот.
Полипептидные цепи – это длинные нити, обеспечивающие выполнение определённых функций. За счёт чередования sp2 и sp3 гибридизованных атомов углерода они способны образовывать определённые более компактные формы молекул в пространстве – структуры белка. Различают четыре уровня подобной организации протеинов: первичную, вторичную, третичную и четвертичную структуры.
Установлены общие правила их формирования в пространстве.
