
- •Государственное бюджетное образовательное учреждение высшего профессионального образования
- •Содержание
- •Список сокращений
- •Введение
- •І. Тема: белки
- •1. Строение и биологическая роль аминокислот, пептидов, белков
- •Аспарагиновая кислота (асп)
- •Лизин (лиз)
- •Серин (сер)
- •1.1. Первичная структура белка
- •1.2. Варианты вторичной структуры белка
- •1.3. Третичная структура белка
- •1.4. Четвертичная структура белка – высший уровень организации
- •Свойства протеинов
- •2.1. Физико - химические свойства биополимеров
- •2.2. Особенности биологических свойств белков
- •3. Методы очистки и выделения белков
- •4. Классификация белков
- •4.1. Простые белки
- •4.1.1. Глобулярные белки
- •4.1. 2. Фибриллярные белки
- •4.2. Сложные белки
- •Отличительные особенности строения углеводсодержащих белков
- •Характеристика липопротеиновых частиц
- •5. Биологическая роль протеинов
- •Вопросы для самоконтроля
- •Тестовые задания для оценки уровня знаний
- •Ситуационные задачи
- •II. Тема: ферменты
- •1. Особенности строения ферментов
- •1.1. Энзим – сложный белок
- •1.1.1. Природа и роль кофермента
- •Витамины – компоненты коферментов
- •1.1.2. Апофермент и его значение
- •1.2. Функциональные центры фермента
- •2. Энзимы как биокатализаторы
- •2.1. Теории, объясняющие механизм действия ферментов
- •I стадия. Образование es-комплекса
- •II стадия. Активация es-комплекса
- •III стадия. Образование eр-комплекса
- •IV стадия. Распад eр-комплекса
- •2.2. Специфичность действия энзимов
- •2.3. Кинетика ферментативных реакций
- •2.3.1. Зависимость скорости реакции от содержания субстрата
- •2.3.2. Влияние концентрации фермента на скорость реакции
- •2.3.3. Эффект колебаний температуры
- •2.3.4. Связь интенсивности процесса с величинами рН среды
- •3. Классификация, номенклатура ферментов
- •3.1. Классификация
- •2.1.1. Характеристика отдельных классов ферментов
- •4. Положительная и отрицательная регуляции работы ферментов
- •4.1. Механизмы аллостерической регуляции
- •4.2. Последствия белок - белкового взаимодействия
- •4.3. Регуляция путём ковалентной модификации
- •4.4. Частичный протеолиз как способ активации зимогена
- •Особенности конкурентного ингибирования
- •5. Использование ферментов в медицине
- •5.1. Энзимопатии
- •Энзимодиагностика
- •Энзимотерапия
- •Вопросы для самоконтроля
- •Тестовые задания для оценки уровня знаний:
- •Ситуационные задачи
- •Приложение № 1
- •Варианты правильных ответов на контрольные тесты
- •Список литературы
1.1. Первичная структура белка
Это генетически запрограммированная последовательность -аминокислот L-ряда в полипептидной цепи. Она имеет зигзагообразное конформационное строение:
Стабилизируется с помощью пептидных связей.
Каждый белок организма имеет уникальную последовательность аминокислот.
Биороль данной структуры: специфические особенности чередования различных по строению а/к обусловливают индивидуализацию формирования пространственных структур (вторичной, третичной и четвертичной), а следовательно и свойства, и функции получившегося протеина.
1.2. Варианты вторичной структуры белка
Данный уровень образуется благодаря вращению пептидных групп относительно друг друга или появлению в полипептидной цепи одноимённо заряженных либо крупных радикалов, пролина.
Р азличают-спираль
и β-складчатый слой. Радикалы этих
структур, как гидрофобные, так и
гидрофильные, направлены перпендикулярно
цепи, имея наиболее выгодное расположение
заместителей - транс-конформацию,
поэтому белки, обладающие лишь вторичной
структурой, плохо растворимы в воде.
азличают-спираль
и β-складчатый слой. Радикалы этих
структур, как гидрофобные, так и
гидрофильные, направлены перпендикулярно
цепи, имея наиболее выгодное расположение
заместителей - транс-конформацию,
поэтому белки, обладающие лишь вторичной
структурой, плохо растворимы в воде.
Правозакрученная α-спираль (Рис.2) содержит 3,6 аминокислотных остатка в одном витке; это создает возможность для взаимодействия карбонильного атома кислорода одной пептидной группы с атомом водорода аминогруппы соседнего витка. В результате возникают многочисленные водородные связи, которые стабилизируют данную структуру.
β-структура представляет складчатый слой, образованный одной или несколькими полипептидными цепями, располагающимися параллельно или антипараллельно (Рис.3).
Эта пространственная организация молекулы похожа на «вытянутую» спираль, где радикалы аминокислот препятствуют спирализации и увеличивают расстояние между витками (одноименно заряженные или крупные радикалы).
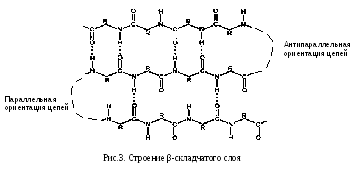
Оба варианта стабилизируются за счёт водородных связей, а β-складчатый слой может и с помощью дисульфидных мостиков.
Биороль данной структуры: отвечает за формирование третичной структуры и свойства белка.
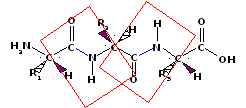
1.3. Третичная структура белка
Чередование
α-спирализованных, β-структурированных
и неспирализованных аморфных участков
позволяет полипептидной цепи более
плотно уложиться в пространстве. В
разных белках наблюдается различное
соотношение типов структур (Рис.4).
Например, инсулин содержит 52% α-спирали
и 6% β-структуры, трипсин – 14% и 45%
соответственно.

Первичная структура малоорганизованных участков включает пролин, особое строение которого провоцирует в цепи изгибы. Формирование глобул происходит в водной среде клетки, поэтому гидрофобные радикалы аминокислот «прячутся» внутрь сферы, образуя «жирную» каплю, а гидрофильные – будут направлены наружу, способствуя созданию гидратной оболочки мицеллы. Поэтому подобные белки хорошо растворимы в воде.
Стабилизируется с помощью различных дополнительных (добавочных) связей, например:
водородных – между атомом водорода и более электроотрицательными атомами —ОН, —СООН, —NH2 группами радикалов аминокислот;
дисульфидных – между остатками цистеина;
гидрофобных – между радикалами алифатических и ароматических аминокислот;
ионных – между группами —СОО– глутамата или аспартата и —NH3+ лизина или аргинина;
псевдопептидных – между —СОО– группами глутамата или аспартата и —NH3+ группами лизина или аргинина;
эфирных – между гидроксигруппами треонина и серина (простые) или карбоксильной группой (—СООН) аспартата, глутамата и –ОН гидроксикислот (сложноэфирная).
Биороль: способствует формированию четвертичной структуры, обуславливает выполнение функций.
