
- •Государственное бюджетное образовательное учреждение высшего профессионального образования
- •Содержание
- •Список сокращений
- •Введение
- •І. Тема: белки
- •1. Строение и биологическая роль аминокислот, пептидов, белков
- •Аспарагиновая кислота (асп)
- •Лизин (лиз)
- •Серин (сер)
- •1.1. Первичная структура белка
- •1.2. Варианты вторичной структуры белка
- •1.3. Третичная структура белка
- •1.4. Четвертичная структура белка – высший уровень организации
- •Свойства протеинов
- •2.1. Физико - химические свойства биополимеров
- •2.2. Особенности биологических свойств белков
- •3. Методы очистки и выделения белков
- •4. Классификация белков
- •4.1. Простые белки
- •4.1.1. Глобулярные белки
- •4.1. 2. Фибриллярные белки
- •4.2. Сложные белки
- •Отличительные особенности строения углеводсодержащих белков
- •Характеристика липопротеиновых частиц
- •5. Биологическая роль протеинов
- •Вопросы для самоконтроля
- •Тестовые задания для оценки уровня знаний
- •Ситуационные задачи
- •II. Тема: ферменты
- •1. Особенности строения ферментов
- •1.1. Энзим – сложный белок
- •1.1.1. Природа и роль кофермента
- •Витамины – компоненты коферментов
- •1.1.2. Апофермент и его значение
- •1.2. Функциональные центры фермента
- •2. Энзимы как биокатализаторы
- •2.1. Теории, объясняющие механизм действия ферментов
- •I стадия. Образование es-комплекса
- •II стадия. Активация es-комплекса
- •III стадия. Образование eр-комплекса
- •IV стадия. Распад eр-комплекса
- •2.2. Специфичность действия энзимов
- •2.3. Кинетика ферментативных реакций
- •2.3.1. Зависимость скорости реакции от содержания субстрата
- •2.3.2. Влияние концентрации фермента на скорость реакции
- •2.3.3. Эффект колебаний температуры
- •2.3.4. Связь интенсивности процесса с величинами рН среды
- •3. Классификация, номенклатура ферментов
- •3.1. Классификация
- •2.1.1. Характеристика отдельных классов ферментов
- •4. Положительная и отрицательная регуляции работы ферментов
- •4.1. Механизмы аллостерической регуляции
- •4.2. Последствия белок - белкового взаимодействия
- •4.3. Регуляция путём ковалентной модификации
- •4.4. Частичный протеолиз как способ активации зимогена
- •Особенности конкурентного ингибирования
- •5. Использование ферментов в медицине
- •5.1. Энзимопатии
- •Энзимодиагностика
- •Энзимотерапия
- •Вопросы для самоконтроля
- •Тестовые задания для оценки уровня знаний:
- •Ситуационные задачи
- •Приложение № 1
- •Варианты правильных ответов на контрольные тесты
- •Список литературы
1.2. Функциональные центры фермента
Активный центр – это фрагмент энзима, который взаимодействует с субстратом (S) для образования энзим-субстратного комплекса (ES). Он является результатом комплексирования кофермента с апоферментом. В нём условно выделяют так называемый связывающий участок, или контактную площадку, которая обеспечивает сближение с субстратом и формирование ES-комплекса, и каталитический участок, где непосредственно осуществляется химическая реакция. Количество активных центров в олигомерных биокатализаторах может быть равно числу субъединиц.
Помимо данного функционального локуса в молекуле энзима может присутствует также аллостерический центр (от греч. allos – другой, иной и steros – пространственный, структурный) - это фрагмент полипептидной цепи, расположенной вдали от активного центра, взаимодействует с низкомолекулярными веществами (эффекторами, или модификаторами), регулируя активность фермента. Иногда подобных доменов может быть несколько. Присоединение эффектора к данному участку приводит к изменениям третичной, часто даже четвертичной структуры молекулы и соответственно сдвигам в конфигурации активного центра, вызывая снижение или повышение энзиматического сродства.
2. Энзимы как биокатализаторы
2.1. Теории, объясняющие механизм действия ферментов
Общая схема работы фермента:
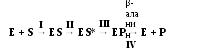
Выделяют 4 стадии катализируемой реакции.
I стадия. Образование es-комплекса
Энзимы обладают высокой специфичностью действия, что позволило в 1890г. Э.Фишеру (Е.Fischer) выдвинуть гипотезу, согласно которой активный центр фермента взаимодействует с субстратом по принципу комплементарности, т.е. химического и геометрического соответствия, поэтому этот участок молекулы должен быть стабильным, жёстко структурированным и подходить к субстрату как «ключ к замку». Но позже было выяснено, что не все биокатализаторы обладают этим свойством, но эффект при этом осуществляют.
В 1959 г. Д. Кошландом была предложена новая интерпретация теории «ключа и замка». Согласно идее исследователя, активный центр фермента является гибкой структурой. Под действием электрофильных (э/ф) или нуклеофильных (н/ф) группировок субстрата данный участок, имея подобные радикалы, способен изменять свою конформацию. Таким способом субстрат наводит энзим на себя, производя при этом в своей молекуле пространственные перестройки. Эта теория получила название «индуцированного соответствия», или «индуцированного наведения». Более тесное сближение субстрата и активного центра позволяет им быстро взаимодействовать с последующим образованием энзим-субстратного комплекса.
II стадия. Активация es-комплекса
Между э/ф и н/ф группами в ES-комплексе происходит перераспределение электронной плотности, в результате изменяется длина химических связей и провоцируется деформация молекулы субстрата; данное явление способствует понижению величины необходимой энергии активации Еа и быстрому протеканию химических преобразований (III стадии).
III стадия. Образование eр-комплекса
В результате пространственной модификации структуры субстрата старые связи ослабляются, затем рвутся, возникают новые и формируется продукт реакции.
