
- •Государственное бюджетное образовательное учреждение высшего профессионального образования
- •Содержание
- •Список сокращений
- •Введение
- •І. Тема: белки
- •1. Строение и биологическая роль аминокислот, пептидов, белков
- •Аспарагиновая кислота (асп)
- •Лизин (лиз)
- •Серин (сер)
- •1.1. Первичная структура белка
- •1.2. Варианты вторичной структуры белка
- •1.3. Третичная структура белка
- •1.4. Четвертичная структура белка – высший уровень организации
- •Свойства протеинов
- •2.1. Физико - химические свойства биополимеров
- •2.2. Особенности биологических свойств белков
- •3. Методы очистки и выделения белков
- •4. Классификация белков
- •4.1. Простые белки
- •4.1.1. Глобулярные белки
- •4.1. 2. Фибриллярные белки
- •4.2. Сложные белки
- •Отличительные особенности строения углеводсодержащих белков
- •Характеристика липопротеиновых частиц
- •5. Биологическая роль протеинов
- •Вопросы для самоконтроля
- •Тестовые задания для оценки уровня знаний
- •Ситуационные задачи
- •II. Тема: ферменты
- •1. Особенности строения ферментов
- •1.1. Энзим – сложный белок
- •1.1.1. Природа и роль кофермента
- •Витамины – компоненты коферментов
- •1.1.2. Апофермент и его значение
- •1.2. Функциональные центры фермента
- •2. Энзимы как биокатализаторы
- •2.1. Теории, объясняющие механизм действия ферментов
- •I стадия. Образование es-комплекса
- •II стадия. Активация es-комплекса
- •III стадия. Образование eр-комплекса
- •IV стадия. Распад eр-комплекса
- •2.2. Специфичность действия энзимов
- •2.3. Кинетика ферментативных реакций
- •2.3.1. Зависимость скорости реакции от содержания субстрата
- •2.3.2. Влияние концентрации фермента на скорость реакции
- •2.3.3. Эффект колебаний температуры
- •2.3.4. Связь интенсивности процесса с величинами рН среды
- •3. Классификация, номенклатура ферментов
- •3.1. Классификация
- •2.1.1. Характеристика отдельных классов ферментов
- •4. Положительная и отрицательная регуляции работы ферментов
- •4.1. Механизмы аллостерической регуляции
- •4.2. Последствия белок - белкового взаимодействия
- •4.3. Регуляция путём ковалентной модификации
- •4.4. Частичный протеолиз как способ активации зимогена
- •Особенности конкурентного ингибирования
- •5. Использование ферментов в медицине
- •5.1. Энзимопатии
- •Энзимодиагностика
- •Энзимотерапия
- •Вопросы для самоконтроля
- •Тестовые задания для оценки уровня знаний:
- •Ситуационные задачи
- •Приложение № 1
- •Варианты правильных ответов на контрольные тесты
- •Список литературы
IV стадия. Распад eр-комплекса
Так как получившееся новое вещество отличается по конформации от субстрата, то оно не комплементарно активному центру фермента и комплекс распадается на составляющие.
2.2. Специфичность действия энзимов
Данное свойство ферментов по отношению к субстрату обусловлено их строением. Различают следующие варианты специфичности энзимов:
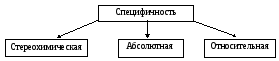
Стереохимическая - проявляется в тех условиях, когда энзим способен катализировать превращение только одного из возможных стереоизомеров субстрата. Например, фумаратгидратаза реагирует с транс-изомером фумаровой кислотой, но не взаимодействует с её цис-изомером (малеиновой кислотой):

Имея абсолютную субстратную специфичность, биокатализатор работает лишь с одним веществом. Наблюдающееся явление и пытался объяснить Э.Фишер, который считал, что конформация активного центра жёстко запрограммирована, - поэтому фермент узнаёт только один свой субстрат. Например, аргиназа разрушает связи только в аргинине:
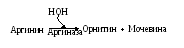
Уреаза бактерий, птиц гидролизует лишь мочевину:
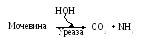
Относительная (групповая) специфичность свидетельствует о том, что фермент может повреждать связи в различных субстратах. Имея данный вариант специфичности, энзим способен осуществлять один тип реакции, но с субстратами, несколько отличающимися по химическому строению. Цитохром Р450 может гидроксилировать (присоединять группы -ОН) около 7000 соединений как природных, так и ксенобиотиков. Большинство протеаз, осуществляющих гидролиз белков, как животного, так и растительного происхождения, расщепляет их пептидные связи. Панкреатическая липаза разрушает молекулу любого жира.
Но как объяснить факт относительной специфичности? Кошланд как раз и предложил свою теорию «индуцированного контакта». По его мнению, как отмечено выше, пространственная укладка активного центра свободного энзима только намечена, а по мере приближения к нему субстрата группировки последнего несколько меняют расположение участков контактной площадки, приспосабливая её для будущей своей работы. Отсюда различные, но сходные по строению вещества способны преобразовываться одним и тем же ферментом.
2.3. Кинетика ферментативных реакций
Кинетика ферментативных реакций – раздел энзимологии, изучающий зависимость скорости процессов, катализируемых энзимами, от химической природы реагирующих веществ, а также от факторов биосреды. Прежде всего - это соотношение концентраций взаимодействующих веществ: фермента и субстрата. Важны и условия, в которых протекает реакция: температура, кислотность, присутствие регуляторных молекул (активаторов и ингибиторов), солей и других примесей, способных как ускорить, так и замедлить ферментативный процесс, и т.д.
О дним
из наиболее существенных факторов,
определяющих эффективность реакции,
являются величины субстрата (или
субстратов) и продукта (продуктов).
дним
из наиболее существенных факторов,
определяющих эффективность реакции,
являются величины субстрата (или
субстратов) и продукта (продуктов).
2.3.1. Зависимость скорости реакции от содержания субстрата
При стабильных значениях энзима скорость процесса с ростом величин субстрата постепенно повышается, достигая определенного максимума (рис.18), при котором дальнейший подъём его содержания практически не оказывает влияния на ход реакции. В таких случаях принято считать, что субстрат находится в избытке, а фермент полностью насыщен, то есть все его молекулы связаны с исходным веществом. Отсюда фактором, ограничивающим скорость реакции, становится количество биокатализатора.
