- •Федеральное агентство морского и речного транспорта
- •Предисловие
- •Лекция 1. Предмет физики.
- •1. Кинематика. Движение тел.
- •2. Движение материальной точки.
- •3. Скорость.
- •4. Ускорение.
- •5. Вращательное движение. Угловая скорость и угловое ускорение.
- •6. Качение тела.
- •Лекция 2. Динамика материальной точки.
- •1. Первый закон Ньютона.
- •2. Второй закон Ньютона.
- •3. Третий закон Ньютона.
- •4. Закон всемирного тяготения. Сила тяжести. Вес.
- •Силы упругости.
- •Силы трения.
- •Лекция 3. Закон сохранения импульса.
- •Введение.
- •Закон сохранения импульса.
- •Закон движения центра масс.
- •Движение тел с переменной массой. Реактивное движение.
- •Лекция 4. Закон сохранения энергии в механике.
- •Энергия, работа, мощность.
- •Потенциальная энергия.
- •Кинетическая энергия
- •Закон сохранения энергии.
- •Удар абсолютно упругих и абсолютно неупругих тел.
- •Лекция 5. Динамика вращательного движения твердого тела.
- •Вращение твердого тела вокруг неподвижной оси. Кинетическая энергия.
- •2. Момент инерции твердого тела.
- •3. Моменты инерции тел различной формы.
- •4. Момент силы относительно неподвижной точки.
- •5. Момент силы относительно неподвижной оси.
- •6. Момент импульса относительно неподвижной точки.
- •7. Момент импульса относительно неподвижной осиz.
- •Лекция 6. Уравнения динамики вращательного движения.
- •1. Закон сохранения момента импульса.
- •2. Гироскоп.
- •Лекция 7 Колебания и волны.
- •Свободные гармонические колебания. Гармонический осциллятор.
- •Задача о колебании груза на пружине.
- •Задача о физическом маятнике.
- •Задача о математическом маятнике.
- •Скорость и ускорение при гармоническом колебании.
- •Энергия гармонического осциллятора.
- •Лекция 8. Сложение колебаний.
- •Сложение гармонических колебаний одного направления и одной частоты.
- •Биения.
- •Формула для сложения колебаний в общем случае для плоских волн.
- •Вынужденные колебания.
- •Затухающие колебания.
- •Механические волны (упругие волны)
- •Лекция 9 Уравнение плоской гармонической волны.
- •Фронт волны
- •Фазовая скорость.
- •Волновое уравнение.
- •Стоячие волны.
- •Звуковые волны.
- •Лекция 10 Механика жидкости
- •Линии и трубки тока. Неразрывность струи.
- •Уравнение Бернулли.
- •Ламинарное и турбулентное течение.
- •Силы сопротивления при движении тел в жидкостях. Закон Стокса. Число Рейнольдса.
- •Лекция 11 Физические основы молекулярно-кинетической теории газов.
- •1. История.
- •2. Идеальный газ. Параметры состояния газа. Уравнение состояния идеального газа.
- •3. Атомная единица массы (а.Е.М.).
- •4. Свойства идеального газа.
- •5. Уравнение Менделеева-Клапейрона.
- •6. Основное уравнение кинетической теории газов (уравнение Клаузиуса).
- •Лекция 12 Первый закон термодинамики.
- •1. Термодинамические системы (тдс).
- •2. Внутренняя энергия систем.
- •3. Первый закон термодинамики. Термодинамические процессы.
- •4. Работа газа при изменении его объема.
- •5. Теплоемкость.
- •Лекция 13 Термодинамические процессы.
- •1. Изохорный процесс
- •2. Изобарный процесс.
- •3. Изотермический процесс.
- •Лекция 14
- •4. Адиабатический процесс.
- •5. Политропический процесс.
- •Лекция 15 Второе начало термодинамики. Сущность второго начала термодинамики.
- •1. Введение
- •2. Обратимые и необратимые процессы.
- •3. Круговые процессы (циклы).
- •4. Прямой цикл (тепловая машина).
- •5. Обратный цикл (холодильник).
- •6. Цикл Карно. Произвольный обратимый цикл.
- •Лекция 16 Энтропия.
Лекция 12 Первый закон термодинамики.
1. Термодинамические системы (тдс).
Термодинамика – наука о свойствах и взаимопревращениях энергии. В основе этой науки лежат два закона: Первый законпредставляет закон сохранения энергии в приложении к процессам взаимного превращения теплоты и работы.Второй законхарактеризует направление процессов, происходящих в термодинамических системах.
Под термодинамической системой (ТДС) понимается совокупность макроскопических объектов, обменивающихся энергией в форме работы или тепла друг с другом и с внешней средой.
|
|
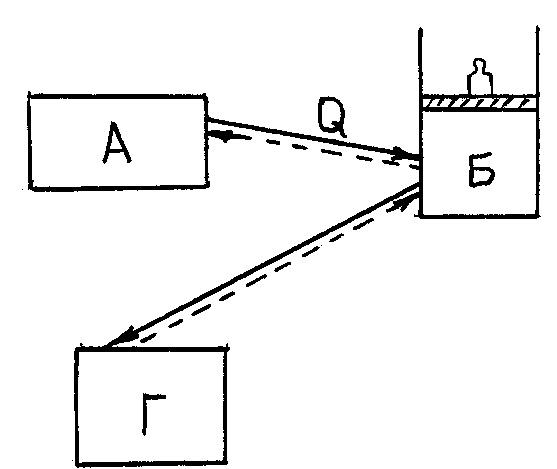
В ТДС входят (рис.1): источник тепла А, могущий получать или отдавать энергию в виде тепла; рабочее тело Б, преобразующее тепло в работу или наоборот; тело Г, могущее отдавать или аккумулировать работу. Рабочее тело совершает преобразование тепла в работу или обратно. Рабочее тело – движущаяся материальная среда (жидкая или газообразная) играет роль посредника в процессах взаимопревращения тепла и работы. |
|
Рис 1. |
|
В качестве рабочего тела используется воздух, или газ, или продукты сгорания топлив. Для простоты в технической термодинамике в качестве рабочего тела применяется идеальный газ.
Важным свойством идеального газа является отсутствие вязкости, а его термодинамические свойства зависят только от строения молекул. Идеальные газы подразделяются на одноатомные, двух-, трех- и многоатомные.
Состояние идеального газа характеризуется
давлением
![]() ,
удельным объемом
,
удельным объемом![]() и температурой
и температурой![]() .
Давление измеряется барометрами (в
области атмосферного давления),
манометрами (высокое давление),
вакуумметрами (низкое давление).
Абсолютное давление равно
.
Давление измеряется барометрами (в
области атмосферного давления),
манометрами (высокое давление),
вакуумметрами (низкое давление).
Абсолютное давление равно![]() ,
,![]() .
Оно и используется при термодинамических
расчетах.
.
Оно и используется при термодинамических
расчетах.
Удельный объем – объем единицы массы вещества
![]() м3/кг.
м3/кг.
Величина, обратная удельному объему называется плотностью
![]() кг/м3.
кг/м3.
Температура характеризует степень нагретости тела, это мера интенсивности теплового движения молекул.
2. Внутренняя энергия систем.
Внутренняя энергия системы – это энергия хаотического (теплового) движения частиц системы и энергия взаимодействия частиц. Из определения следует, что к внутренней энергии не относится кинетическая энергия системы как целого (например, движение газа с сосудом) и потенциальная энергия во внешних полях.
Внутренняя энергия является функцией состояния системы. Это означает, что значение энергии не зависит от процессов по которым система пришла в это состояние. Изменение внутренней энергии всегда равно разности значений энергий в этих состояниях.
Для определения численного значения внутренней энергии вводится понятие числа степеней свободы.
Положение точки в пространстве характеризуется тремя числами. Это и есть число независимых степеней свободы для одноатомного газа.
Число независимых координат, полностью определяющих положение системы в пространстве, называется числом степеней свободы.
Молекулу одноатомного газа можно рассматривать как точку. Она имеет три поступательных степени свободы (по x,yиzнаправлениям). Молекула двухатомного газа имеет 5 степеней свободы (2 вращения, 3 поступательных), молекула трехатомного газа имеет 6 степеней свободы (3 вращения и 3 поступательных).
Средняя внутренняя энергия, приходящаяся на одну молекулу равна
![]() ,
,
![]() - число степеней свободы.
- число степеней свободы.
Внутренняя энергия моля равна
![]() .
.