- •И. В. Крепышева
- •Содержание
- •Тема 7. Химия металлов 125
- •1.2. Квантово-механическая модель атома водорода
- •1.3. Строение многоэлектронных атомов
- •1.4. Периодическая система элементов д.И. Менделеева
- •1.5. Периодические свойства элементов
- •1.6. Решение типовых задач
- •1.7. Задачи для самостоятельного решения
- •Тема 2. Химическая связь
- •2.1. Ковалентная связь
- •2.2. Гибридизация атомных орбиталей
- •2.3. Ионная химическая связь
- •2.4. Металлическая связь
- •2.5. Водородная связь
- •2.6. Строение твердого тела
- •Тема 3. Элементы химической термодинамики
- •3.1. Основные понятия термодинамики
- •3.2. Внутренняя энергия
- •3.3. Энтальпия
- •3.4. Термохимия. Закон Гесса
- •3.5. Энтропия
- •3.6. Самопроизвольные процессы. Энергия Гиббса
- •3.7. Решение типовых задач
- •3.8. Задачи для самостоятельного решения
- •Тема 4. Химическая кинетика и химическое равновесие
- •4.1. Скорость химической реакции
- •4.2. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •4.3. Зависимость скорости реакции от температуры
- •4.4. Катализ
- •4.5. Химическое равновесие
- •4.6. Смещение химического равновесия. Принцип Ле Шателье
- •4.7. Решение типовых задач
- •4.8. Задачи для самостоятельного решения
- •Тема 5. Растворы. Дисперсные системы
- •5.1. Общие свойства растворов
- •5.2. Способы выражения состава растворов
- •5.3. Теория электролитической диссоциации
- •5.4. Теории кислот и оснований
- •5.5. Ионные реакции в растворах
- •5.6. Ионное произведение воды. Водородный показатель рН
- •5.7. Гидролиз солей
- •5.8. Дисперсные системы и их классификация
- •5.9. Решение типовых задач
- •28,57 Г соли растворены в 71,43 г воды
- •3% Массы раствора составляют 48,84 г
- •Соотношение между рН и рОн
- •5.10. Задачи для самостоятельного решения
- •Тема 6. Окислительно-восстановительные электрохимические процессы
- •6.1. Основные понятия
- •Правила определения степени окисления
- •6.2. Составление уравнений окислительно-восстановительных реакций
- •6.3. Влияние среды на характер протекания реакций
- •6.4. Важнейшие окислители и восстановители
- •6.5. Электрохимические процессы
- •96500 Кл (26,8 а∙ч) – 31,77 г Cu (масса моля эквивалентов)
- •96500 Кл – 1 г (11,2 л– объем моля эквивалентов)
- •6.6. Гальванический элемент Даниэля-Якоби
- •6.7. Окислительно-восстановительные потенциалы
- •6.8. Эдс окислительно-восстановительных реакций
- •6.9. Электролиз расплавов и растворов солей
- •6.10. Некоторые области применения электрохимии
- •6.11. Решение типовых задач
- •6.12. Задачи для самостоятельного решения
- •Тема 7. Химия металлов
- •7.1. Общая характеристика металлов
- •7.2. Химические свойства металлов
- •7.3. Взаимодействие металлов с кислотами
- •Взаимодействие металлов с соляной кислотой.
- •Взаимодействие металлов с азотной кислотой
- •Взаимодействие металлов с серной кислотой
- •7.4. Сплавы
- •7.5. Получение металлов
- •Тема 8. Коррозия и защита металлов
- •8.1. Определение и классификация коррозионных процессов
- •8.2. Химическая коррозия
- •8.3. Электрохимическая коррозия
- •8.4. Возможность коррозии с водородной и кислородной деполяризацией
- •8.5. Защита металлов от коррозии
- •8.6. Решение типовых задач
- •8.7. Задачи для самостоятельного решения
- •Тема 9. Органические полимерные материалы
- •9.1. Классификация полимерных (высокомолекулярных) материалов
- •9.2. Строение полимеров
- •9.3. Кристаллическое и аморфное состояние полимеров
- •9.4. Методы получения полимеров
- •9.5. Применение полимеров
- •Тема 10. Химическая идентификация и анализ вещества
- •10.1. Химическая идентификация вещества
- •Некоторые реагенты для идентификации катионов
- •Классификация анионов по окислительно-восстановительным свойствам
- •Некоторые реагенты для идентификации анионов
- •10.2. Количественный анализ. Химические методы анализа
- •10.3. Инструментальные методы анализа
- •Приложение
- •Важнейшие единицы си и их соотношение с единицами других систем
- •Приставки для дольных и кратных единиц си
- •Термодинамические характеристики некоторых веществ при 298 к
- •Стандартные потенциалы металлических
- •Энергия разрыва связи
- •Электроотрицательность элементов по Полингу
- •Стандартные окислительно-восстановительные потенциалы элементов
- •Растворимость соединений
- •Обозначения: р – растворимый, м – малорастворимый, н – нерастворимый,
- •Константы диссоциации Кд слабых электролитов
- •Распределение электронов в атоме
- •Список литературы
- •Крепышева Ирина Вадимовна
- •Учебное пособие для самостоятельной работы студентов
- •Нехимических специальностей и направлений
Тема 8. Коррозия и защита металлов
8.1. Определение и классификация коррозионных процессов
Коррозия
– это разрушение металла в результате
его физико-химического взаимодействия
с окружающей средой. При этом металлы
окисляются и образуются продукты, состав
которых зависит от условий коррозии.
Коррозия – самопроизвольный процесс,
поэтому протекает с уменьшением энергии
Гиббса системы (![]() ).
По механизму протекания коррозионного
процесса различаютхимическую
и электрохимическую
коррозию.
).
По механизму протекания коррозионного
процесса различаютхимическую
и электрохимическую
коррозию.
Химическая коррозия характерна для сред, не проводящих электрический ток. При химической коррозии происходит прямое гетерогенное взаимодействие металла с окислителем окружающей среды. По условиям протекания коррозионного процесса различают: а) газовую коррозию – в газах и парах без конденсации влаги на поверхности металла, обычно при высоких температурах; б) коррозию в неэлектролитах – агрессивных органических жидкостях, таких как сернистая нефть и др.
Электрохимическая коррозия характерна для сред, имеющих ионную проводимость.
При электрохимической коррозии процесс взаимодействия металла с окислителем включает анодное растворение металла и катодное восстановление окислителя.
Электрохимическая коррозия может протекать:
а) в электролитах – в водных растворах солей, кислот, щелочей, в морской воде;
б) в атмосфере любого влажного газа;
в) в почве.
Особым видом электрохимической коррозии следует считать коррозию за счет внешнего электрического тока (коррозия трубопроводов с токопроводящими жидкостями, нерастворимых анодов в электрохимических ваннах, подземных металлических сооружений).
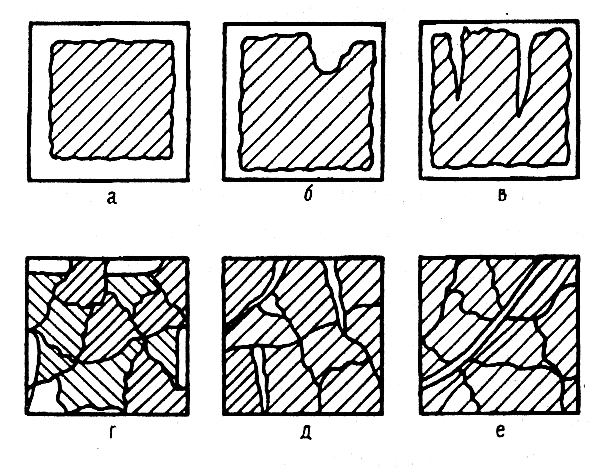
Хотя механизм протекания коррозионного процесса в разных условиях различен, по характеру разрушения поверхности металла коррозию можно разделить на равномерную и местную (рис. 8.1.).
|
Равномерная (общая коррозия) распределяется более или менее равномерно по всей поверхности металла. Местная коррозия сосредоточена на отдельных участках, проявляется в виде точек, язв и пятен. Местная коррозия, как правило, более опасна, чем равномерная коррозия так как проникает на большую глубину.
|
|
|
|
Рис. 8.1. Виды коррозионных разрушений: а – равномерное; б – местное; в – точечное; г – избирательное; д – межкристаллическое; е – транскристаллическое |
Особыми видами коррозии являются межкристаллическая коррозия (коррозия по границам зерен), избирательная коррозия (растворение одного из компонентов сплава) и коррозионное растрескивание (коррозия при одновременном воздействии химических реагентов и высоких механических напряжений).
8.2. Химическая коррозия
Термодинамика химической коррозии. Химическая коррозия представляет собой самопроизвольное разрушение металлов в среде окислительного газа (например, кислорода, галогенов) при повышенных температурах или в жидкостях неэлектролитах.
Рассмотрим химическую коррозию в газах (газовую коррозию), в частности, коррозию в атмосфере кислорода. Уравнение реакции окисления металлов кислородом можно записать в общем виде:
nM + m/2O2 = MnOm
В соответствии с законами химической термодинамики эта реакция, как и другие реакции коррозии, может протекать лишь при условии уменьшения энергии Гиббса системы. Так как, по определению, энергия Гиббса простых веществ равна нулю, то энергия Гиббса окисления металлов равна энергии Гиббса образования оксидов. Энергию Гиббса реакции окисления рассчитывают по уравнению
ΔG
= ΔG0
-
![]() ,
,
где ΔG0
–
стандартная энергия Гиббса реакции;
![]() – относительное парциальное давление
кислорода (р/100).
– относительное парциальное давление
кислорода (р/100).
Стандартные значения ΔG0 приведены в справочниках. Для подавляющего большинства металлов стандартная энергия Гиббса их окисления ниже нуля, что говорит о возможности протекания этой реакции при атмосферном давлении кислорода.
Для большинства металлов условие ΔG0>0, при котором коррозия невозможна, проявляется при очень низких давлениях кислорода, не реализуемых на практике.