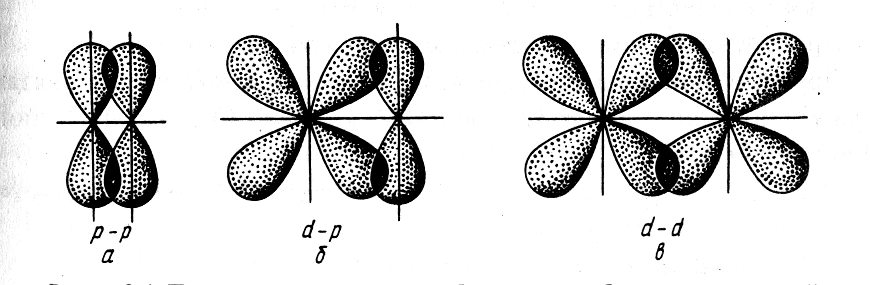- •И. В. Крепышева
- •Содержание
- •Тема 7. Химия металлов 125
- •1.2. Квантово-механическая модель атома водорода
- •1.3. Строение многоэлектронных атомов
- •1.4. Периодическая система элементов д.И. Менделеева
- •1.5. Периодические свойства элементов
- •1.6. Решение типовых задач
- •1.7. Задачи для самостоятельного решения
- •Тема 2. Химическая связь
- •2.1. Ковалентная связь
- •2.2. Гибридизация атомных орбиталей
- •2.3. Ионная химическая связь
- •2.4. Металлическая связь
- •2.5. Водородная связь
- •2.6. Строение твердого тела
- •Тема 3. Элементы химической термодинамики
- •3.1. Основные понятия термодинамики
- •3.2. Внутренняя энергия
- •3.3. Энтальпия
- •3.4. Термохимия. Закон Гесса
- •3.5. Энтропия
- •3.6. Самопроизвольные процессы. Энергия Гиббса
- •3.7. Решение типовых задач
- •3.8. Задачи для самостоятельного решения
- •Тема 4. Химическая кинетика и химическое равновесие
- •4.1. Скорость химической реакции
- •4.2. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •4.3. Зависимость скорости реакции от температуры
- •4.4. Катализ
- •4.5. Химическое равновесие
- •4.6. Смещение химического равновесия. Принцип Ле Шателье
- •4.7. Решение типовых задач
- •4.8. Задачи для самостоятельного решения
- •Тема 5. Растворы. Дисперсные системы
- •5.1. Общие свойства растворов
- •5.2. Способы выражения состава растворов
- •5.3. Теория электролитической диссоциации
- •5.4. Теории кислот и оснований
- •5.5. Ионные реакции в растворах
- •5.6. Ионное произведение воды. Водородный показатель рН
- •5.7. Гидролиз солей
- •5.8. Дисперсные системы и их классификация
- •5.9. Решение типовых задач
- •28,57 Г соли растворены в 71,43 г воды
- •3% Массы раствора составляют 48,84 г
- •Соотношение между рН и рОн
- •5.10. Задачи для самостоятельного решения
- •Тема 6. Окислительно-восстановительные электрохимические процессы
- •6.1. Основные понятия
- •Правила определения степени окисления
- •6.2. Составление уравнений окислительно-восстановительных реакций
- •6.3. Влияние среды на характер протекания реакций
- •6.4. Важнейшие окислители и восстановители
- •6.5. Электрохимические процессы
- •96500 Кл (26,8 а∙ч) – 31,77 г Cu (масса моля эквивалентов)
- •96500 Кл – 1 г (11,2 л– объем моля эквивалентов)
- •6.6. Гальванический элемент Даниэля-Якоби
- •6.7. Окислительно-восстановительные потенциалы
- •6.8. Эдс окислительно-восстановительных реакций
- •6.9. Электролиз расплавов и растворов солей
- •6.10. Некоторые области применения электрохимии
- •6.11. Решение типовых задач
- •6.12. Задачи для самостоятельного решения
- •Тема 7. Химия металлов
- •7.1. Общая характеристика металлов
- •7.2. Химические свойства металлов
- •7.3. Взаимодействие металлов с кислотами
- •Взаимодействие металлов с соляной кислотой.
- •Взаимодействие металлов с азотной кислотой
- •Взаимодействие металлов с серной кислотой
- •7.4. Сплавы
- •7.5. Получение металлов
- •Тема 8. Коррозия и защита металлов
- •8.1. Определение и классификация коррозионных процессов
- •8.2. Химическая коррозия
- •8.3. Электрохимическая коррозия
- •8.4. Возможность коррозии с водородной и кислородной деполяризацией
- •8.5. Защита металлов от коррозии
- •8.6. Решение типовых задач
- •8.7. Задачи для самостоятельного решения
- •Тема 9. Органические полимерные материалы
- •9.1. Классификация полимерных (высокомолекулярных) материалов
- •9.2. Строение полимеров
- •9.3. Кристаллическое и аморфное состояние полимеров
- •9.4. Методы получения полимеров
- •9.5. Применение полимеров
- •Тема 10. Химическая идентификация и анализ вещества
- •10.1. Химическая идентификация вещества
- •Некоторые реагенты для идентификации катионов
- •Классификация анионов по окислительно-восстановительным свойствам
- •Некоторые реагенты для идентификации анионов
- •10.2. Количественный анализ. Химические методы анализа
- •10.3. Инструментальные методы анализа
- •Приложение
- •Важнейшие единицы си и их соотношение с единицами других систем
- •Приставки для дольных и кратных единиц си
- •Термодинамические характеристики некоторых веществ при 298 к
- •Стандартные потенциалы металлических
- •Энергия разрыва связи
- •Электроотрицательность элементов по Полингу
- •Стандартные окислительно-восстановительные потенциалы элементов
- •Растворимость соединений
- •Обозначения: р – растворимый, м – малорастворимый, н – нерастворимый,
- •Константы диссоциации Кд слабых электролитов
- •Распределение электронов в атоме
- •Список литературы
- •Крепышева Ирина Вадимовна
- •Учебное пособие для самостоятельной работы студентов
- •Нехимических специальностей и направлений
2.1. Ковалентная связь
Химическая связь, образованная путем обобществления пары электронов двумя атомами, называется ковалентной связью.
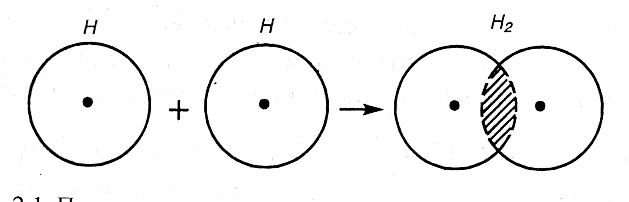
Рассмотрим для примера образование ковалентной связи в молекуле водорода. При сближении атомов водорода происходит проникновение их электронных облаков друг в друга, которое называется перекрыванием электронных облаков (рис.2.1.)
|
|
|
Рис. 2.1. Перекрывание электронных облаков при образовании молекулы водорода |
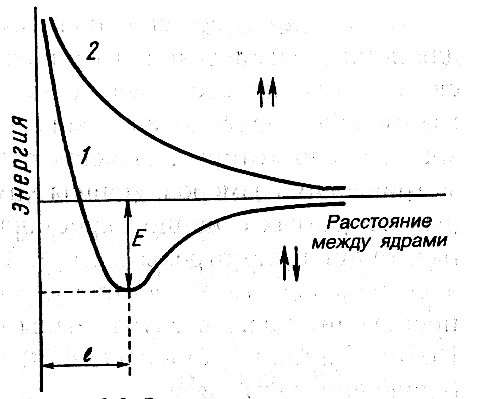
Электронная плотность между ядрами возрастает. Ядра притягиваются друг к другу. Вследствие этого снижается энергия системы (рис. 2.2.).
|
Однако при очень сильном сближении атомов возрастает отталкивание ядер. Поэтому оптимальное расстояние между ядрами (длина связи lсв), при котором система имеет минимальную энергию. При таком состоянии выделяется энергия, называемая энергией связи Есв. Ковалентная связь обладает насыщаемостью и направленностью. Насыщаемость ковалентной связи вызывается ограничением числа электронов, находящихся на внешних оболочках, которые могут участвовать в образовании ковалентной связи. |
Рис. 2.2. Зависимость энергии систем из двух атомов водорода с параллельными (1) и антипараллельными (2) спинами от расстояния между ядрами. Е – энергия связи |
Так как атомные орбитали пространственно ориентированы, то перекрывание электронных облаков происходит по определённым направлениям, что и обусловливает направленность ковалентной связи. Количественно направленность выражается в виде валентных углов между направлениями химической связи в молекулах и твердых телах.
Полярность
ковалентной связи.
Если ковалентная связь образована
одинаковыми атомами, например
![]() ,
то обобществленные электроны равномерно
распределены между ними. Такая связь
называетсяковалентной
неполярной связью.
,
то обобществленные электроны равномерно
распределены между ними. Такая связь
называетсяковалентной
неполярной связью.
В молекулах состоящих из атомов разных элементов, связующее электронное облако оттягивается к тому из них, у которого больше значение электроотицательности. Это полярная ковалентная связь. Разность электроотицательности атомов характеризует полярность связи.
В результате смещения электронной пары первый атом приобретает избыточный отрицательный заряд, а второй избыточный отрицательный заряд. Эти заряды называются эффективными зарядами атомов в молекуле δ- и δ+. Вследствие этого возникает диполь, представляющий собой электрически нейтральную систему с двумя одинаковыми по величине положительным и отрицательным зарядами, находящимися на определенном расстоянии (длина диполя) lд друг от друга. Мерой полярности связи служит электрический момент диполя µсв, равный произведению эффективного заряда σ на длину диполя lд
![]()
Электрический момент диполя имеет единицу измерения кулон на метр (Кл · м). В качестве единицы измерения используют также внесистемную единицу измерения дебай D, равную 3,3 · 10-30 Кл · м (табл. 2.1.).
Как видно и табл. 2.2, электрический момент диполя растет с увеличением разности ЭО.
Таблица 2.2. Электрический момент диполя химической связи в молекулах
|
Связь |
Разность ЭО |
µсв, D |
|
Связь |
Разность ЭО |
µсв, D |
|
H-F |
1,9 |
1,98 |
H-O |
1,4 |
1,53 | |
|
H-Cl |
0,7 |
1,03 |
H-N |
0,9 |
1,3 | |
|
H-Br |
0,74 |
0,78 |
H-S |
0,4 |
0,7 | |
|
H-I |
0,4 |
0,38 |
H-C |
0,4 |
0,3 |
Полярную ковалентную связь с δ, приближающемуся к 1, можно считать ионной связью. Однако, даже у ионных соединений δ ниже единицы. Поэтому любая ионная связь имеет определенную долю ковалентности.
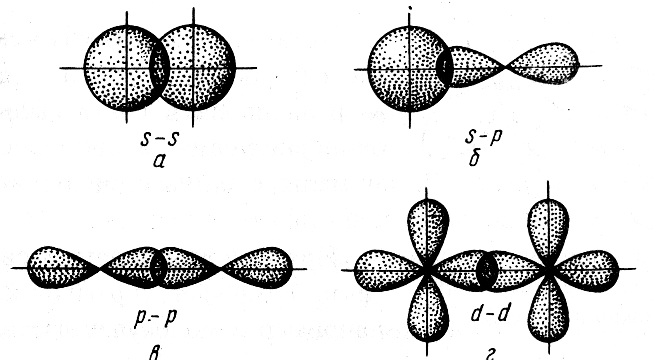
Сигма-связь. Как уже говорилось, ковалентная химическая связь характеризуется направленностью, что обусловлено определенными ориентациями атомных орбиталей (АО) в пространстве. Связь, образованная перекрыванием АО по линии, соединяющей ядра взаимодействующих атомов, называется σ-связью.
|
Рис. 2.3. Перекрывание атомных орбиталей при образовании σ-связей |
Сигма-связь может возникать при перекрывании s-орбиталей (рис. 2.3, а), s- и р-орбиталей (рис. 2.3, б), d-орбиталей (рис. 2.3, в), а также d- и s-орбиталей, d- и р-орбиталей и f-орбиталей друг с другом и другими орбиталями. Сигма-связь обычно охватывает два атома и не простирается за их пределы, поэтому является локализованной двухцентровой связью. |
Кратные связи. Кроме простых σ-связей существуют кратные (двойные и тройные) связи, которые образуются при наложении σ-, π- и δ-связей.
Связь, образованная перекрыванием АО по обе стороны линии, соединяющей ядра атомов (боковые перекрывания), называется π-связью.
|
Рис. 2.4. Перекрывание атомных орбиталей при образовании π-связей |
Пи-связь может образовываться при перекрывании р – р-орбиталей (рис. 2.4, а), р – d-орбиталей (рис. 2.4, б), d – d-орбиталей (рис. 2.4, в), а также f – p-, f – d- и f – f-орбиталей. |
Связь, образованная перекрыванием d-орбиталей всеми четырьмя лепестками, называется δ-связью.
Соответственно, s-элементы могут образовывать только σ-связи, р-элементы - σ- и π-связи, d-элементы - σ-, π- и δ-связи, а f-элементы - σ-, π-, δ- и еще более сложные связи. В связи с меньшим перекрыванием АО прочность у π- и δ-связей ниже, чем у σ-связей.
При наложении π-связи на σ-связь образуется двойная связь, например в молекулах кислорода, диоксида углерода. Кратная связь изображается двумя черточками: О=О, О=С=О.
Хотя энергия π-связи меньше, чем энергия σ-связи, однако суммарная энергия двойной связи выше энергии одинарной связи, а длина двойной связи меньше длины одинарной связи (табл. 2.1.).
Число связей между атомами называется кратностью связи.
В некоторых молекулах и ионах, содержащих двойные связи, π-связи являются делокализованными, т.е. охватывающими не два атома, а часть или целые молекулы или ионы.
Донорно-акцепторный механизм образования ковалентной связи. Донорно-акцепторная связь - разновидность ковалентной связи.
Если одна из двух
молекул имеет атом со свободными
орбиталями, а другая – атом с парой
неподеленных электронов, то между ними
происходит донорно-акцепторное
взаимодействие,
которое приводит к образованию ковалентной
связи, например у иона аммония
![]() атом азота образует четыре ковалентные
связи с водородом, хотя у атома азота
всего три неспаренных электрона.
атом азота образует четыре ковалентные
связи с водородом, хотя у атома азота
всего три неспаренных электрона.
Азот молекулы аммиака, имеющий три ковалентные связи с тремя атомами водорода по обменному механизму, имеет неподеленную пару электронов
![]() ,
,
которая может взаимодействовать со свободной орбиталью иона водорода Н+, образуя четвертую ковалентную связь:
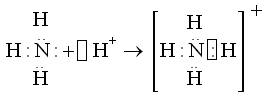
Четвертая ковалентная связь, образованная по донорно-акцепторному механизму, характеризуется теми же параметрами, что и остальные три ковалентные связи, образованные по обменному механизму, т.е. в ионе аммония все четыре связи равноценны.
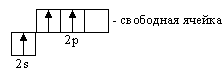
Ковалентная связь по донорно-акцепторному механизму образуется при взаимодействии многих атомов, ионов и молекул. Например,
![]()
*
![]()

![]()
![]()
Атом азота отдает на связь пару электронов, а атом бора – вакантную орбиталь.

![]()
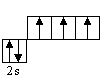
![]() – комплексное соединение
– комплексное соединение
В полученном соединении суммарные валентности бора и азота равны 4.
Аналогичным путем
образуется комплексное соединение
![]() при взаимодействии
при взаимодействии![]() и
и![]() ,
которое записывается
,
которое записывается![]() .
.
Атом, предоставляющий электронную пару, называется донором, а атом, представляющий свободную орбиталь называется акцептором.
Сложные соединения, у которых имеются ковалентные связи, образованные по донорно-акцепторному механизму, называются комплексными или координационными соединениями.
Донорно-акцепторная связь обладает такими же свойствами, как и ковалентная связь: насыщаемостью и направленностью.
Валентность – общее число химических связей, которые образуют один атом элемента в молекуле определенного соединения.
Ковалентность – определяют по общему числу ковалентных и донорно-акцепторных связей, которые образует один атом элемента в молекуле.