
- •И. В. Крепышева
- •Содержание
- •Тема 7. Химия металлов 125
- •1.2. Квантово-механическая модель атома водорода
- •1.3. Строение многоэлектронных атомов
- •1.4. Периодическая система элементов д.И. Менделеева
- •1.5. Периодические свойства элементов
- •1.6. Решение типовых задач
- •1.7. Задачи для самостоятельного решения
- •Тема 2. Химическая связь
- •2.1. Ковалентная связь
- •2.2. Гибридизация атомных орбиталей
- •2.3. Ионная химическая связь
- •2.4. Металлическая связь
- •2.5. Водородная связь
- •2.6. Строение твердого тела
- •Тема 3. Элементы химической термодинамики
- •3.1. Основные понятия термодинамики
- •3.2. Внутренняя энергия
- •3.3. Энтальпия
- •3.4. Термохимия. Закон Гесса
- •3.5. Энтропия
- •3.6. Самопроизвольные процессы. Энергия Гиббса
- •3.7. Решение типовых задач
- •3.8. Задачи для самостоятельного решения
- •Тема 4. Химическая кинетика и химическое равновесие
- •4.1. Скорость химической реакции
- •4.2. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •4.3. Зависимость скорости реакции от температуры
- •4.4. Катализ
- •4.5. Химическое равновесие
- •4.6. Смещение химического равновесия. Принцип Ле Шателье
- •4.7. Решение типовых задач
- •4.8. Задачи для самостоятельного решения
- •Тема 5. Растворы. Дисперсные системы
- •5.1. Общие свойства растворов
- •5.2. Способы выражения состава растворов
- •5.3. Теория электролитической диссоциации
- •5.4. Теории кислот и оснований
- •5.5. Ионные реакции в растворах
- •5.6. Ионное произведение воды. Водородный показатель рН
- •5.7. Гидролиз солей
- •5.8. Дисперсные системы и их классификация
- •5.9. Решение типовых задач
- •28,57 Г соли растворены в 71,43 г воды
- •3% Массы раствора составляют 48,84 г
- •Соотношение между рН и рОн
- •5.10. Задачи для самостоятельного решения
- •Тема 6. Окислительно-восстановительные электрохимические процессы
- •6.1. Основные понятия
- •Правила определения степени окисления
- •6.2. Составление уравнений окислительно-восстановительных реакций
- •6.3. Влияние среды на характер протекания реакций
- •6.4. Важнейшие окислители и восстановители
- •6.5. Электрохимические процессы
- •96500 Кл (26,8 а∙ч) – 31,77 г Cu (масса моля эквивалентов)
- •96500 Кл – 1 г (11,2 л– объем моля эквивалентов)
- •6.6. Гальванический элемент Даниэля-Якоби
- •6.7. Окислительно-восстановительные потенциалы
- •6.8. Эдс окислительно-восстановительных реакций
- •6.9. Электролиз расплавов и растворов солей
- •6.10. Некоторые области применения электрохимии
- •6.11. Решение типовых задач
- •6.12. Задачи для самостоятельного решения
- •Тема 7. Химия металлов
- •7.1. Общая характеристика металлов
- •7.2. Химические свойства металлов
- •7.3. Взаимодействие металлов с кислотами
- •Взаимодействие металлов с соляной кислотой.
- •Взаимодействие металлов с азотной кислотой
- •Взаимодействие металлов с серной кислотой
- •7.4. Сплавы
- •7.5. Получение металлов
- •Тема 8. Коррозия и защита металлов
- •8.1. Определение и классификация коррозионных процессов
- •8.2. Химическая коррозия
- •8.3. Электрохимическая коррозия
- •8.4. Возможность коррозии с водородной и кислородной деполяризацией
- •8.5. Защита металлов от коррозии
- •8.6. Решение типовых задач
- •8.7. Задачи для самостоятельного решения
- •Тема 9. Органические полимерные материалы
- •9.1. Классификация полимерных (высокомолекулярных) материалов
- •9.2. Строение полимеров
- •9.3. Кристаллическое и аморфное состояние полимеров
- •9.4. Методы получения полимеров
- •9.5. Применение полимеров
- •Тема 10. Химическая идентификация и анализ вещества
- •10.1. Химическая идентификация вещества
- •Некоторые реагенты для идентификации катионов
- •Классификация анионов по окислительно-восстановительным свойствам
- •Некоторые реагенты для идентификации анионов
- •10.2. Количественный анализ. Химические методы анализа
- •10.3. Инструментальные методы анализа
- •Приложение
- •Важнейшие единицы си и их соотношение с единицами других систем
- •Приставки для дольных и кратных единиц си
- •Термодинамические характеристики некоторых веществ при 298 к
- •Стандартные потенциалы металлических
- •Энергия разрыва связи
- •Электроотрицательность элементов по Полингу
- •Стандартные окислительно-восстановительные потенциалы элементов
- •Растворимость соединений
- •Обозначения: р – растворимый, м – малорастворимый, н – нерастворимый,
- •Константы диссоциации Кд слабых электролитов
- •Распределение электронов в атоме
- •Список литературы
- •Крепышева Ирина Вадимовна
- •Учебное пособие для самостоятельной работы студентов
- •Нехимических специальностей и направлений
5.4. Теории кислот и оснований
Кислотно-основные взаимодействия широко распространены в природе и технике, поэтому давно привлекали внимание ученых, предложивших несколько теорий этих процессов. Большинство теорий не противоречат друг другу, но имеют различные области применения. Наиболее известны теория, основанная на механизме электролитической диссоциации, протонная и электронная теории кислот и оснований.
Согласно теории электролитической диссоциации, применимой к водным растворам, кислотой является электролит, который диссоциирует с образованием ионов Н+. Сильные кислоты диссоциируют практически полностью, у слабых диссоциирована лишь часть молекул. О силе кислот можно судить по константе диссоциации. Чем больше константа диссоциации, тем более диссоциирована кислота.
Электролит, диссоциирующий с образованием ионов ОН-, называют основанием.
Существуют электролиты, которые могут диссоциировать как кислоты, и как основания:
H+ + RO- ↔ ROH ↔ R+ + OH-
Такие электролиты называют амфотерными электролитами. Амфотерность электролитов объясняется малым различием связей R –H и
O – H. Примером амфотерного электролита может быть гидроксид цинка:
2H+ + [Zn(OH)4]2- ↔ Zn(OH)2 + 2H2O ↔ [Zn(H2O)2]2+ + 2OH-
При взаимодействии гидроксида цинка, например, с азотной кислотой образуется нитрат цинка:
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
при взаимодействии же с гидроксидом калия – цинкат калия:
Zn(OH)2 + 2KOH = K2[Zn(OH)4]
К амфотерным электролитам также относятся гидроксиды алюминия Al(OH)3, свинца Pb(OH)2, олова Sn(OH)2 и др.
Теория электролитической диссоциации неприменима к взаимодействиям, не сопровождающимся диссоциацией на ионы. Например, аммиак, реагируя с безводным фторидом водорода, образует соль фторид аммония NH3 + HF = NH4F. Аммиак, не имея в своем составе гидроксидной группы, ведет себя как основание.
В 1923 г. Д. Брендстедом была предложена протонная теория кислот и оснований, применяемая как к водным, так и неводным средам. Согласно протонной теории, кислоту считают донором протонов, а основание – акцептором протонов. При взаимодействии кислота отдает, а основание принимает протон. Соотношение между основанием и кислотой можно представить схемой
Основание + Протон → Кислота
Основание и кислота, связанные данным соотношением, называются сопряженными. Взаимодействие между кислотой и основанием согласно протонной теории обозначается схемой
Кислота 1 + Основание 2 = Кислота 2 + Основание 1
Например, реакцию аммиака и фторида водорода можно записать уравнением
HF + NH3 ↔ NH4+ + F-
Кислота 1 Основание 2 Кислота 2 Основание 1
В этом уравнении кислоте HF соответствует сопряженное основание F-, а основанию NH3 – сопряженная кислота NH4+. В зависимости от партнера то или иное вещество может быть или кислотой, или основанием. Например, вода по отношению к аммиаку является кислотой, а по отношению к фториду водорода – основанием:
H2O + NH3 ↔ OH- + NH4+
HF + H2O ↔ F- + Н3О+
кислота основание основание кислота
Таким образом, как и во всех протолитических процессах, продуктом взаимодействия кислоты и основания является не соль, а сопряженные кислота и основание.
В 1924 г. Дж. Льюис выдвинул и обосновал электронную теорию кислот и оснований, согласно которой кислота является акцептором, а основание – донором электронов. Если в состав кислоты входит водород, то она называется водородной. Однако кислота может и не содержать атома водорода, такая кислота называется апротонной. Взаимодействие кислоты и основания, по Льюису, приводит к образованию ковалентной связи по донорно-акцепторному механизму:
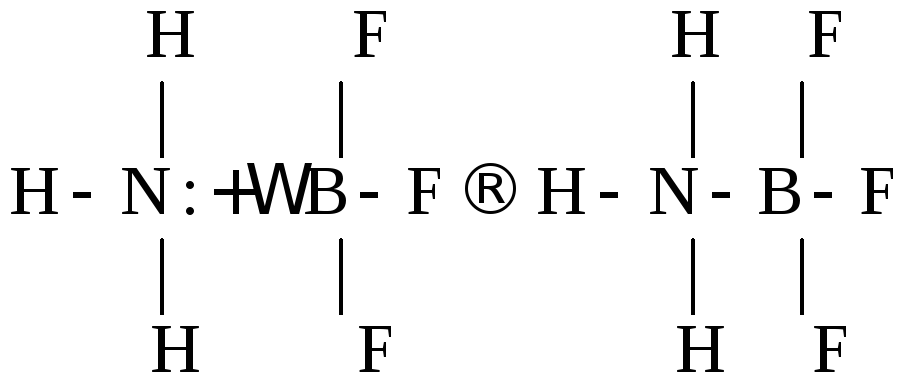
основание кислота продукт нейтрализации
Электронная теория охватывает более широкий круг соединений, чем протонная теория.
