
- •И. В. Крепышева
- •Содержание
- •Тема 7. Химия металлов 125
- •1.2. Квантово-механическая модель атома водорода
- •1.3. Строение многоэлектронных атомов
- •1.4. Периодическая система элементов д.И. Менделеева
- •1.5. Периодические свойства элементов
- •1.6. Решение типовых задач
- •1.7. Задачи для самостоятельного решения
- •Тема 2. Химическая связь
- •2.1. Ковалентная связь
- •2.2. Гибридизация атомных орбиталей
- •2.3. Ионная химическая связь
- •2.4. Металлическая связь
- •2.5. Водородная связь
- •2.6. Строение твердого тела
- •Тема 3. Элементы химической термодинамики
- •3.1. Основные понятия термодинамики
- •3.2. Внутренняя энергия
- •3.3. Энтальпия
- •3.4. Термохимия. Закон Гесса
- •3.5. Энтропия
- •3.6. Самопроизвольные процессы. Энергия Гиббса
- •3.7. Решение типовых задач
- •3.8. Задачи для самостоятельного решения
- •Тема 4. Химическая кинетика и химическое равновесие
- •4.1. Скорость химической реакции
- •4.2. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •4.3. Зависимость скорости реакции от температуры
- •4.4. Катализ
- •4.5. Химическое равновесие
- •4.6. Смещение химического равновесия. Принцип Ле Шателье
- •4.7. Решение типовых задач
- •4.8. Задачи для самостоятельного решения
- •Тема 5. Растворы. Дисперсные системы
- •5.1. Общие свойства растворов
- •5.2. Способы выражения состава растворов
- •5.3. Теория электролитической диссоциации
- •5.4. Теории кислот и оснований
- •5.5. Ионные реакции в растворах
- •5.6. Ионное произведение воды. Водородный показатель рН
- •5.7. Гидролиз солей
- •5.8. Дисперсные системы и их классификация
- •5.9. Решение типовых задач
- •28,57 Г соли растворены в 71,43 г воды
- •3% Массы раствора составляют 48,84 г
- •Соотношение между рН и рОн
- •5.10. Задачи для самостоятельного решения
- •Тема 6. Окислительно-восстановительные электрохимические процессы
- •6.1. Основные понятия
- •Правила определения степени окисления
- •6.2. Составление уравнений окислительно-восстановительных реакций
- •6.3. Влияние среды на характер протекания реакций
- •6.4. Важнейшие окислители и восстановители
- •6.5. Электрохимические процессы
- •96500 Кл (26,8 а∙ч) – 31,77 г Cu (масса моля эквивалентов)
- •96500 Кл – 1 г (11,2 л– объем моля эквивалентов)
- •6.6. Гальванический элемент Даниэля-Якоби
- •6.7. Окислительно-восстановительные потенциалы
- •6.8. Эдс окислительно-восстановительных реакций
- •6.9. Электролиз расплавов и растворов солей
- •6.10. Некоторые области применения электрохимии
- •6.11. Решение типовых задач
- •6.12. Задачи для самостоятельного решения
- •Тема 7. Химия металлов
- •7.1. Общая характеристика металлов
- •7.2. Химические свойства металлов
- •7.3. Взаимодействие металлов с кислотами
- •Взаимодействие металлов с соляной кислотой.
- •Взаимодействие металлов с азотной кислотой
- •Взаимодействие металлов с серной кислотой
- •7.4. Сплавы
- •7.5. Получение металлов
- •Тема 8. Коррозия и защита металлов
- •8.1. Определение и классификация коррозионных процессов
- •8.2. Химическая коррозия
- •8.3. Электрохимическая коррозия
- •8.4. Возможность коррозии с водородной и кислородной деполяризацией
- •8.5. Защита металлов от коррозии
- •8.6. Решение типовых задач
- •8.7. Задачи для самостоятельного решения
- •Тема 9. Органические полимерные материалы
- •9.1. Классификация полимерных (высокомолекулярных) материалов
- •9.2. Строение полимеров
- •9.3. Кристаллическое и аморфное состояние полимеров
- •9.4. Методы получения полимеров
- •9.5. Применение полимеров
- •Тема 10. Химическая идентификация и анализ вещества
- •10.1. Химическая идентификация вещества
- •Некоторые реагенты для идентификации катионов
- •Классификация анионов по окислительно-восстановительным свойствам
- •Некоторые реагенты для идентификации анионов
- •10.2. Количественный анализ. Химические методы анализа
- •10.3. Инструментальные методы анализа
- •Приложение
- •Важнейшие единицы си и их соотношение с единицами других систем
- •Приставки для дольных и кратных единиц си
- •Термодинамические характеристики некоторых веществ при 298 к
- •Стандартные потенциалы металлических
- •Энергия разрыва связи
- •Электроотрицательность элементов по Полингу
- •Стандартные окислительно-восстановительные потенциалы элементов
- •Растворимость соединений
- •Обозначения: р – растворимый, м – малорастворимый, н – нерастворимый,
- •Константы диссоциации Кд слабых электролитов
- •Распределение электронов в атоме
- •Список литературы
- •Крепышева Ирина Вадимовна
- •Учебное пособие для самостоятельной работы студентов
- •Нехимических специальностей и направлений
5.9. Решение типовых задач
Пример 1.
В 450 г воды
растворили 50 г
![]() .
Вычислить процентное содержание
кристаллогидрата и безводной соли.
.
Вычислить процентное содержание
кристаллогидрата и безводной соли.
Решение. Общая масса раствора составляет 500 г. Процентное содержание кристаллогидрата находим из пропорции:
-
500 г раствора
−
100%
50 » растворенного вещества
−
х »
![]()
Процентное
содержание безводной соли
![]() составит
составит
![]() ,
,
где 31,96 – количество
граммов
![]() ,
отвечающее 50 г
,
отвечающее 50 г![]() .
.
Предельную растворимость вещества выражают количеством граммов вещества, которое растворяется в 100 г воды при данной температуре.
Очевидно, если
предельная растворимость
![]() при 0°С
составляет 27,6 г, то насыщенный при
указанной температуре раствор содержит
при 0°С
составляет 27,6 г, то насыщенный при
указанной температуре раствор содержит
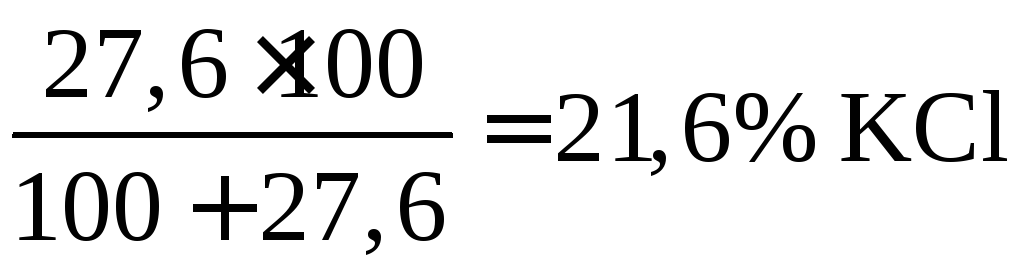 .
.
Если известно, что
насыщенный при 40°С
раствор
![]() содержит 28,57% растворенной соли, то
предельная растворимость вычисляется
из пропорции:
содержит 28,57% растворенной соли, то
предельная растворимость вычисляется
из пропорции:
28,57 Г соли растворены в 71,43 г воды
х » » » » 100 » »
 г соли.
г соли.
Пример 2.
Сколько
граммов соли и воды содержится в 800 г
12%-ного раствора
![]() ?
?
Решение. Масса растворенной соли составляет 12% от массы раствора, т. е.
![]() г
г
![]() ,
,
а масса растворителя составляет 88% от массы раствора, т.е.
 г воды.
г воды.
Пример 3.
Сколько
граммов 3%-ного раствора
![]() можно приготовить из 100 г
можно приготовить из 100 г![]() ?
?
Решение. В
100 г
![]() содержится
содержится
![]() г
г
безводной соли. Согласно условию задачи масса безводной соли составляет 3% массы раствора.
3% Массы раствора составляют 48,84 г
100 » » » » х »
![]() г.
г.
Пример 4. Сколько граммов 5%-ного раствора КОН можно приготовить из едкого кали и 100 г воды?
Решение. Согласно условию задачи 100 г воды составляют 95% массы всего раствора. Отсюда масса раствора равна
![]() г.
г.
Пример 5.
Сколько
граммов
![]() следует растворить в 250 г воды для
получения 10%-ного раствора
следует растворить в 250 г воды для
получения 10%-ного раствора![]() ?
?
Решение. 250
г воды составляют 90 % массы раствора.
Масса
![]() составляет 10% массы раствора или
составляет 10% массы раствора или
![]() г
г
![]() .
.
Пример 6.
В каком
количестве граммов воды следует
растворить 100 г
![]() для получения раствора, содержащего 5%
безводной соли?
для получения раствора, содержащего 5%
безводной соли?
Решение. 100
г
![]() содержит 48,84 г
содержит 48,84 г![]() и 51,16 г воды. Согласно условию 48,84 г соли
составляют 5% массы раствора. Отсюда
масса растворителя равна
и 51,16 г воды. Согласно условию 48,84 г соли
составляют 5% массы раствора. Отсюда
масса растворителя равна
![]() г.
г.
Следовательно, остается добавить 928 – 51,2 = 876,8 г воды.
Можно найти сначала общую массу раствора, которая составит
![]() г,
г,
а затем массу растворителя:
976,8 – 100 = 876,8 г воды.
Пример 7. Сколько граммов 10%-ного раствора H2SO4 требуется для обменного взаимодействия с 100 мл 13,7%-ного раствора Na2CO3 (ρ = 1,145).
Решение. Масса 100 мл раствора составляет 114,5 г и содержит
114,5 ∙ 0,137 = 15,68 г Na2CO3.
Из уравнения реакции
Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O
Находим необходимое количество серной кислоты:
![]() г,
г,
а 10%-ного раствора H2SO4 потребуется
![]() г.
г.
Пример 8. Сколько миллилитров 9,5%-ного раствора Na2CO3 (ρ = 1,10) следует добавить к 100 г воды для получения 3%-ного раствора?
Решение. Обозначим искомый объем раствора через x мл. Масса его в этом случае равна х · 1,10 г, а масса содержащегося в нем Na2CO3 равна х ∙ 1,10 · 0,095 г. Согласно уравнению задачи, масса растворенного вещества составляет 3% от массы полученного раствора (1,10х + 100):
 ,
,
х ≈ 42 мл.
Пример 9. Сколько мл 35%-ного раствора аммиака (ρ = 0,94) требуется для образования 33г (NH4)2SO4?
Решение. Из уравнения реакции
2NH3 + H2SO4 = (NH4)2SO4
находим массу аммиака:
![]() г,
г,
а 35%-ного раствора потребуется
![]() г,
или
г,
или
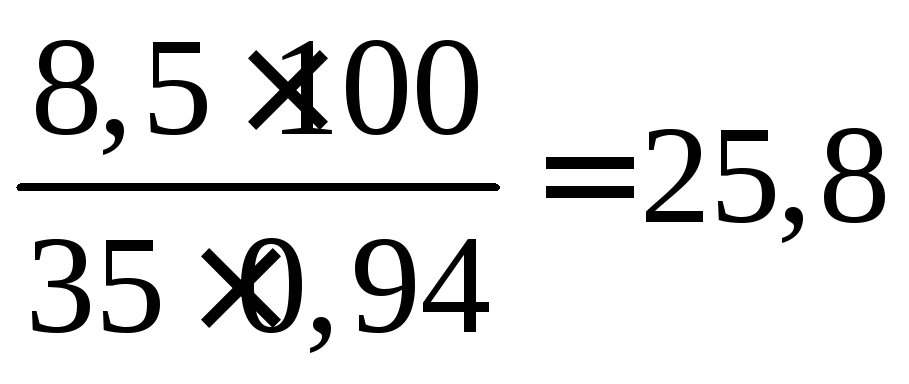 мл.
мл.
Пример 10. Сколько мл 32,5%-ного раствора NH3 (ρ = 0,888) требуется для образования сульфата аммония (NH4)2SO4 с 250 мл 27,3%-ного раствора H2SO4 (ρ = 1,2)?
Решение. Масса раствора кислоты составляет 250 ∙ 1,2 = 300 г. Раствор содержит 300 · 0,273 = 81,9 г H2SO4 . Согласно уравнению
2NH3 + H2SO4 = (NH4)2SO4
вычисляем массу аммиака, вошедшего в реакцию; она составляет
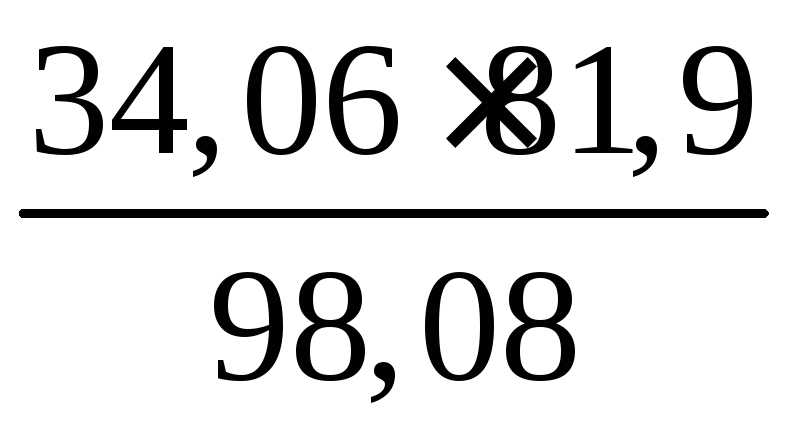 г NH3.
г NH3.
Этому количеству граммов NH3 соответствует
 г
г
или
 мл
мл
его 32,5%-ного раствора.
Пример 11. Вычислить молярную концентрацию, молярную концентрацию эквивалента, титр и моляльность 10% - го раствора Al2(SO4)3 (ρ = 1,105 г/см3).
Решение. 1. Масса 1 л раствора тр-ра = ρVр-ра = 1,105 ∙1000 =115 г. По определению массовой доли, в 100 г раствора содержится 10 г Al2(SO4)3, следовательно, в 1105 г (т. е. в 1 л) соответственно (1105 ·10)/100 = 110,5 г. Молярная масса Al2(SO4)3 М(Al2(SO4)3) = 342 г/моль. Таким образом, в 1 л раствора содержится 110,5/342 = 0,32 моль Al2(SO4)3 и молярная концентрация раствора см равна 0,32 моль/л.
2. Эквивалент молекулы Al2(SO4)3 равен 1/6 молекулы: Э(Al2(SO4)3) = 1/6 (М(Al2(SO4)3)). Следовательно, в одном моле Al2(SO4)3 содержится шесть моль-эквивалентов, а в 1 л данного раствора 0,32 · 6 = 1,92 моль-экв Al2(SO4)3. Молярная концентрация эквивалента (или нормальная концентрация) сн равна 1,92 моль/л или 1,92 н.
3. Поскольку выше было найдено, что в 1000 мл раствора содержится 110,5 г растворенного вещества, то в 1 мл находится 110,5/1000 = 0,1105 г Al2(SO4)3 и титр раствора Т = 0,1105 г/мл.
4. По условию в 100 г раствора содержится 10 г Al2(SO4)3 и 90 г Н2О. Тогда на 1000 г воды приходится (1000 · 10)/90 = 111,11 г Al2(SO4)3. Это составляет 111,11/342 = 0,325 моль. Следовательно, в 1000 г растворителя содержится 0,325 моль растворенного вещества Al2(SO4)3 и моляльность раствора ст, по определению, равна 0,325 моль/1000 г Н2О.
Пример 12. Константа диссоциации муравьиной кислоты НСООН, диссоциирующей по уравнению
![]()
составляет
![]() .
Вычислить
и
.
Вычислить
и
![]() для 0,3М
раствора этой кислоты.
для 0,3М
раствора этой кислоты.
Решение.

что соответствует 2,64 %
![]() моль/л;
моль/л;
Вариант решения. Напишем выражение для константы диссоциации в общем виде:
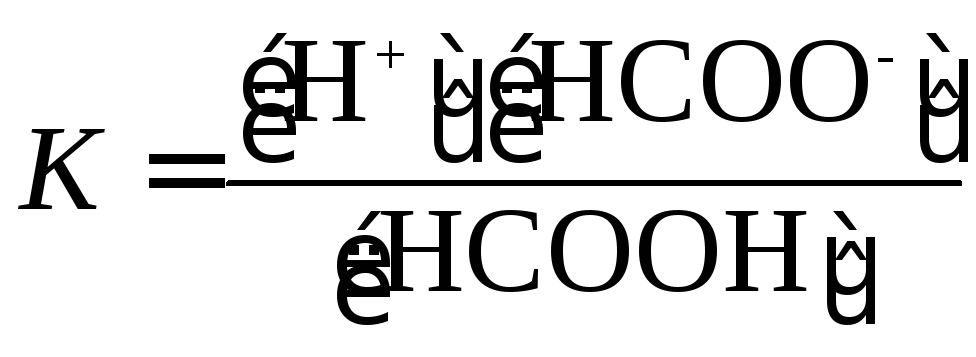 .
.
Числитель
представляет собой произведение
концентраций ионов; эти концентрации
равны друг другу, поэтому числитель
можно заменить выражением
![]() .
Знаменатель представляет собой
концентрацию недиссоциированной части
кислоты, которую, если пренебречь
диссоциированной частью, примем равной
общей концентрации электролита (то же
допущение делается и при выводе формулы
.
Знаменатель представляет собой
концентрацию недиссоциированной части
кислоты, которую, если пренебречь
диссоциированной частью, примем равной
общей концентрации электролита (то же
допущение делается и при выводе формулы![]() ,
когда величина 1 -
принимается равной 1). В этом случае
,
когда величина 1 -
принимается равной 1). В этом случае

Находим
![]() :
:
![]() моль/л;
моль/л;
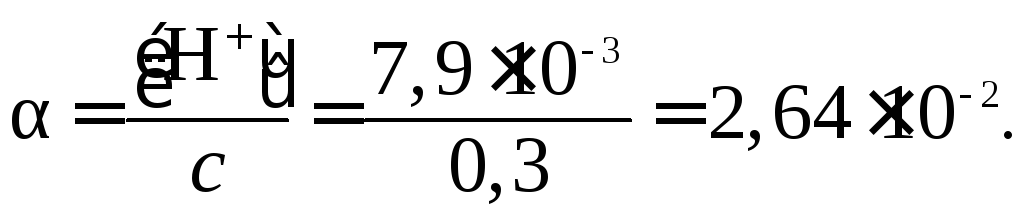
Пример 13.
Концентрация гидроксильных ионов
![]() моль/л.
Вычислить рН.
моль/л.
Вычислить рН.
Решение.
![]() моль/л,
моль/л,
![]()
Или, если
![]() моль/л, то
моль/л, то![]() Учитывая, что рН + рОН = 14, находим рН = 14
– 11,6 = 2,4.
Учитывая, что рН + рОН = 14, находим рН = 14
– 11,6 = 2,4.
Пример 14.
рН раствора составляет 4,3. Вычислить
![]() и
и
![]() .
.
Решение.
![]()
0,7 – это логарифм коэффициента, стоящего при 10-5. Этому логарифму соответствует число 5, следовательно,
![]() моль/л, а
моль/л, а
![]() моль/л.
моль/л.
