- •И. В. Крепышева
- •Содержание
- •Тема 7. Химия металлов 125
- •1.2. Квантово-механическая модель атома водорода
- •1.3. Строение многоэлектронных атомов
- •1.4. Периодическая система элементов д.И. Менделеева
- •1.5. Периодические свойства элементов
- •1.6. Решение типовых задач
- •1.7. Задачи для самостоятельного решения
- •Тема 2. Химическая связь
- •2.1. Ковалентная связь
- •2.2. Гибридизация атомных орбиталей
- •2.3. Ионная химическая связь
- •2.4. Металлическая связь
- •2.5. Водородная связь
- •2.6. Строение твердого тела
- •Тема 3. Элементы химической термодинамики
- •3.1. Основные понятия термодинамики
- •3.2. Внутренняя энергия
- •3.3. Энтальпия
- •3.4. Термохимия. Закон Гесса
- •3.5. Энтропия
- •3.6. Самопроизвольные процессы. Энергия Гиббса
- •3.7. Решение типовых задач
- •3.8. Задачи для самостоятельного решения
- •Тема 4. Химическая кинетика и химическое равновесие
- •4.1. Скорость химической реакции
- •4.2. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •4.3. Зависимость скорости реакции от температуры
- •4.4. Катализ
- •4.5. Химическое равновесие
- •4.6. Смещение химического равновесия. Принцип Ле Шателье
- •4.7. Решение типовых задач
- •4.8. Задачи для самостоятельного решения
- •Тема 5. Растворы. Дисперсные системы
- •5.1. Общие свойства растворов
- •5.2. Способы выражения состава растворов
- •5.3. Теория электролитической диссоциации
- •5.4. Теории кислот и оснований
- •5.5. Ионные реакции в растворах
- •5.6. Ионное произведение воды. Водородный показатель рН
- •5.7. Гидролиз солей
- •5.8. Дисперсные системы и их классификация
- •5.9. Решение типовых задач
- •28,57 Г соли растворены в 71,43 г воды
- •3% Массы раствора составляют 48,84 г
- •Соотношение между рН и рОн
- •5.10. Задачи для самостоятельного решения
- •Тема 6. Окислительно-восстановительные электрохимические процессы
- •6.1. Основные понятия
- •Правила определения степени окисления
- •6.2. Составление уравнений окислительно-восстановительных реакций
- •6.3. Влияние среды на характер протекания реакций
- •6.4. Важнейшие окислители и восстановители
- •6.5. Электрохимические процессы
- •96500 Кл (26,8 а∙ч) – 31,77 г Cu (масса моля эквивалентов)
- •96500 Кл – 1 г (11,2 л– объем моля эквивалентов)
- •6.6. Гальванический элемент Даниэля-Якоби
- •6.7. Окислительно-восстановительные потенциалы
- •6.8. Эдс окислительно-восстановительных реакций
- •6.9. Электролиз расплавов и растворов солей
- •6.10. Некоторые области применения электрохимии
- •6.11. Решение типовых задач
- •6.12. Задачи для самостоятельного решения
- •Тема 7. Химия металлов
- •7.1. Общая характеристика металлов
- •7.2. Химические свойства металлов
- •7.3. Взаимодействие металлов с кислотами
- •Взаимодействие металлов с соляной кислотой.
- •Взаимодействие металлов с азотной кислотой
- •Взаимодействие металлов с серной кислотой
- •7.4. Сплавы
- •7.5. Получение металлов
- •Тема 8. Коррозия и защита металлов
- •8.1. Определение и классификация коррозионных процессов
- •8.2. Химическая коррозия
- •8.3. Электрохимическая коррозия
- •8.4. Возможность коррозии с водородной и кислородной деполяризацией
- •8.5. Защита металлов от коррозии
- •8.6. Решение типовых задач
- •8.7. Задачи для самостоятельного решения
- •Тема 9. Органические полимерные материалы
- •9.1. Классификация полимерных (высокомолекулярных) материалов
- •9.2. Строение полимеров
- •9.3. Кристаллическое и аморфное состояние полимеров
- •9.4. Методы получения полимеров
- •9.5. Применение полимеров
- •Тема 10. Химическая идентификация и анализ вещества
- •10.1. Химическая идентификация вещества
- •Некоторые реагенты для идентификации катионов
- •Классификация анионов по окислительно-восстановительным свойствам
- •Некоторые реагенты для идентификации анионов
- •10.2. Количественный анализ. Химические методы анализа
- •10.3. Инструментальные методы анализа
- •Приложение
- •Важнейшие единицы си и их соотношение с единицами других систем
- •Приставки для дольных и кратных единиц си
- •Термодинамические характеристики некоторых веществ при 298 к
- •Стандартные потенциалы металлических
- •Энергия разрыва связи
- •Электроотрицательность элементов по Полингу
- •Стандартные окислительно-восстановительные потенциалы элементов
- •Растворимость соединений
- •Обозначения: р – растворимый, м – малорастворимый, н – нерастворимый,
- •Константы диссоциации Кд слабых электролитов
- •Распределение электронов в атоме
- •Список литературы
- •Крепышева Ирина Вадимовна
- •Учебное пособие для самостоятельной работы студентов
- •Нехимических специальностей и направлений
6.9. Электролиз расплавов и растворов солей
Электролизом называют процессы, происходящие на электродах под действием электрического тока, подаваемого от внешнего источника.
При электролизе происходит превращение электрической энергии в химическую.
|
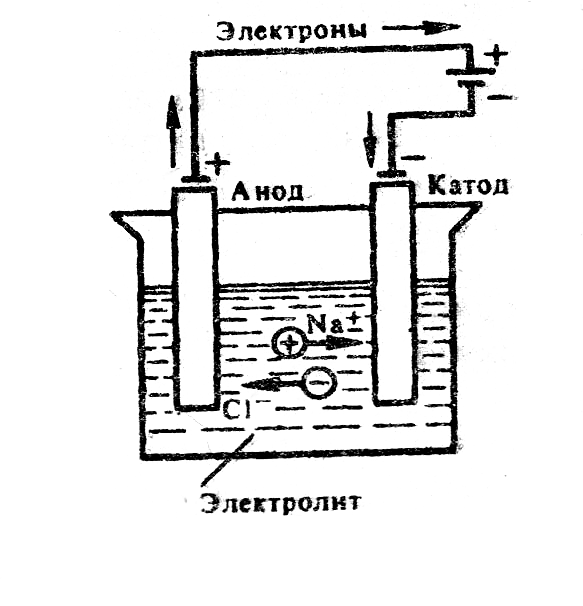
Ячейка для электролиза, называемая электролизером, состоит из двух электродов и электролита (рис. 6.3). Электрод, на котором идет реакция восстановления (катод), у электролизера подключен к отрицательному полюсу внешнего источника тока. Электрод, на котором протекает реакция окисления (анод), подключен к положительному полюсу источника тока. Рассмотрим электродные реакции на примере электролиза расплава хлорида натрия. |
Рис. 6.3. Схема электролиза расплава NaCl |
При плавлении происходит термохимическая диссоциация соли:
![]() .
.
Если погрузить инертные (угольные) электроды и пропускать постоянный электрический ток, то ионы будут двигаться к электродам: катионы Na+ – к катоду, анионы Cl- – к аноду (рис. 6.3.). В итоге на катоде выделяется металлический натрий, а на аноде – хлор:
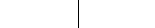
![]() 2 восстановление
2 восстановление
![]() 1 окисление
1 окисление
![]()
![]()
Электролиз растворов солей
Пример 1.
Электролиз водного раствора
![]() .
.
При электролизе водных растворов солей нужно учитывать: 1) все ионы в водном растворе гидратированы; 2) в водном растворе помимо самого вещества присутствуют молекулы воды и ионы Н+ и ОН-.
Электролит
![]() состоит из следующих частиц, способных
участвовать в электродных процессах:
состоит из следующих частиц, способных
участвовать в электродных процессах:![]()
![]() и
и![]() а также воды. Концентрация ионов
а также воды. Концентрация ионов![]() и
и![]() мала, так как обусловлена слабой
диссоциацией молекул
мала, так как обусловлена слабой
диссоциацией молекул![]() .
.
Восстанавливаться
на катоде могут только молекулы
![]() :
:
![]()
Восстановление
катионов
![]() невозможно из-за электроотрицательного
потенциала (
невозможно из-за электроотрицательного
потенциала (![]()
![]() В).
В).
Из-за возможных процессов окисления:
![]()
![]() В,
В,
![]()
![]() В.
В.
на аноде будет протекать реакция, которой отвечает меньший потенциал, то есть окисление воды с выделением О2.
Итак, при электролизе
водного раствора
![]() на катоде выделяется Н2,
а на аноде – О2.
на катоде выделяется Н2,
а на аноде – О2.
![]() ,
,
![]() .
.
причем электролит около катода становится щелочным, а около анода – кислым.
Суммарный процесс электролиза
![]() .
.
Подобное изменение среды в электролите у катода и анода может быть использовано для получения щелочей и кислот, если обеспечить неперемешиваемость растворов у обоих электродов.
Аналогично протекает
электролиз водных растворов солей,
образованных щелочными и щелочно-земельными
металлами и кислородсодержащей кислотой
(![]() ).
).
Пример 2.
Электролиз водного раствора
![]()
На катоде будут восстанавливаться катионы меди:
![]() ;
;
на аноде будет кислород в результате реакции окисления воды:
![]() .
.
Суммарное уравнение электролиза:
![]() .
.
Пример 3.
Электролиз раствора
![]() .
.
На катоде при электролизе этого раствора выделяется водород
![]() ,
,
![]() .
.
На аноде выделяется хлор по реакции
![]()
Именно таким путем – электролизом насыщенного раствора хлорида натрия – в промышленности получают хлор.
Суммарное уравнение
электролиза раствора
![]()
![]()
Последовательность разряда ионов.
I. Для процессов, протекающих на катоде:
1. При электролизе
растворов
солей металлов, расположенных в ряду
напряжений после Н2
(![]() )
на катоде выделяется соответствующий
металл по схеме:
)
на катоде выделяется соответствующий
металл по схеме:
![]() .
.
2. При электролизе
растворов
солей металлов, которые находятся в
начале ряда напряжений (![]() ),
на катоде разряжаются ионы водорода из
воды;
),
на катоде разряжаются ионы водорода из
воды;
3. при электролизе
растворов солей металлов, электронные
потенциалы которых находятся между
потенциалами
![]() (
(![]() до Н), на катоде выделяется металл и Н2:
до Н), на катоде выделяется металл и Н2:
![]() ;
;
![]() .
.
Если же водный
раствор содержит катионы различных
металлов, то при электролизе выделение
их на катоде протекает в порядке
уменьшения величины стандартного
электродного потенциала соответствующего
металла. Так, из смеси катионов
![]() сначала будут восстанавливаться катионы
серебра
сначала будут восстанавливаться катионы
серебра![]() затем катионы меди
затем катионы меди![]() и последними – катионы железа
и последними – катионы железа![]() .
.
Вывод. При разрядке ионов на катоде легче разряжаются те из них, которым отвечает наибольшее значение положительного потенциала.
Характер реакций, протекающих на аноде, зависит как от присутствия молекул воды, так и от вещества, из которого сделан анод. Обычно аноды подразделяются на нерастворимые и растворимые. Первые изготавливаются из угля, графита, платины, иридия; вторые – из меди, серебра, цинка, кадмия, никеля и других металлов.
II. Для процессов, протекающих на нерастворимом аноде.
1) При электролизе
водных растворов бескислородных кислот
и их солей, кроме
![]() и фторидов, будут окисляться данные
анионы. Например, при электролизе (
и фторидов, будут окисляться данные
анионы. Например, при электролизе (![]() и их солей на аноде выделяется
и их солей на аноде выделяется![]() )
)
![]() (галоген)
(галоген)
2) При электролизе
кислородсодержащих кислот и их солей
(![]() и т. д.) на аноде выделяется О2,
так как анодное окисление претерпевают
ионы или вода, но потенциал окисления
воды значительно меньше, чем для данных
анионов.
и т. д.) на аноде выделяется О2,
так как анодное окисление претерпевают
ионы или вода, но потенциал окисления
воды значительно меньше, чем для данных
анионов.
Например,
![]()
![]() В
В
![]()
![]() В
В
Вывод. В целом, на аноде происходят в первую очередь те процессы, потенциалы которых более отрицательны, то есть меньше по величине.
Растворимый анод при электролизе сам подвергается окислению, т. е. посылает электроны во внешнюю цепь.
Пример.
Два медных электрода помещены в раствор
![]() .
.
Рассмотрим электродные процессы при прохождении электрического тока:
На катоде – восстановление катионов меди:
![]() .
.
На аноде – окисление меди:
![]() .
.
Происходит растворение анода:
![]()
металл уходит уходят во
анода в раствор внешнюю цепь
и анод растворяется. Этот случай электролиза широко используется для очистки металлов.