- •И. В. Крепышева
- •Содержание
- •Тема 7. Химия металлов 125
- •1.2. Квантово-механическая модель атома водорода
- •1.3. Строение многоэлектронных атомов
- •1.4. Периодическая система элементов д.И. Менделеева
- •1.5. Периодические свойства элементов
- •1.6. Решение типовых задач
- •1.7. Задачи для самостоятельного решения
- •Тема 2. Химическая связь
- •2.1. Ковалентная связь
- •2.2. Гибридизация атомных орбиталей
- •2.3. Ионная химическая связь
- •2.4. Металлическая связь
- •2.5. Водородная связь
- •2.6. Строение твердого тела
- •Тема 3. Элементы химической термодинамики
- •3.1. Основные понятия термодинамики
- •3.2. Внутренняя энергия
- •3.3. Энтальпия
- •3.4. Термохимия. Закон Гесса
- •3.5. Энтропия
- •3.6. Самопроизвольные процессы. Энергия Гиббса
- •3.7. Решение типовых задач
- •3.8. Задачи для самостоятельного решения
- •Тема 4. Химическая кинетика и химическое равновесие
- •4.1. Скорость химической реакции
- •4.2. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •4.3. Зависимость скорости реакции от температуры
- •4.4. Катализ
- •4.5. Химическое равновесие
- •4.6. Смещение химического равновесия. Принцип Ле Шателье
- •4.7. Решение типовых задач
- •4.8. Задачи для самостоятельного решения
- •Тема 5. Растворы. Дисперсные системы
- •5.1. Общие свойства растворов
- •5.2. Способы выражения состава растворов
- •5.3. Теория электролитической диссоциации
- •5.4. Теории кислот и оснований
- •5.5. Ионные реакции в растворах
- •5.6. Ионное произведение воды. Водородный показатель рН
- •5.7. Гидролиз солей
- •5.8. Дисперсные системы и их классификация
- •5.9. Решение типовых задач
- •28,57 Г соли растворены в 71,43 г воды
- •3% Массы раствора составляют 48,84 г
- •Соотношение между рН и рОн
- •5.10. Задачи для самостоятельного решения
- •Тема 6. Окислительно-восстановительные электрохимические процессы
- •6.1. Основные понятия
- •Правила определения степени окисления
- •6.2. Составление уравнений окислительно-восстановительных реакций
- •6.3. Влияние среды на характер протекания реакций
- •6.4. Важнейшие окислители и восстановители
- •6.5. Электрохимические процессы
- •96500 Кл (26,8 а∙ч) – 31,77 г Cu (масса моля эквивалентов)
- •96500 Кл – 1 г (11,2 л– объем моля эквивалентов)
- •6.6. Гальванический элемент Даниэля-Якоби
- •6.7. Окислительно-восстановительные потенциалы
- •6.8. Эдс окислительно-восстановительных реакций
- •6.9. Электролиз расплавов и растворов солей
- •6.10. Некоторые области применения электрохимии
- •6.11. Решение типовых задач
- •6.12. Задачи для самостоятельного решения
- •Тема 7. Химия металлов
- •7.1. Общая характеристика металлов
- •7.2. Химические свойства металлов
- •7.3. Взаимодействие металлов с кислотами
- •Взаимодействие металлов с соляной кислотой.
- •Взаимодействие металлов с азотной кислотой
- •Взаимодействие металлов с серной кислотой
- •7.4. Сплавы
- •7.5. Получение металлов
- •Тема 8. Коррозия и защита металлов
- •8.1. Определение и классификация коррозионных процессов
- •8.2. Химическая коррозия
- •8.3. Электрохимическая коррозия
- •8.4. Возможность коррозии с водородной и кислородной деполяризацией
- •8.5. Защита металлов от коррозии
- •8.6. Решение типовых задач
- •8.7. Задачи для самостоятельного решения
- •Тема 9. Органические полимерные материалы
- •9.1. Классификация полимерных (высокомолекулярных) материалов
- •9.2. Строение полимеров
- •9.3. Кристаллическое и аморфное состояние полимеров
- •9.4. Методы получения полимеров
- •9.5. Применение полимеров
- •Тема 10. Химическая идентификация и анализ вещества
- •10.1. Химическая идентификация вещества
- •Некоторые реагенты для идентификации катионов
- •Классификация анионов по окислительно-восстановительным свойствам
- •Некоторые реагенты для идентификации анионов
- •10.2. Количественный анализ. Химические методы анализа
- •10.3. Инструментальные методы анализа
- •Приложение
- •Важнейшие единицы си и их соотношение с единицами других систем
- •Приставки для дольных и кратных единиц си
- •Термодинамические характеристики некоторых веществ при 298 к
- •Стандартные потенциалы металлических
- •Энергия разрыва связи
- •Электроотрицательность элементов по Полингу
- •Стандартные окислительно-восстановительные потенциалы элементов
- •Растворимость соединений
- •Обозначения: р – растворимый, м – малорастворимый, н – нерастворимый,
- •Константы диссоциации Кд слабых электролитов
- •Распределение электронов в атоме
- •Список литературы
- •Крепышева Ирина Вадимовна
- •Учебное пособие для самостоятельной работы студентов
- •Нехимических специальностей и направлений
3.5. Энтропия
Понятие энтропии вытекает из понятия внутренней энергии.
U = Uсв. + Uсвяз.,
где Uсв., Uсвяз. – соответственно свободная и связанная энергии.
Свободная, или полезная энергия может переходить в другие формы энергии и совершать работу.
Связанная, или бесполезная энергия – энергия, затрачиваемая в процессе на хаотическое движение частиц, составляющих вещество, она не может переходить в другие формы энергии.
Доля связанной энергии пропорциональна температуре:
Uсвяз. = ST.
Следовательно, величина S характеризует часть энергии, затрачиваемую на беспорядочное движение частиц, отражает степень беспорядка в системе и называется энтропией. Энтропия есть мера неупорядоченности системы.
Состояние системы можно характеризовать микросостояниями составляющих ее частиц, т. е. их мгновенными координатами и скоростями различных видов движения в различных направлениях. Число микросостояний системы называется термодинамической вероятностью системы W. Так как число частиц в системе огромно (например, в 1 моль имеется 6,02 ∙ 1023 частиц), то термодинамическая вероятность системы выражается огромными числами. Поэтому пользуются логарифмом термодинамической вероятности lnW.
Величина, равная S = RlnW, называется энтропией системы, отнесенной к одному молю вещества, R – газовая постоянная. Энтропия имеет единицу измерения Дж/(моль ∙ К). Энтропия вещества в стандартном состоянии называется стандартной энтропией S 0.
В отличие от других термодинамических функций, можно определить не только изменение, но и абсолютное значение энтропии. Это вытекает из высказанного в 1911 г. М. Планком постулата, согласно которому «при абсолютном нуле энтропия идеального кристалла равна нулю». Этот постулат получил название третьего закона термодинамики.
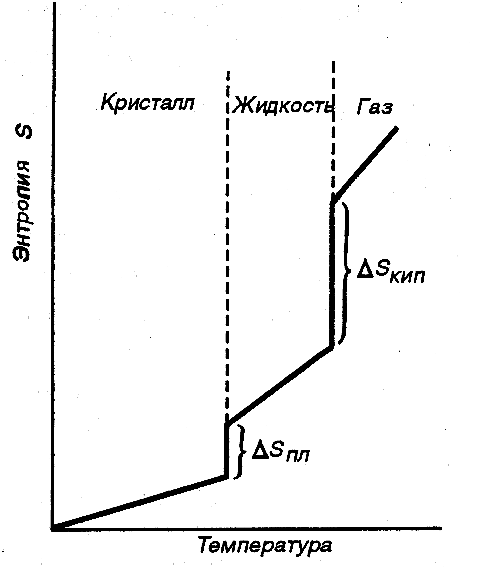
|
Рис.3.1. Изменение энтропии вещества с увеличением температуры |
По мере повышения температуры растет скорость различных видов движения частиц, т. е. число их микросостояний и соответственно термодинамическая вероятность, и энтропия вещества (рис. 3.1.) При переходе вещества из твердого состояния в жидкое значительно увеличивается неупорядоченность и соответственно энтропия вещества (ΔSпл). Особенно резко растет неупорядоченность и соответственно энтропия вещества при его переходе из жидкого в газообразное состояние (ΔSкип).
|
Изменение энтропии в системе в результате протекания химической реакции (ΔS) (энтропия реакции) равно сумме энтропий продуктов реакции за вычетом энтропий исходных веществ с учетом стехиометрических коэффициентов.
ΔS = ∑nк Sкон.пр. – ∑nн S исх.в-в. .
Например, энтропия реакции:
CH4 + H2O(г) = CO + 3H2
при стандартных состояниях реагентов и продуктов процесса и 298 К равна:
ΔS = S0CO,298+ 3S0H2,298–S0H20(г),298 = 197,54+3∙130,58 – 186,19–188,7 = 214,39 Дж/К.
Второе начало термодинамики утверждает, что в изолированной системе самопроизвольно могут протекать только такие процессы, которые ведут к увеличению неупорядоченности системы, т. е. к росту энтропии.
Увеличение энтропии определяет возможность самопроизвольного протекания таких процессов, как диффузия газов и жидкостей, осмос и любой процесс растворения. Важно подчеркнуть, что в подобных процессах на увеличение энтропии тратится теплота. Например, испарение эфира с руки протекает самопроизвольно с увеличением энтропии, так как энтропия пара всегда больше, чем жидкости, но теплота для такого перехода отнимается от руки, т. е. процесс идет эндотермически.
Энтропия газов всегда значительно больше, чем твердых тел и жидкостей, поэтому в химических реакциях с участием газообразных веществ изменение энтропии связано, прежде всего, с изменением числа молей газов. Если число молей газа в реакции увеличивается, то энтропия при реакции также увеличивается, и наоборот. Например,
СаСО3 (кр) = СаО (кр) + СО2 (г) ΔS > 0;
СО (г) + 1/2O2 (г) = СО2 (г) ΔS < 0;
N2 (г) + ЗН2 (г) = 2NH3 (г) ΔS <0;
CuCl2 (кр) + Н2 (г) = Сu (кр) + 2НCl (г) ΔS >0.
Если же реакция идет без участия газообразных веществ или число молей газов в реакции не меняется, то изменение энтропии мало и знак не может быть предсказан, исходя из уравнения реакции:
Н2 (г) +Сl2 (г) = 2НСl (г) ΔS ≈ 0;
Fe2O3 (кр) + 3Mg (кр) = 2Fe (кр) + 3MgO (кр) ΔS ≈ 0;
Na2O (кр) + SiO2 (кр) = Na2SiO3 (кр) ΔS ≈ 0.