- •И. В. Крепышева
- •Содержание
- •Тема 7. Химия металлов 125
- •1.2. Квантово-механическая модель атома водорода
- •1.3. Строение многоэлектронных атомов
- •1.4. Периодическая система элементов д.И. Менделеева
- •1.5. Периодические свойства элементов
- •1.6. Решение типовых задач
- •1.7. Задачи для самостоятельного решения
- •Тема 2. Химическая связь
- •2.1. Ковалентная связь
- •2.2. Гибридизация атомных орбиталей
- •2.3. Ионная химическая связь
- •2.4. Металлическая связь
- •2.5. Водородная связь
- •2.6. Строение твердого тела
- •Тема 3. Элементы химической термодинамики
- •3.1. Основные понятия термодинамики
- •3.2. Внутренняя энергия
- •3.3. Энтальпия
- •3.4. Термохимия. Закон Гесса
- •3.5. Энтропия
- •3.6. Самопроизвольные процессы. Энергия Гиббса
- •3.7. Решение типовых задач
- •3.8. Задачи для самостоятельного решения
- •Тема 4. Химическая кинетика и химическое равновесие
- •4.1. Скорость химической реакции
- •4.2. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •4.3. Зависимость скорости реакции от температуры
- •4.4. Катализ
- •4.5. Химическое равновесие
- •4.6. Смещение химического равновесия. Принцип Ле Шателье
- •4.7. Решение типовых задач
- •4.8. Задачи для самостоятельного решения
- •Тема 5. Растворы. Дисперсные системы
- •5.1. Общие свойства растворов
- •5.2. Способы выражения состава растворов
- •5.3. Теория электролитической диссоциации
- •5.4. Теории кислот и оснований
- •5.5. Ионные реакции в растворах
- •5.6. Ионное произведение воды. Водородный показатель рН
- •5.7. Гидролиз солей
- •5.8. Дисперсные системы и их классификация
- •5.9. Решение типовых задач
- •28,57 Г соли растворены в 71,43 г воды
- •3% Массы раствора составляют 48,84 г
- •Соотношение между рН и рОн
- •5.10. Задачи для самостоятельного решения
- •Тема 6. Окислительно-восстановительные электрохимические процессы
- •6.1. Основные понятия
- •Правила определения степени окисления
- •6.2. Составление уравнений окислительно-восстановительных реакций
- •6.3. Влияние среды на характер протекания реакций
- •6.4. Важнейшие окислители и восстановители
- •6.5. Электрохимические процессы
- •96500 Кл (26,8 а∙ч) – 31,77 г Cu (масса моля эквивалентов)
- •96500 Кл – 1 г (11,2 л– объем моля эквивалентов)
- •6.6. Гальванический элемент Даниэля-Якоби
- •6.7. Окислительно-восстановительные потенциалы
- •6.8. Эдс окислительно-восстановительных реакций
- •6.9. Электролиз расплавов и растворов солей
- •6.10. Некоторые области применения электрохимии
- •6.11. Решение типовых задач
- •6.12. Задачи для самостоятельного решения
- •Тема 7. Химия металлов
- •7.1. Общая характеристика металлов
- •7.2. Химические свойства металлов
- •7.3. Взаимодействие металлов с кислотами
- •Взаимодействие металлов с соляной кислотой.
- •Взаимодействие металлов с азотной кислотой
- •Взаимодействие металлов с серной кислотой
- •7.4. Сплавы
- •7.5. Получение металлов
- •Тема 8. Коррозия и защита металлов
- •8.1. Определение и классификация коррозионных процессов
- •8.2. Химическая коррозия
- •8.3. Электрохимическая коррозия
- •8.4. Возможность коррозии с водородной и кислородной деполяризацией
- •8.5. Защита металлов от коррозии
- •8.6. Решение типовых задач
- •8.7. Задачи для самостоятельного решения
- •Тема 9. Органические полимерные материалы
- •9.1. Классификация полимерных (высокомолекулярных) материалов
- •9.2. Строение полимеров
- •9.3. Кристаллическое и аморфное состояние полимеров
- •9.4. Методы получения полимеров
- •9.5. Применение полимеров
- •Тема 10. Химическая идентификация и анализ вещества
- •10.1. Химическая идентификация вещества
- •Некоторые реагенты для идентификации катионов
- •Классификация анионов по окислительно-восстановительным свойствам
- •Некоторые реагенты для идентификации анионов
- •10.2. Количественный анализ. Химические методы анализа
- •10.3. Инструментальные методы анализа
- •Приложение
- •Важнейшие единицы си и их соотношение с единицами других систем
- •Приставки для дольных и кратных единиц си
- •Термодинамические характеристики некоторых веществ при 298 к
- •Стандартные потенциалы металлических
- •Энергия разрыва связи
- •Электроотрицательность элементов по Полингу
- •Стандартные окислительно-восстановительные потенциалы элементов
- •Растворимость соединений
- •Обозначения: р – растворимый, м – малорастворимый, н – нерастворимый,
- •Константы диссоциации Кд слабых электролитов
- •Распределение электронов в атоме
- •Список литературы
- •Крепышева Ирина Вадимовна
- •Учебное пособие для самостоятельной работы студентов
- •Нехимических специальностей и направлений
5.3. Теория электролитической диссоциации
Хорошо известно, что одни вещества в растворенном или расплавленном состоянии проводят электрический ток, другие в тех же условиях ток не проводят.
Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами.
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам – большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные связи.
Для объяснения особенностей водных растворов электролитов шведским ученым С. Аррениусом в 1887 г. была предложена теория электролитической диссоциации. Современное содержание этой теории можно свести к следующим положениям:
1. Молекулы электролитов – кислот, оснований, солей при растворении в воде распадаются на положительно и отрицательно заряженные ионы. Это явление называется электролитической диссоциацией.
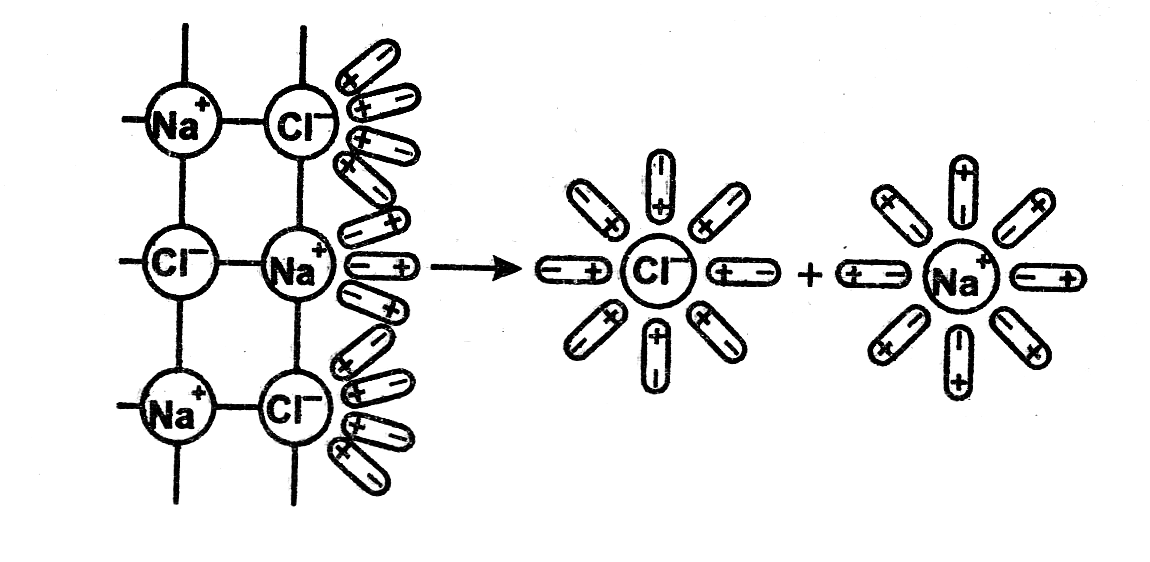
Легче всего диссоциируют вещества с ионной связью. При их растворении диполи воды ориентируются вокруг положительно и отрицательно заряженных ионов. Между ионами и диполями воды возникают силы взаимного притяжения.
|
Рис. 5.2. Схема электролитической диссоциации хлорида натрия в водном растворе |
В результате связь между ионами ослабевает, происходит переход ионов из кристалла в раствор. При этом, как показано на рис. 5.2, образуются гидратированные ионы, т. е. ионы, химически связанные с молекулами воды.
|
Аналогично диссоциируют и электролиты, молекулы которых образованы по типу полярной ковалентной связи (полярные молекулы). Вокруг каждой полярной молекулы вещества также ориентируются диполи воды. В результате связующее электронное облако (электронная пара) полностью смещается к атому с большей электроотрицательностью, полярная молекула превращается в ионную и затем образуются гидратированные ионы (рис. 5.3.).
-
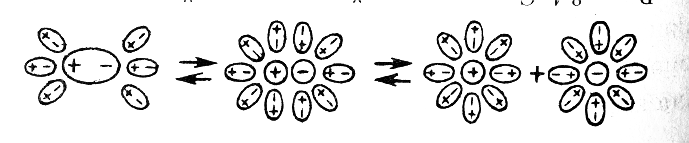
Рис. 5.3. Схема электролитической диссоциации полярной молекулы в водном растворе
Распад молекулы на ионы возможен только в растворителях, молекулы которых имеют полярное строение (вода, ацетон), такие растворители называются ионизирующими.
2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные – к аноду. Поэтому первые называются катионами, вторые – анионами.
Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами.
Диссоциация – обратимый процесс: одновременно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация).
Гидратация ионов. Д. И. Менделеев экспериментально обосновал образование химических соединений при взаимодействии растворенного вещества с растворителем. Действительно, при растворении происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы. Эти ионы связаны с молекулами воды, т. е. гидратированы. Гидратированные ионы содержат как постоянное, так и переменное число молекул воды. Гидрат постоянного состава образует ион водорода Н+, удерживающий одну молекулу воды, – это гидратированный протон Н+(Н2О), его изображают формулой Н3О+ и называют ионом гидроксония. Говоря об ионе водорода в растворе, всегда имеют в виду ион гидроксония, который для простоты обозначают Н+.
Сильные и слабые электролиты. Лишь часть электролита диссоциирует на ионы, поэтому Аррениусом было введено понятие степени диссоциации.
Степенью диссоциации электролита называется отношение числа его молекул, распавшихся на ионы, к общему числу его молекул в растворе, α (выражается в % или долях единицы).
![]()
Например, выражение «степень диссоциации СН3СООН в 0,01 М растворе при данной температуре равна 0,042» означает, что 4,2 % уксусной кислоты в этом растворе продиссоциировало, а 95,8 % находятся в виде недиссоциированных молекул.
Степень диссоциации зависит от природы электролита, природы растворителя, температуры и концентрации раствора.
Электролиты можно
разделить на две группы: сильные
и слабые
электролиты. Сильными обычно считают
электролиты, у которых
![]() (в 0,1 Н растворах).
(в 0,1 Н растворах).
Сильные электролиты в водных растворах диссоциированы практически нацело; понятие степени диссоциации к ним по существу неприменимо. К ним относятся:
1. Почти все соли, за исключением тех, анионы и катионы которых образуют в растворе комплексные соединения.
2. Многие минеральные
кислоты, например ![]()
![]() .
.
3. Основания щелочных
и щелочноземельных металлов, например,
![]() .
.
Как уже отмечалось, сильные электролиты находятся в растворах только в виде ионов, теоретически истинная степень их диссоциации равна 1 (100 %). Однако при экспериментальном определении для этих электролитов получают значение α < 1. Эту величину называют кажущейся степенью диссоциации. Несоответствие истинной и кажущейся степени диссоциации объясняется теорией сильных электролитов П. Дебая и Э. Хюккеля. Согласно этой теории между ионами, находящимися в растворе, возникают электростатические силы притяжения и отталкивания.
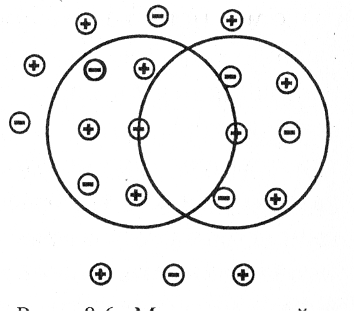
В результате вокруг иона образуется ионная атмосфера (рис. 5.4), каждый ион оказывается окруженным некоторым числом ионов с зарядом противоположного знака.
|
Рис. 5.4. Модель ионной атмосферы |
Влияние ионной атмосферы сказывается в достаточно концентрированных растворах. Так, установлено, что в 1 М растворе HNO3 кажущаяся степень диссоциации 82 %. Она несколько больше в более разбавленном 0,1 М растворе – 92 %. В очень разбавленных растворах влиянием ионной атмосферы можно пренебречь. Разбавленные растворы близки по свойствам к идеальным растворам. |
Слабые электролиты при растворении в воде лишь частично диссоциируют на ионы. К ним относятся:
1. Основания всех
нещелочных и нещелочно-земельных
металлов, например
![]() ,
а также NH4OH.
,
а также NH4OH.
2. Почти все
органические кислоты, например
![]() ;
некоторые минеральные кислоты, например
;
некоторые минеральные кислоты, например![]() ,
,![]() ,
HNO2,
HClO, H2SiO3.
,
HNO2,
HClO, H2SiO3.
3. Вода
![]() .
.
К равновесию, которое устанавливается в растворе слабого электролита между молекулами и ионами, можно применить законы химического равновесия. и записать выражение константы равновесия.
Например, для диссоциации уксусной кислоты:
![]()
Константа равновесия имеет вид:
концентрация
ионов концентрация
недиссоциирующих молекул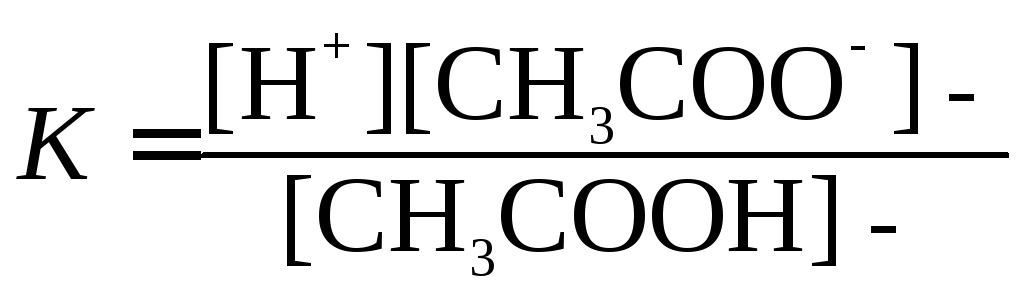
Константа равновесия, отвечающая диссоциации слабого электролита, называется константой диссоцации.
Величина К зависит от природы электролита и растворителя, а также от температуры и не зависит от концентрации раствора. Чем выше К, тем легче электролит диссоциирует.
Закон разбавления
Оствальда выводит математическую
зависимость между К
и
![]() :
:
![]()
Для очень слабых
электролитов
![]()
![]()
Из закона видно,
что если концентрацию слабого электролита
уменьшить в 100 раз, то
![]() увеличится приблизительно в
увеличится приблизительно в![]() ,
то есть в 10 раз.
,
то есть в 10 раз.
Поскольку величина К от концентрации не зависит, из уравнений следует, что с разбавлением раствора, то есть с уменьшением концентрации степень диссоциации слабого электролита увеличивается.