
- •И. В. Крепышева
- •Содержание
- •Тема 7. Химия металлов 125
- •1.2. Квантово-механическая модель атома водорода
- •1.3. Строение многоэлектронных атомов
- •1.4. Периодическая система элементов д.И. Менделеева
- •1.5. Периодические свойства элементов
- •1.6. Решение типовых задач
- •1.7. Задачи для самостоятельного решения
- •Тема 2. Химическая связь
- •2.1. Ковалентная связь
- •2.2. Гибридизация атомных орбиталей
- •2.3. Ионная химическая связь
- •2.4. Металлическая связь
- •2.5. Водородная связь
- •2.6. Строение твердого тела
- •Тема 3. Элементы химической термодинамики
- •3.1. Основные понятия термодинамики
- •3.2. Внутренняя энергия
- •3.3. Энтальпия
- •3.4. Термохимия. Закон Гесса
- •3.5. Энтропия
- •3.6. Самопроизвольные процессы. Энергия Гиббса
- •3.7. Решение типовых задач
- •3.8. Задачи для самостоятельного решения
- •Тема 4. Химическая кинетика и химическое равновесие
- •4.1. Скорость химической реакции
- •4.2. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •4.3. Зависимость скорости реакции от температуры
- •4.4. Катализ
- •4.5. Химическое равновесие
- •4.6. Смещение химического равновесия. Принцип Ле Шателье
- •4.7. Решение типовых задач
- •4.8. Задачи для самостоятельного решения
- •Тема 5. Растворы. Дисперсные системы
- •5.1. Общие свойства растворов
- •5.2. Способы выражения состава растворов
- •5.3. Теория электролитической диссоциации
- •5.4. Теории кислот и оснований
- •5.5. Ионные реакции в растворах
- •5.6. Ионное произведение воды. Водородный показатель рН
- •5.7. Гидролиз солей
- •5.8. Дисперсные системы и их классификация
- •5.9. Решение типовых задач
- •28,57 Г соли растворены в 71,43 г воды
- •3% Массы раствора составляют 48,84 г
- •Соотношение между рН и рОн
- •5.10. Задачи для самостоятельного решения
- •Тема 6. Окислительно-восстановительные электрохимические процессы
- •6.1. Основные понятия
- •Правила определения степени окисления
- •6.2. Составление уравнений окислительно-восстановительных реакций
- •6.3. Влияние среды на характер протекания реакций
- •6.4. Важнейшие окислители и восстановители
- •6.5. Электрохимические процессы
- •96500 Кл (26,8 а∙ч) – 31,77 г Cu (масса моля эквивалентов)
- •96500 Кл – 1 г (11,2 л– объем моля эквивалентов)
- •6.6. Гальванический элемент Даниэля-Якоби
- •6.7. Окислительно-восстановительные потенциалы
- •6.8. Эдс окислительно-восстановительных реакций
- •6.9. Электролиз расплавов и растворов солей
- •6.10. Некоторые области применения электрохимии
- •6.11. Решение типовых задач
- •6.12. Задачи для самостоятельного решения
- •Тема 7. Химия металлов
- •7.1. Общая характеристика металлов
- •7.2. Химические свойства металлов
- •7.3. Взаимодействие металлов с кислотами
- •Взаимодействие металлов с соляной кислотой.
- •Взаимодействие металлов с азотной кислотой
- •Взаимодействие металлов с серной кислотой
- •7.4. Сплавы
- •7.5. Получение металлов
- •Тема 8. Коррозия и защита металлов
- •8.1. Определение и классификация коррозионных процессов
- •8.2. Химическая коррозия
- •8.3. Электрохимическая коррозия
- •8.4. Возможность коррозии с водородной и кислородной деполяризацией
- •8.5. Защита металлов от коррозии
- •8.6. Решение типовых задач
- •8.7. Задачи для самостоятельного решения
- •Тема 9. Органические полимерные материалы
- •9.1. Классификация полимерных (высокомолекулярных) материалов
- •9.2. Строение полимеров
- •9.3. Кристаллическое и аморфное состояние полимеров
- •9.4. Методы получения полимеров
- •9.5. Применение полимеров
- •Тема 10. Химическая идентификация и анализ вещества
- •10.1. Химическая идентификация вещества
- •Некоторые реагенты для идентификации катионов
- •Классификация анионов по окислительно-восстановительным свойствам
- •Некоторые реагенты для идентификации анионов
- •10.2. Количественный анализ. Химические методы анализа
- •10.3. Инструментальные методы анализа
- •Приложение
- •Важнейшие единицы си и их соотношение с единицами других систем
- •Приставки для дольных и кратных единиц си
- •Термодинамические характеристики некоторых веществ при 298 к
- •Стандартные потенциалы металлических
- •Энергия разрыва связи
- •Электроотрицательность элементов по Полингу
- •Стандартные окислительно-восстановительные потенциалы элементов
- •Растворимость соединений
- •Обозначения: р – растворимый, м – малорастворимый, н – нерастворимый,
- •Константы диссоциации Кд слабых электролитов
- •Распределение электронов в атоме
- •Список литературы
- •Крепышева Ирина Вадимовна
- •Учебное пособие для самостоятельной работы студентов
- •Нехимических специальностей и направлений
7.3. Взаимодействие металлов с кислотами
Почти все металлы реагируют с кислотами, образуя соли. Характер взаимодействия металла с кислотой зависит от активности металла, его свойств и концентрации кислоты.
При действии
кислоты на металл роль окислителя играет
или ион водорода (![]() ,
разбавленная
,
разбавленная![]() ),
или кислотный остаток кислородсодержащей
кислоты (
),
или кислотный остаток кислородсодержащей
кислоты (![]() ,
,![]() – концентрированная).
– концентрированная).
Взаимодействие металлов с соляной кислотой.
С соляной кислотой взаимодействуют металлы, стоящие в ряду напряжений до водорода.
![]() .
.
![]()

![]()
![]()
Вывод: окислителем являются катионы водорода, которые принимают электроны от атома металла.
Взаимодействие металлов с азотной кислотой
Концентрированная
и разбавленная азотная кислота
окисляет
металлы без выделения водорода, так как
в ней окислителем является нитрат-ион
(![]() ).
).
Восстановление азотной кислоты различной концентрации при взаимодействии с металлами разной активности можно представить в виде схемы.

![]()





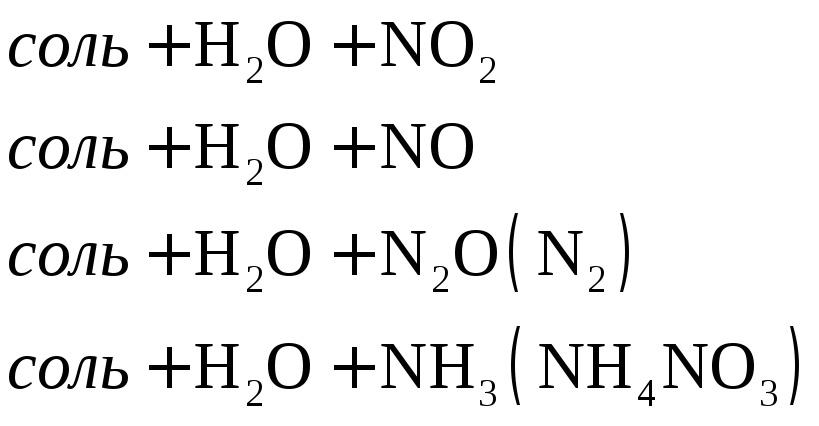
Согласно схеме степень окисления азота при взаимодействии кислоты с металлами меняется от +5 до -3.
Рассмотрим несколько примеров.
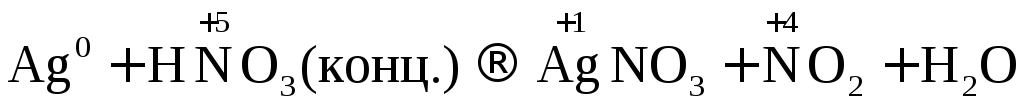 .
.
Коэффициенты в уравнении реакции подбираем ионно-электронным методом.
![]()
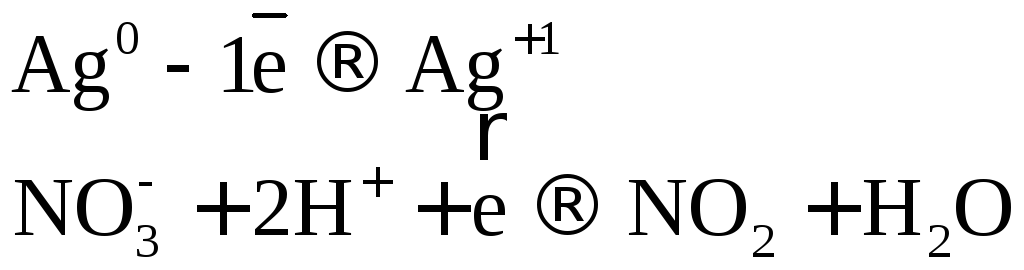
![]()
![]()
![]()
или
![]() .
.
 .
.
Разбавленная
азотная кислота при взаимодействии с
неактивными металлами восстанавливается
до
![]() ,
образуется соль
,
образуется соль![]() и вода.
и вода.
![]()
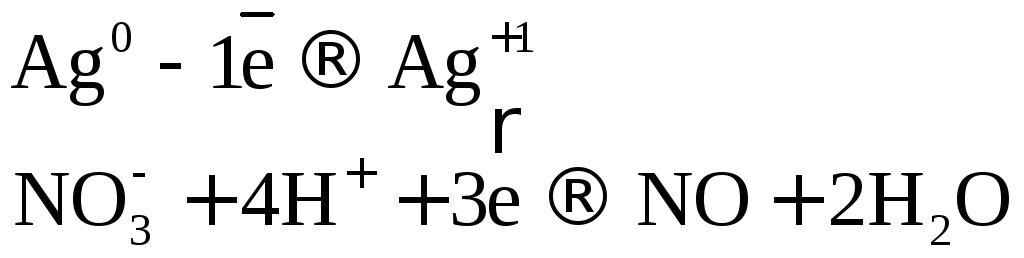
![]()
![]()
![]()
или
![]() .
.
 .
.
При взаимодействии
активных металлов с разбавленной азотной
кислотой образуется соль, вода и
![]() или
или![]() .
.
![]()
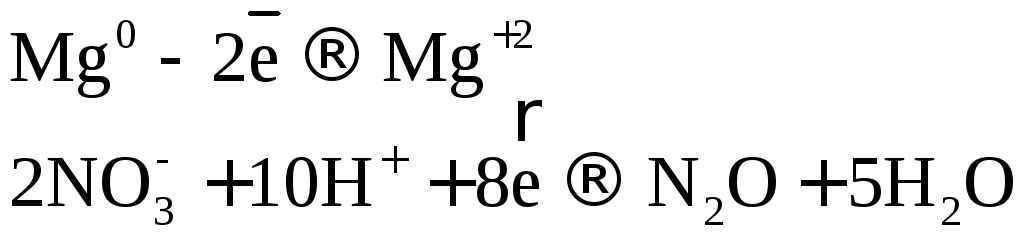
![]()
![]()
![]()
или
![]() .
.
![]() .
.
При взаимодействии активных металлов с очень разбавленной азотной кислотой образуется соль, вода и аммиак или нитрат аммония.
или
![]()
Вывод:
окислителем в азотной кислоте является
нитрат-анион. Концентрированная азотная
кислота пассивирует
![]()
![]() …
…
Следует иметь в виду, что во многих случаях при действии азотной кислоты на металлы образуется смесь различных азотсодержащих соединений, в которых преобладает какое-либо из них.
Взаимодействие металлов с серной кислотой
С разбавленной серной кислотой.
В разбавленной
серной кислоте окислителем являются
ионы водорода
![]() ,
поэтому она взаимодействует с металлами,
расположенными в ряду напряжений до
водорода.
,
поэтому она взаимодействует с металлами,
расположенными в ряду напряжений до
водорода.
![]()
![]()
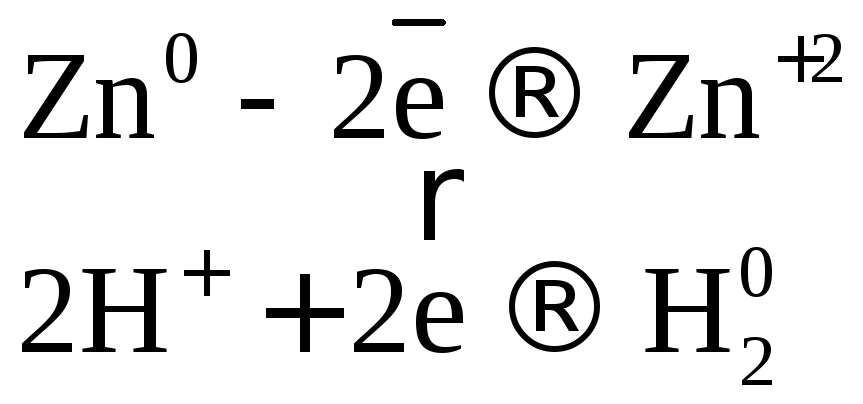
![]()
![]()
С концентрированной серной кислотой.
В концентрированной
серной кислоте окислителем является
ион
![]() но так как сульфат-ион не является
сильным окислителем, то большинство
реакций идет при нагревании. Степень
окисления серы может меняться от
+6 до
- 2. Чем
активнее металл, тем больше степень
восстановления серы.
но так как сульфат-ион не является
сильным окислителем, то большинство
реакций идет при нагревании. Степень
окисления серы может меняться от
+6 до
- 2. Чем
активнее металл, тем больше степень
восстановления серы.
Взаимодействие металлов с серной кислотой можно представить в виде схемы.
![]()




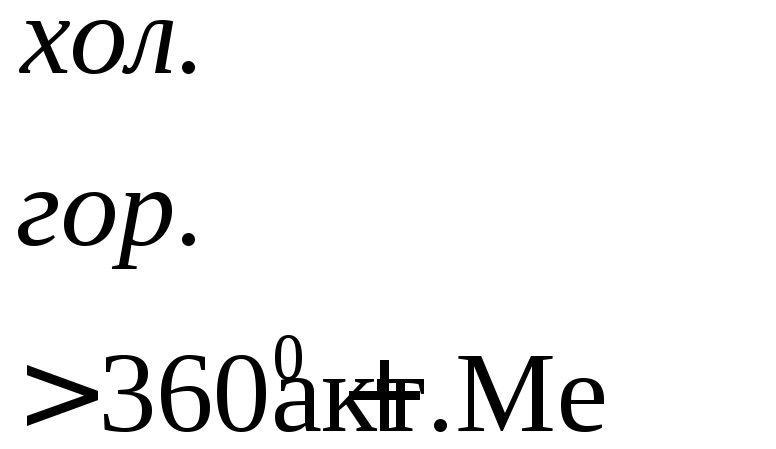
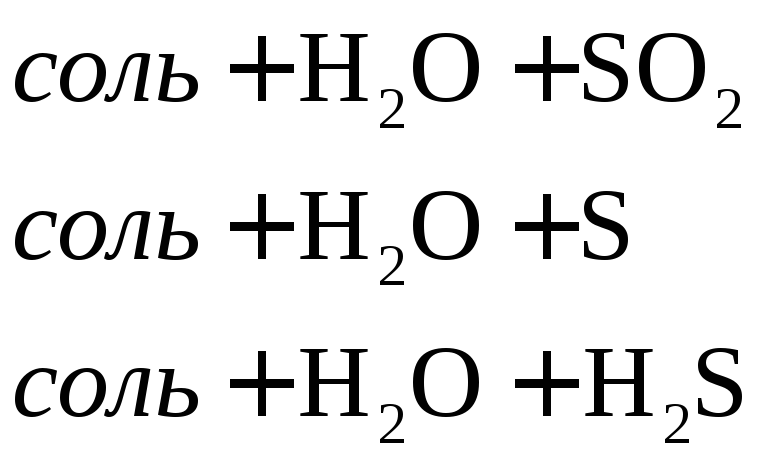
Характер взаимодействия зависит от активности металла, условий проведения реакции.
Например: при нагревании серной концентрированной кислоты с цинком сначала выделяется сернистый газ, а затем элементарная сера и сероводород.


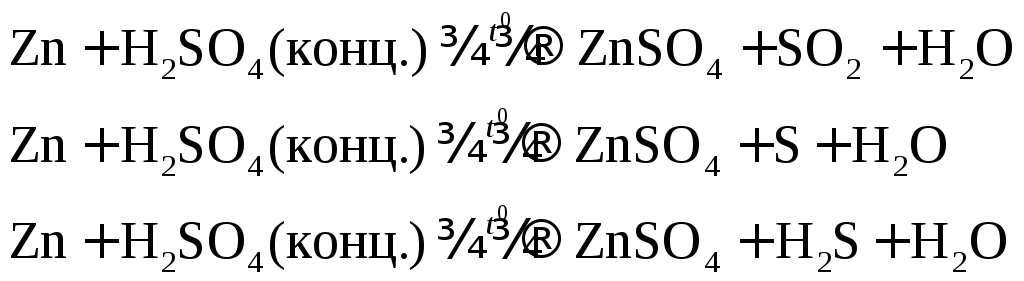
В одном из уравнений расставим коэффициенты ионно-электронным методом.
![]()
![]()
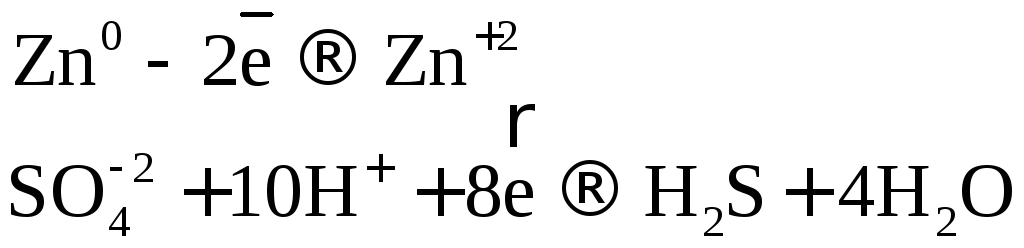
![]()
![]()
![]()
Вывод:
Окислителем в концентрированной серной
кислоте является ион
![]() .
Концентрированная серная кислота
окисляет многие металлы, в том числе и
такие, которые в ряду напряжений
расположены правее водорода, при этом
обычно выделяется сернистый газ.
.
Концентрированная серная кислота
окисляет многие металлы, в том числе и
такие, которые в ряду напряжений
расположены правее водорода, при этом
обычно выделяется сернистый газ.

Концентрированная
серная кислота не действует на
![]() и пассивирует
и пассивирует
![]() .
.
