
- •И. В. Крепышева
- •Содержание
- •Тема 7. Химия металлов 125
- •1.2. Квантово-механическая модель атома водорода
- •1.3. Строение многоэлектронных атомов
- •1.4. Периодическая система элементов д.И. Менделеева
- •1.5. Периодические свойства элементов
- •1.6. Решение типовых задач
- •1.7. Задачи для самостоятельного решения
- •Тема 2. Химическая связь
- •2.1. Ковалентная связь
- •2.2. Гибридизация атомных орбиталей
- •2.3. Ионная химическая связь
- •2.4. Металлическая связь
- •2.5. Водородная связь
- •2.6. Строение твердого тела
- •Тема 3. Элементы химической термодинамики
- •3.1. Основные понятия термодинамики
- •3.2. Внутренняя энергия
- •3.3. Энтальпия
- •3.4. Термохимия. Закон Гесса
- •3.5. Энтропия
- •3.6. Самопроизвольные процессы. Энергия Гиббса
- •3.7. Решение типовых задач
- •3.8. Задачи для самостоятельного решения
- •Тема 4. Химическая кинетика и химическое равновесие
- •4.1. Скорость химической реакции
- •4.2. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •4.3. Зависимость скорости реакции от температуры
- •4.4. Катализ
- •4.5. Химическое равновесие
- •4.6. Смещение химического равновесия. Принцип Ле Шателье
- •4.7. Решение типовых задач
- •4.8. Задачи для самостоятельного решения
- •Тема 5. Растворы. Дисперсные системы
- •5.1. Общие свойства растворов
- •5.2. Способы выражения состава растворов
- •5.3. Теория электролитической диссоциации
- •5.4. Теории кислот и оснований
- •5.5. Ионные реакции в растворах
- •5.6. Ионное произведение воды. Водородный показатель рН
- •5.7. Гидролиз солей
- •5.8. Дисперсные системы и их классификация
- •5.9. Решение типовых задач
- •28,57 Г соли растворены в 71,43 г воды
- •3% Массы раствора составляют 48,84 г
- •Соотношение между рН и рОн
- •5.10. Задачи для самостоятельного решения
- •Тема 6. Окислительно-восстановительные электрохимические процессы
- •6.1. Основные понятия
- •Правила определения степени окисления
- •6.2. Составление уравнений окислительно-восстановительных реакций
- •6.3. Влияние среды на характер протекания реакций
- •6.4. Важнейшие окислители и восстановители
- •6.5. Электрохимические процессы
- •96500 Кл (26,8 а∙ч) – 31,77 г Cu (масса моля эквивалентов)
- •96500 Кл – 1 г (11,2 л– объем моля эквивалентов)
- •6.6. Гальванический элемент Даниэля-Якоби
- •6.7. Окислительно-восстановительные потенциалы
- •6.8. Эдс окислительно-восстановительных реакций
- •6.9. Электролиз расплавов и растворов солей
- •6.10. Некоторые области применения электрохимии
- •6.11. Решение типовых задач
- •6.12. Задачи для самостоятельного решения
- •Тема 7. Химия металлов
- •7.1. Общая характеристика металлов
- •7.2. Химические свойства металлов
- •7.3. Взаимодействие металлов с кислотами
- •Взаимодействие металлов с соляной кислотой.
- •Взаимодействие металлов с азотной кислотой
- •Взаимодействие металлов с серной кислотой
- •7.4. Сплавы
- •7.5. Получение металлов
- •Тема 8. Коррозия и защита металлов
- •8.1. Определение и классификация коррозионных процессов
- •8.2. Химическая коррозия
- •8.3. Электрохимическая коррозия
- •8.4. Возможность коррозии с водородной и кислородной деполяризацией
- •8.5. Защита металлов от коррозии
- •8.6. Решение типовых задач
- •8.7. Задачи для самостоятельного решения
- •Тема 9. Органические полимерные материалы
- •9.1. Классификация полимерных (высокомолекулярных) материалов
- •9.2. Строение полимеров
- •9.3. Кристаллическое и аморфное состояние полимеров
- •9.4. Методы получения полимеров
- •9.5. Применение полимеров
- •Тема 10. Химическая идентификация и анализ вещества
- •10.1. Химическая идентификация вещества
- •Некоторые реагенты для идентификации катионов
- •Классификация анионов по окислительно-восстановительным свойствам
- •Некоторые реагенты для идентификации анионов
- •10.2. Количественный анализ. Химические методы анализа
- •10.3. Инструментальные методы анализа
- •Приложение
- •Важнейшие единицы си и их соотношение с единицами других систем
- •Приставки для дольных и кратных единиц си
- •Термодинамические характеристики некоторых веществ при 298 к
- •Стандартные потенциалы металлических
- •Энергия разрыва связи
- •Электроотрицательность элементов по Полингу
- •Стандартные окислительно-восстановительные потенциалы элементов
- •Растворимость соединений
- •Обозначения: р – растворимый, м – малорастворимый, н – нерастворимый,
- •Константы диссоциации Кд слабых электролитов
- •Распределение электронов в атоме
- •Список литературы
- •Крепышева Ирина Вадимовна
- •Учебное пособие для самостоятельной работы студентов
- •Нехимических специальностей и направлений
6.3. Влияние среды на характер протекания реакций
Реакции окисления
– восстановления могут протекать в
различных средах: в кислой (избыток
ионов Н+),
нейтральной (Н2О)
и щелочной (избыток гидроксид-ионов
ОН-).
В зависимости от среды может меняться
характер протекания между одними и теми
же веществами. Среда влияет на изменение
степеней окисления атомов. Так, например,
ион
![]() в кислой среде восстанавливается до
в кислой среде восстанавливается до![]() ,
в нейтральной – до
,
в нейтральной – до![]() ,
а в щелочной – до
,
а в щелочной – до![]() .
Схематически эти изменения можно
представить так:
.
Схематически эти изменения можно
представить так:
|
Окисленная форма |
Среда раствора |
Восстановленная форма |
|
|
Н+ |
Mn2+(бесцветный раствор) |
|
MnO4- |
Н2О |
MnO2(бурый осадок) |
|
|
ОН- |
MnO42-(раствор зеленого цвета) |
Обычно для создания в растворе кислой среды используют серную кислоту. Азотную и соляную кислоты применяют редко: первая сама является окислителем, вторая способна окисляться. Для создания щелочной среды применяются растворы гидроксидов калия или натрия. Руководствуясь приведенной схемой, составим методом полуреакций уравнения реакции взаимодействия сульфита натрия Na2SO4 (восстановитель) с перманганатом калия KMnO4 (окислитель) в различных средах (примеры 1-3).
Пример 1. В кислой среде:
![]()

![]() 5
5
![]() 2
2
_________________________________________________________________
![]()
или
![]()
Пример 2. В нейтральной или слабокислой среде:
![]()
![]()
 3
3
![]() 2
2
_________________________________________________________________________________
![]()
или
![]() .
.
Пример 3. В сильнощелочной среде:
![]()
![]()
 1
1
![]() 2
2
_______________________________________________________________________________
![]()
или
![]() .
.
Методика составления уравнений окислительно-восстановительных реакций, для которых заведомо известны их начальные и конечные продукты, представляет собой лишь первый этап их изучения.
Весьма важным является определение самой возможности протекания окислительно-восстановительной реакции и установление ее продуктов даже при наличии двух веществ, из которых одно может выполнить функцию восстановителя или окислителя по отношению к другому. Приступая к уравнению реакции, необходимо, прежде всего, выяснить, какие вещества могут выполнить в ней функцию окислителя и восстановителя, каковы возможные продукты реакции и влияние на них характера среды – нейтральной, кислой или щелочной.
Ниже рассмотрены некоторые важнейшие типы окислителей и восстановителей.
6.4. Важнейшие окислители и восстановители
Окислители – элементарные вещества. Окислителями могут быть элементарные вещества, нейтральные атомы которых способны путем присоединения электронов переходить в отрицательно заряженные ионы с электронной структурой ближайшего благородного газа.
Так, молекулы
галогенов
![]() и
и![]() ,
выполняя функцию окислителей, превращаются
в отрицательно заряженные ионы
,
выполняя функцию окислителей, превращаются
в отрицательно заряженные ионы![]() и
и![]() .
Нейтральные атомы кислорода, серы и ее
аналогов переходят в состояние окисления
.
Нейтральные атомы кислорода, серы и ее
аналогов переходят в состояние окисления![]() и т. д.
и т. д.
Если окисление
галогенами идет в кислой среде, то
продуктами восстановления галогенов
являются соответствующие галогеноводородные
кислоты
![]() и
и![]() .
При окислении в щелочной среде получаются
соли этих кислот, т. е. галогениды
металлов. Сера при повышенной температуре
ведет себя как окислитель по отношению
к водороду и к металлам. Продуктами
восстановления ее являются сероводород
и сульфиды металлов.
.
При окислении в щелочной среде получаются
соли этих кислот, т. е. галогениды
металлов. Сера при повышенной температуре
ведет себя как окислитель по отношению
к водороду и к металлам. Продуктами
восстановления ее являются сероводород
и сульфиды металлов.
Окислители –
кислородные кислоты, преимущественно
высшие, и их соли. В
состав окислителей обычно входят атомы
элементов в высшей или в одной из боле
высоких степеней окисления, например,
![]()
![]() ,
а также
,
а также![]() .
В последних соединениях галогены
находятся не в высших степенях окисления,
однако они широко применяются в практике
в качестве окислителей.
.
В последних соединениях галогены
находятся не в высших степенях окисления,
однако они широко применяются в практике
в качестве окислителей.
Азотная кислота,
действуя в качестве окислителя,
восстанавливается до оксидов азота. В
умеренно концентрированном состоянии
образуется
![]() по схеме
по схеме
![]()
В концентрированном
состоянии наряду с
![]() выделяется также и
выделяется также и![]() :
:
![]()
Концентрированная
![]() ,
действуя в качестве окислителя,
восстанавливается до
,
действуя в качестве окислителя,
восстанавливается до![]() по схеме
по схеме
![]()
При окислении
двуокисью марганца, манганатом калия
![]() или
перманганатом калия
или
перманганатом калия![]() в кислой среде, т. е. в присутствии серной,
разбавленной соляной (с концентрированной
соляной кислотой эти окислители реагируют
с выделением хлора), азотной или других
кислот, происходит восстановление
марганца до двухвалентного катиона,
образующего соответствующие соли
в кислой среде, т. е. в присутствии серной,
разбавленной соляной (с концентрированной
соляной кислотой эти окислители реагируют
с выделением хлора), азотной или других
кислот, происходит восстановление
марганца до двухвалентного катиона,
образующего соответствующие соли![]() и т. д. по схемам:
и т. д. по схемам:
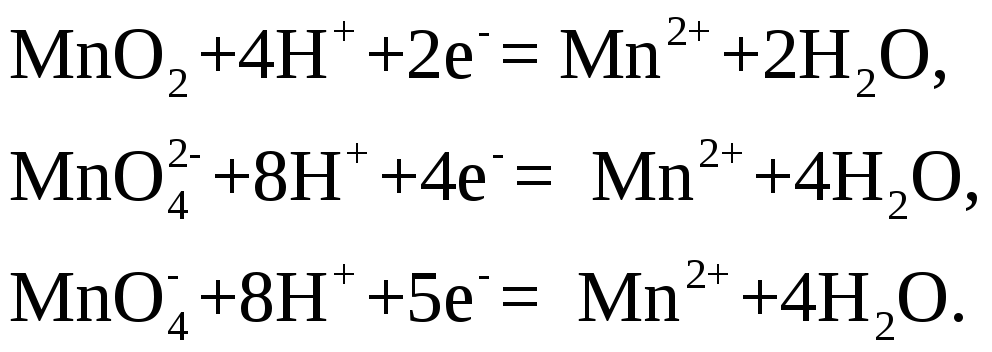
В нейтральной или
слабощелочной среде восстановление
![]() и
и![]() сопровождается образованием двуокиси
марганца:
сопровождается образованием двуокиси
марганца:
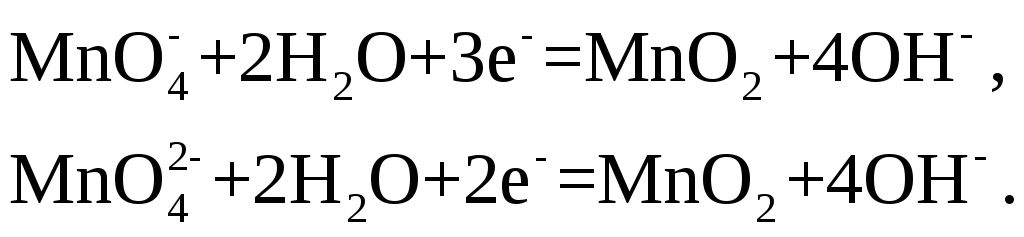
Хромовая и
двухромовая кислоты и их соли, действуя
в качестве окислителей, восстанавливаются
до трехвалентного катиона
![]() ,
образующего соответствующие соли
,
образующего соответствующие соли![]() в зависимости от прибавляемой кислоты:
в зависимости от прибавляемой кислоты:
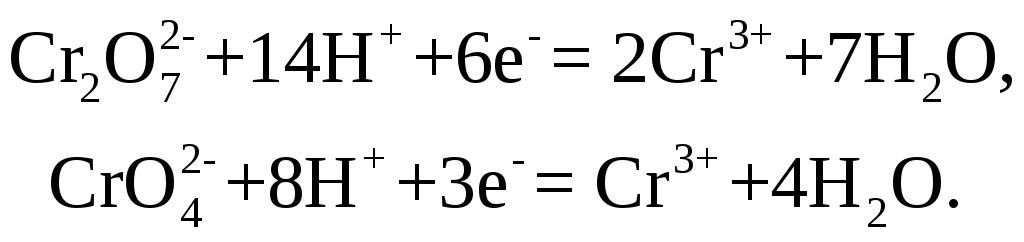
Хлор и бром в
кислородных кислотах и их солях, действуя
в качестве окислителей, обычно переходят
в отрицательно заряженные ионы
![]() и
и![]() .
Йод в кислородных кислотах и их солях
восстанавливается до свободного йода,
а при действии более сильных восстановителей
– до отрицательно заряженного иона
.
Йод в кислородных кислотах и их солях
восстанавливается до свободного йода,
а при действии более сильных восстановителей
– до отрицательно заряженного иона![]() .
.
Окислители –
ион Н+
и ионы металлов в их высшей степени
окисления.
В эту группу окислителей входят
соединения, содержащие положительно
заряженный ион Н+
(вода, кислоты и щелочи), который при
взаимодействии с восстановителем
переходит в элементарный водород. Ионы
металлов в их высшей степени окисления,
например
![]() ,
выполняя функцию окислителей, переходят
в ионы с более низкой степенью окисления.
,
выполняя функцию окислителей, переходят
в ионы с более низкой степенью окисления.
Восстановители
– элементарные вещества.
К этой группе восстановителей относятся
металлы и некоторые другие элементарные
вещества, как, например, водород, углерод
и др., атомы которых способны терять
электроны и переходить в окисленное
состояние. Металлы образуют при этом
соответствующие соли в зависимости от
кислоты, участвующей в реакции. Такие
металлы, как цинк, алюминий и некоторые
другие, могут восстанавливать и в
щелочной среде, поскольку эти металлы
растворимы в щелочах с образованием
гидроксоцинкатов, гидроксоалюминатов
и т. д. Являясь сильными восстановителями,
при реакции, например с некоторыми
растворами азотной или серной кислоты,
они способны восстановить центральные
ионы этих кислот до низших степеней
окисления, т. е. до
![]() или
или![]() ,
по схемам:
,
по схемам:
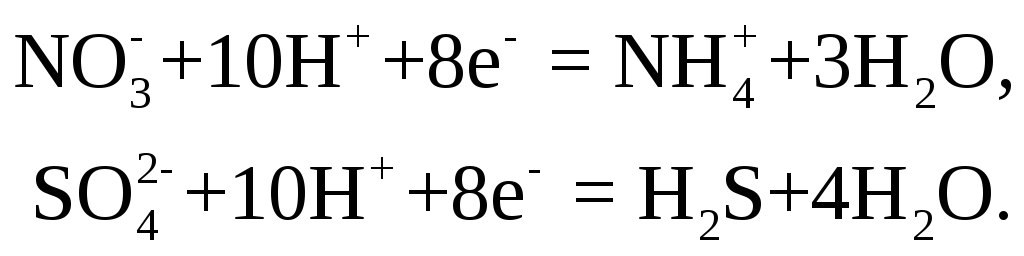
Восстановители – низшие кислородные кислоты и их соли. Молекулы этих восстановителей содержат один или несколько атомов элемента в одном из его низших состояний окисления. При взаимодействии с окислителями эти атомы теряют электроны и образуют соединения, отвечающие максимальному положительному состоянию окисления данного элемента. Например,
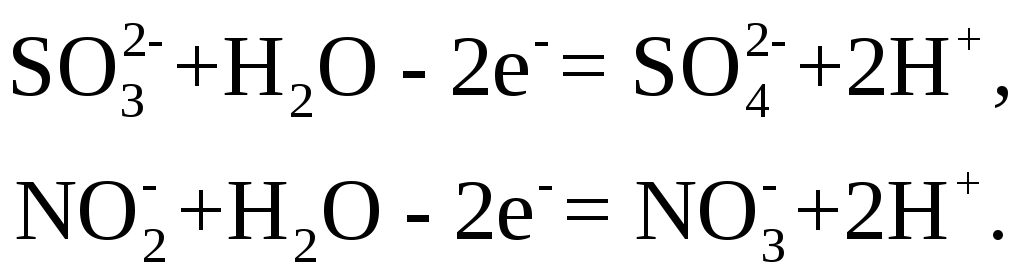
Восстановители – положительно заряженные ионы металлов. К этой группе восстановителей относятся ионы металлов в их низшей степени окисления и способные при взаимодействии с окислителем повышать степень окисления за счет перехода электронов к окислителю.
Восстановители
– отрицательно заряженные элементарные
ионы. К этой
группе восстановителей относятся
бескислородные кислоты и их соли, а
также гидриды щелочных и щелочноземельных
металлов (![]() и др.). Молекулы этих восстановителей
содержат отрицательно заряженные
элементарные ионы, способные терять
электроны и переходить в состояние
нейтральных атомов или молекул или
претерпевать дальнейшее окисление.
и др.). Молекулы этих восстановителей
содержат отрицательно заряженные
элементарные ионы, способные терять
электроны и переходить в состояние
нейтральных атомов или молекул или
претерпевать дальнейшее окисление.
Окислительно-восстановительная
двойственность.
При наличии у элемента способности
проявлять переменные степени окисления,
можно говорить о крайних и промежуточных
степенях окисления его. Так, азот обладает
крайними степенями окисления – 3 (в
![]() ,
аммонийных солях и нитридах металлов)
и + 5 (в азотной кислоте, ее солях и
производных). Можно привести ряд
соединений, в которых степень окисления
азота имеет промежуточное значение
между указанными крайними значениями.
,
аммонийных солях и нитридах металлов)
и + 5 (в азотной кислоте, ее солях и
производных). Можно привести ряд
соединений, в которых степень окисления
азота имеет промежуточное значение
между указанными крайними значениями.
![]()
Молекулы и атомы, отвечающие крайним степеням окисления, ведут себя однозначно: одни могут быть только восстановителями, другие – только окислителями. Азот в аммиаке и нитридах металлов достигает максимальной отрицательной степени окисления и не способен более к присоединению электронов. В азотной кислоте и ее солях азот достигает максимальной положительной степени окисления и не способен более терять электроны.
Если же соединение или простое вещество содержит атомы элемента в промежуточной степени окисления, то оно может вести себя двояко: оно может и приобретать, и терять электроны. В первом случае оно ведет себя как окислитель, во втором – как восстановитель. Его поведение определяется химической природой элемента-партнера, с которым оно соприкасается, условиями и характером среды, в которой протекает окислительно-восстановительная реакция.
Сера в свободном
состоянии играет роль окислителя по
отношению к водороду и металлам и роль
восстановителя по отношению к кислороду
или хлору. Водород в подавляющем
большинстве случаев ведет себя как
восстановитель, а по отношению к щелочным
и щелочноземельным металлам – как
окислитель. Азотистая кислота и нитриты
являются восстановителями по отношению
к сильным окислителям (![]() )
и окислителями по отношению к
восстановителям (
)
и окислителями по отношению к
восстановителям (![]() ).
Аналогичным образом ведет себя и перекись
водорода. Йод является слабым окислителем
и сам окисляется более сильными
окислителями, например хлорной водой
или азотной кислотой.
).
Аналогичным образом ведет себя и перекись
водорода. Йод является слабым окислителем
и сам окисляется более сильными
окислителями, например хлорной водой
или азотной кислотой.
Большое влияние на направление окислительно-восстановительной реакции могут оказать условия, в которых она протекает.
Перекись водорода в кислой среде окисляет йод в йодноватую кислоту, а при некоторой меньшей кислотности вновь восстанавливает йодноватую кислоту до свободного йода. Гидроксиламин в кислом растворе восстанавливает сульфат железа (III) в сульфат железа (II), а в щелочном растворе окисляет гидроокись железа (II) в гидроокись железа (III). Хлор, бром и йод диспропорционируют в щелочной среде, а в кислой среде реакция протекает в обратном направлении.
Ниже приведены примеры некоторых соединений, проявляющих окислительно-восстановительную двойственность.
Азотистая кислота и нитриты, действуя в качестве восстановителей, окисляются при этом в азотную кислоту или ее соли. Действуя в качестве окислителей, они восстанавливаются при этом до NO или более низких степеней окисления азота в зависимости от характера восстановителя. Гидроксиламин восстанавливается до аммиака, а окисляется до свободного азота или до N2О. Гидразин – сильный восстановитель, но сам может восстановиться, подвергаясь действию водорода в момент выделения.
Пероксид водорода,
пероксиды металлов, дисульфид
водорода
![]() идисульфиды
металлов. В
соединениях этого типа, т. е.
идисульфиды
металлов. В
соединениях этого типа, т. е.
![]() и некоторых других, содержатся двухзарядные
ионы
и некоторых других, содержатся двухзарядные
ионы![]() и
и![]() ,
поэтому степень окисления каждого из
атомов кислорода и серы, образующих
данные цепи, равна -1. В соответствии со
сказанным выше эти соединения могут
играть роль окислителей, действуя по
схемам
,
поэтому степень окисления каждого из
атомов кислорода и серы, образующих
данные цепи, равна -1. В соответствии со
сказанным выше эти соединения могут
играть роль окислителей, действуя по
схемам
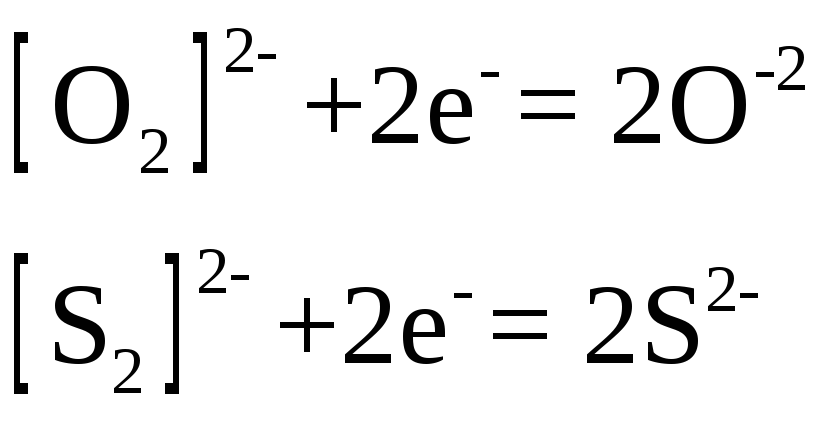
В молекулярно-ионном виде схемы имеют вид
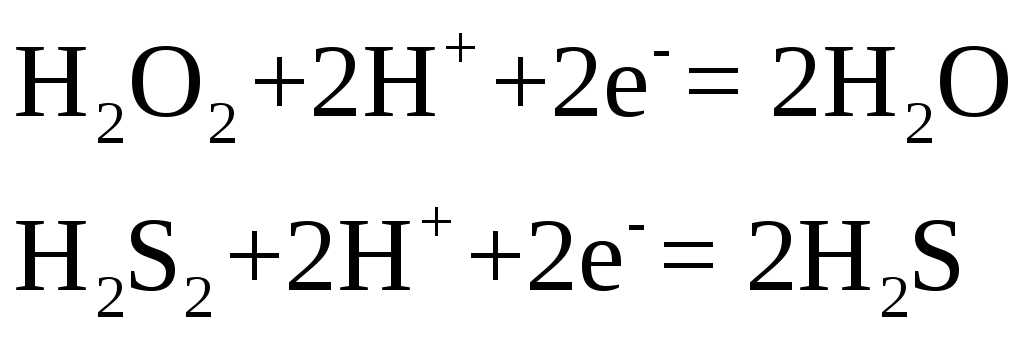
Эти же соединения могут играть и роль восстановителей

с образованием свободного кислорода или свободной серы.
Молекулярно-ионные схемы имеют вид
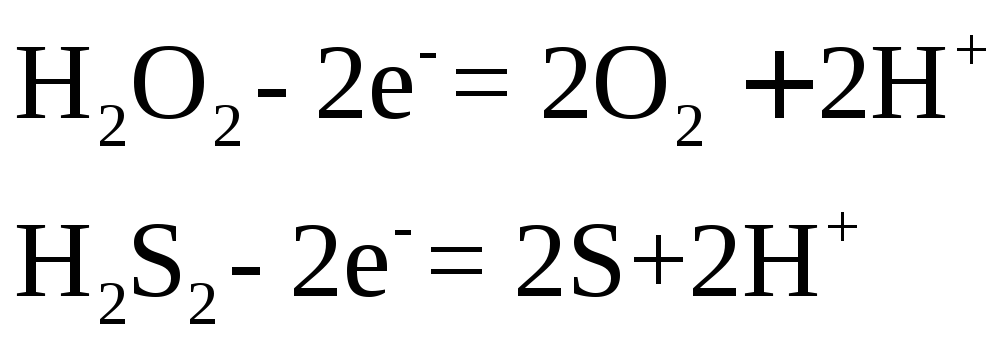
В зависимости от характера окислителя и условий реакции сера может подвергнуться более глубокому окислению
![]()
или по схеме
![]()
а в молекулярно-ионном виде
![]()
Говоря об
окислительно-восстановительной
двойственности, не следует забывать,
что в некоторых случаях она может быть
обусловлена различной природой отдельных
составных частей молекулы. Так, соляная
кислота является восстановителем за
счет отрицательно заряженных ионов
![]() и окислителем за счет положительно
заряженных ионов Н+.
Аммиак ведет себя как восстановитель
за счет отрицательно заряженного
и окислителем за счет положительно
заряженных ионов Н+.
Аммиак ведет себя как восстановитель
за счет отрицательно заряженного
![]() и как окислитель по отношению к щелочным
металлам, с которыми образует амиды:
и как окислитель по отношению к щелочным
металлам, с которыми образует амиды:
![]()
Поэтому такие
кислоты, как
![]() и
и![]() ,
являются как бы «двойными» окислителями.
В концентрированном состоянии они
окисляют главным образом за счет ионов
,
являются как бы «двойными» окислителями.
В концентрированном состоянии они
окисляют главным образом за счет ионов![]() и
и![]() ,
а в разбавленном состоянии при
взаимодействии с определенными металлами
за счет Н+
– ионов.
,
а в разбавленном состоянии при
взаимодействии с определенными металлами
за счет Н+
– ионов.
