- •И. В. Крепышева
- •Содержание
- •Тема 7. Химия металлов 125
- •1.2. Квантово-механическая модель атома водорода
- •1.3. Строение многоэлектронных атомов
- •1.4. Периодическая система элементов д.И. Менделеева
- •1.5. Периодические свойства элементов
- •1.6. Решение типовых задач
- •1.7. Задачи для самостоятельного решения
- •Тема 2. Химическая связь
- •2.1. Ковалентная связь
- •2.2. Гибридизация атомных орбиталей
- •2.3. Ионная химическая связь
- •2.4. Металлическая связь
- •2.5. Водородная связь
- •2.6. Строение твердого тела
- •Тема 3. Элементы химической термодинамики
- •3.1. Основные понятия термодинамики
- •3.2. Внутренняя энергия
- •3.3. Энтальпия
- •3.4. Термохимия. Закон Гесса
- •3.5. Энтропия
- •3.6. Самопроизвольные процессы. Энергия Гиббса
- •3.7. Решение типовых задач
- •3.8. Задачи для самостоятельного решения
- •Тема 4. Химическая кинетика и химическое равновесие
- •4.1. Скорость химической реакции
- •4.2. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •4.3. Зависимость скорости реакции от температуры
- •4.4. Катализ
- •4.5. Химическое равновесие
- •4.6. Смещение химического равновесия. Принцип Ле Шателье
- •4.7. Решение типовых задач
- •4.8. Задачи для самостоятельного решения
- •Тема 5. Растворы. Дисперсные системы
- •5.1. Общие свойства растворов
- •5.2. Способы выражения состава растворов
- •5.3. Теория электролитической диссоциации
- •5.4. Теории кислот и оснований
- •5.5. Ионные реакции в растворах
- •5.6. Ионное произведение воды. Водородный показатель рН
- •5.7. Гидролиз солей
- •5.8. Дисперсные системы и их классификация
- •5.9. Решение типовых задач
- •28,57 Г соли растворены в 71,43 г воды
- •3% Массы раствора составляют 48,84 г
- •Соотношение между рН и рОн
- •5.10. Задачи для самостоятельного решения
- •Тема 6. Окислительно-восстановительные электрохимические процессы
- •6.1. Основные понятия
- •Правила определения степени окисления
- •6.2. Составление уравнений окислительно-восстановительных реакций
- •6.3. Влияние среды на характер протекания реакций
- •6.4. Важнейшие окислители и восстановители
- •6.5. Электрохимические процессы
- •96500 Кл (26,8 а∙ч) – 31,77 г Cu (масса моля эквивалентов)
- •96500 Кл – 1 г (11,2 л– объем моля эквивалентов)
- •6.6. Гальванический элемент Даниэля-Якоби
- •6.7. Окислительно-восстановительные потенциалы
- •6.8. Эдс окислительно-восстановительных реакций
- •6.9. Электролиз расплавов и растворов солей
- •6.10. Некоторые области применения электрохимии
- •6.11. Решение типовых задач
- •6.12. Задачи для самостоятельного решения
- •Тема 7. Химия металлов
- •7.1. Общая характеристика металлов
- •7.2. Химические свойства металлов
- •7.3. Взаимодействие металлов с кислотами
- •Взаимодействие металлов с соляной кислотой.
- •Взаимодействие металлов с азотной кислотой
- •Взаимодействие металлов с серной кислотой
- •7.4. Сплавы
- •7.5. Получение металлов
- •Тема 8. Коррозия и защита металлов
- •8.1. Определение и классификация коррозионных процессов
- •8.2. Химическая коррозия
- •8.3. Электрохимическая коррозия
- •8.4. Возможность коррозии с водородной и кислородной деполяризацией
- •8.5. Защита металлов от коррозии
- •8.6. Решение типовых задач
- •8.7. Задачи для самостоятельного решения
- •Тема 9. Органические полимерные материалы
- •9.1. Классификация полимерных (высокомолекулярных) материалов
- •9.2. Строение полимеров
- •9.3. Кристаллическое и аморфное состояние полимеров
- •9.4. Методы получения полимеров
- •9.5. Применение полимеров
- •Тема 10. Химическая идентификация и анализ вещества
- •10.1. Химическая идентификация вещества
- •Некоторые реагенты для идентификации катионов
- •Классификация анионов по окислительно-восстановительным свойствам
- •Некоторые реагенты для идентификации анионов
- •10.2. Количественный анализ. Химические методы анализа
- •10.3. Инструментальные методы анализа
- •Приложение
- •Важнейшие единицы си и их соотношение с единицами других систем
- •Приставки для дольных и кратных единиц си
- •Термодинамические характеристики некоторых веществ при 298 к
- •Стандартные потенциалы металлических
- •Энергия разрыва связи
- •Электроотрицательность элементов по Полингу
- •Стандартные окислительно-восстановительные потенциалы элементов
- •Растворимость соединений
- •Обозначения: р – растворимый, м – малорастворимый, н – нерастворимый,
- •Константы диссоциации Кд слабых электролитов
- •Распределение электронов в атоме
- •Список литературы
- •Крепышева Ирина Вадимовна
- •Учебное пособие для самостоятельной работы студентов
- •Нехимических специальностей и направлений
5.8. Дисперсные системы и их классификация
В середине 19 века английский химик Томас Грэм (1805-1869) обнаружил вещества с загадочными свойствами. При выпаривании их растворов вместо кристаллов получались аморфные студенистые массы. Они имели клеющие свойства. По-гречески клей – «колла», поэтому Грэм назвал эти вещества коллоидами.
Позже выяснилось, что из одного и того же вещества можно приготовить и обычный, и коллоидный раствор. Просто в обычных растворах вещество находится в виде отдельных молекул или ионов, а в коллоидных в виде крупных частиц.
Например, поваренная соль в органическом растворителе (бензоле) образует типичную коллоидную систему.
В любом коллоиде выделяются две фазы: сплошная (дисперсионная среда) и дисперсная или прерывистая – мелкие твердые частицы, капли жидкости или пузырьки газа.
Крайне редки газы, жидкости или твердые материалы, в которых отсутствуют коллоидные частицы.
Гелеобразную структуру имеет даже головной мозг. И. И. Жуков (представитель коллоидной химии) говорил, что «человек – ходячий коллоид».
В зависимости от размера частиц дисперсные системы подразделяют на группы:
а) взвеси (суспензии, эмульсии), у которых частицы имеют размер 10-6 м и более (1000 нм);
б)
коллоидные системы, размер частиц (от
10-9
м до
![]() м) от 1 до 500 нм.
м) от 1 до 500 нм.
Дисперсные системы также классифицируют по агрегатному состоянию дисперсной фазы и дисперсионной среды.
|
Тип дисперсной системы |
Фазовое состояние |
Примеры | |
|
дисперсионной среды |
дисперсной фазы | ||
|
аэрозоль |
газ |
жидкость |
туман, облака |
|
аэрозоль |
газ |
твердая |
дым, пыль |
|
пена |
жидкая |
газ |
взбитые сливки, мыльная пена |
|
эмульсия emulgere(лат.) |
жидкая «доить» (т. к. первая изученная эмульсия – молоко) |
жидкая |
молоко, кровь, майонез |
|
золь |
жидкая |
твердая |
краски |
|
твердая эмульсия |
твердая |
жидкая |
масло |
|
гель |
твердая |
жидкая |
желе, агар-агар |
|
|
твердая |
газ |
пемза, пенопласт |
Коллоидные
растворы. Коллоидное
состояние характерно для многих веществ,
если их частицы имеют размер от 1 до 500
нм (10-9
м![]() м).
м).
Коллоидная частица имеет сложное строение.
Она включает в себя:
ядро;
адсорбированные ионы;
противоионы;
растворитель.
Примеры коллоидных частиц:

ядро
![]()
![]()
золь

ядро
![]()
![]()
золь

ядро
![]()
![]()
золь
Как видно, ядро
состоит из электронейтрального агрегата
с адсорбированными ионами элементов
(![]() ).
).
Коллоидная частица кроме ядра имеет противоионы и молекулы растворителя.
Адсорбированные ионы и противоионы с растворителями образуют адсорбированный слой.
Заряд коллоидной частицы равен разности зарядов адсорбированных ионов и противоионов.
Вокруг частиц находится диффузный слой ионов, заряд которых равен заряду коллоидной частицы. Коллоидная частица и диффузный слой образуют электронейтральную мицеллу.
Методы получения коллоидных растворов. Для приготовления коллоидных растворов следует получить частицы размером от 1 до 500 нм, подобрать дисперсионную среду, в которой не растворяется вещество частиц, обеспечить устойчивость частиц.
Частицы соответствующих размеров получают:
I. Дробление крупных частиц. Эти методы называются диспергационными.
1) механическое диспергирование (раздавливание, расщепление, истирание);
2) ультразвуковое диспергирование;
3) электрическое диспергирование.
II. Объединение молекул или ионов. Такие методы называются конденсационными.
1) конденсация из паров при понижении температуры;
2) метод замены растворителя – дисперсионная фаза возникает вследствие меньшей растворимости вещества в новом растворителе.
3) химические методы
(дисперсионная фаза возникает в результате
ОВР, гидролиза или реакции обмена.
Например, в результате гидролиза солей
железа (III)
получают его гидроксид:
![]() ).
).
В качестве вещества коллоидных частиц в водных средах служат металлы, оксиды, гидрокисды, сульфиды и другие. Для повышения устойчивости коллоидов в раствор вводят стабилизаторы, например, ПАВ или ионы вещества, из которого состоит частица.
Электрические и оптические свойства коллоидных растворов.
Если рассматривать путь светового луча, проходящего через совершенно прозрачный коллоидный раствор, сбоку на темном фоне, то он становится видимым.
|
Этот оптический эффект называется конусом Тиндаля (рис. 5.5.) При сильном увеличении каждая частица в конусе Тиндаля кажется светящейся точкой. Эффект вызывается рассеянием света частицами дисперсной фазы. При сильном увеличении каждая частица в конусе Тиндаля кажется светящейся точкой. Эффект Тиндаля можно наблюдать в темноте при прохождении луча света через запыленное или накуренное помещение. |
Рис. 5.5. Эффект Тиндаля |
В 1909 г. проф. Московского университета Ф. Ф. Рейсс наблюдал воздействие постоянного электрического тока на диспергированную глину и на этом основании описал электрические свойства коллоидных растворов. Частицы дисперсной фазы (глины) перемещались к аноду, где вследствие их большого скопления наблюдалось помутнение раствора.
|
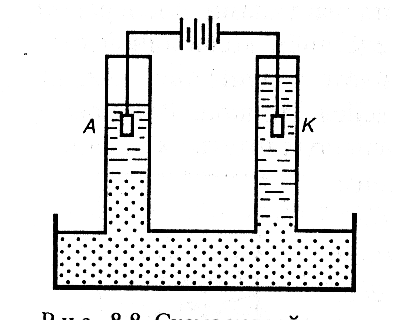
Частицы же дисперсионной среды (воды) перемещались к катоду, где наблюдалось повышение уровня прозрачной жидкости (рис. 5.6.). Направленное движение частиц к электродам говорило об их заряде, причем дисперсная фаза несет на себе заряд, противоположный по знаку заряду среды. Движение частиц дисперсной фазы к одному из электродов при пропускании через золь постоянного электрического тока называется электрофорезом, а движение частиц дисперсной среды – электроосмосом. |
Рис. 5.6. Схема устройства для демонстрации электрофореза |
|
На границе раздела фаз возникает двойной электрический (ток) слой, состоящий из тонкой (адсорбционной) части и протяженной диффузионной части (рис. 5.7.а) Между фазами возникает разность потенциалов, называемая электротермодинамическим потенциалом φ. Часть скачка потенциала, обусловленная диффузным слоем, называется электрокинетическим или ξ (дзета) – потенциалом (рис. 5.7.б). Электрокинетический потенциал определяется толщиной и зарядом диффузного слоя, которые зависят от концентрации и заряда противоионов и температуры.
|
Рис. 5.7. Двойной электрический слой: а) распределение зарядов; б) падение потенциала в двойном слое |
Электрические свойства коллоидных растворов объясняют их агрегативную устойчивость, которая проявляется в том, что частицы дисперсной фазы не укрупняются, не слипаются. Частицы дисперсной фазы одноименно заряжены, поэтому отталкиваются друг от друга.
Наличие электрического заряда у частиц дисперсной фазы приводит к их значительной гидратации. Гидратная оболочка также уменьшает стремление частиц к укрупнению. Гидратная оболочка приводит также к разобщению частиц, что повышает агрегативную устойчивость.
Кинетические свойства дисперсных систем.
1. Броуновское движение – беспорядочное, хаотичное движение коллоидных и дисперсных частиц.
2. Диффузия – скорость диффузии при постоянной температуре и вязкости среды зависит от величины и формы частиц. Медленность диффузии является признаком, отличающим коллоидные системы от истинных растворов.
3. Седиментацией называется свободное оседание частиц в вязкой среде под действием гравитационного поля. Истинные и коллоидные растворы седиментационно устойчивы.
Кинетические свойства коллоидных растворов определяют их кинетическую устойчивость, которая состоит в том, что концентрация коллоидных растворов одинакова по всему объему системы.