- •И. В. Крепышева
- •Содержание
- •Тема 7. Химия металлов 125
- •1.2. Квантово-механическая модель атома водорода
- •1.3. Строение многоэлектронных атомов
- •1.4. Периодическая система элементов д.И. Менделеева
- •1.5. Периодические свойства элементов
- •1.6. Решение типовых задач
- •1.7. Задачи для самостоятельного решения
- •Тема 2. Химическая связь
- •2.1. Ковалентная связь
- •2.2. Гибридизация атомных орбиталей
- •2.3. Ионная химическая связь
- •2.4. Металлическая связь
- •2.5. Водородная связь
- •2.6. Строение твердого тела
- •Тема 3. Элементы химической термодинамики
- •3.1. Основные понятия термодинамики
- •3.2. Внутренняя энергия
- •3.3. Энтальпия
- •3.4. Термохимия. Закон Гесса
- •3.5. Энтропия
- •3.6. Самопроизвольные процессы. Энергия Гиббса
- •3.7. Решение типовых задач
- •3.8. Задачи для самостоятельного решения
- •Тема 4. Химическая кинетика и химическое равновесие
- •4.1. Скорость химической реакции
- •4.2. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •4.3. Зависимость скорости реакции от температуры
- •4.4. Катализ
- •4.5. Химическое равновесие
- •4.6. Смещение химического равновесия. Принцип Ле Шателье
- •4.7. Решение типовых задач
- •4.8. Задачи для самостоятельного решения
- •Тема 5. Растворы. Дисперсные системы
- •5.1. Общие свойства растворов
- •5.2. Способы выражения состава растворов
- •5.3. Теория электролитической диссоциации
- •5.4. Теории кислот и оснований
- •5.5. Ионные реакции в растворах
- •5.6. Ионное произведение воды. Водородный показатель рН
- •5.7. Гидролиз солей
- •5.8. Дисперсные системы и их классификация
- •5.9. Решение типовых задач
- •28,57 Г соли растворены в 71,43 г воды
- •3% Массы раствора составляют 48,84 г
- •Соотношение между рН и рОн
- •5.10. Задачи для самостоятельного решения
- •Тема 6. Окислительно-восстановительные электрохимические процессы
- •6.1. Основные понятия
- •Правила определения степени окисления
- •6.2. Составление уравнений окислительно-восстановительных реакций
- •6.3. Влияние среды на характер протекания реакций
- •6.4. Важнейшие окислители и восстановители
- •6.5. Электрохимические процессы
- •96500 Кл (26,8 а∙ч) – 31,77 г Cu (масса моля эквивалентов)
- •96500 Кл – 1 г (11,2 л– объем моля эквивалентов)
- •6.6. Гальванический элемент Даниэля-Якоби
- •6.7. Окислительно-восстановительные потенциалы
- •6.8. Эдс окислительно-восстановительных реакций
- •6.9. Электролиз расплавов и растворов солей
- •6.10. Некоторые области применения электрохимии
- •6.11. Решение типовых задач
- •6.12. Задачи для самостоятельного решения
- •Тема 7. Химия металлов
- •7.1. Общая характеристика металлов
- •7.2. Химические свойства металлов
- •7.3. Взаимодействие металлов с кислотами
- •Взаимодействие металлов с соляной кислотой.
- •Взаимодействие металлов с азотной кислотой
- •Взаимодействие металлов с серной кислотой
- •7.4. Сплавы
- •7.5. Получение металлов
- •Тема 8. Коррозия и защита металлов
- •8.1. Определение и классификация коррозионных процессов
- •8.2. Химическая коррозия
- •8.3. Электрохимическая коррозия
- •8.4. Возможность коррозии с водородной и кислородной деполяризацией
- •8.5. Защита металлов от коррозии
- •8.6. Решение типовых задач
- •8.7. Задачи для самостоятельного решения
- •Тема 9. Органические полимерные материалы
- •9.1. Классификация полимерных (высокомолекулярных) материалов
- •9.2. Строение полимеров
- •9.3. Кристаллическое и аморфное состояние полимеров
- •9.4. Методы получения полимеров
- •9.5. Применение полимеров
- •Тема 10. Химическая идентификация и анализ вещества
- •10.1. Химическая идентификация вещества
- •Некоторые реагенты для идентификации катионов
- •Классификация анионов по окислительно-восстановительным свойствам
- •Некоторые реагенты для идентификации анионов
- •10.2. Количественный анализ. Химические методы анализа
- •10.3. Инструментальные методы анализа
- •Приложение
- •Важнейшие единицы си и их соотношение с единицами других систем
- •Приставки для дольных и кратных единиц си
- •Термодинамические характеристики некоторых веществ при 298 к
- •Стандартные потенциалы металлических
- •Энергия разрыва связи
- •Электроотрицательность элементов по Полингу
- •Стандартные окислительно-восстановительные потенциалы элементов
- •Растворимость соединений
- •Обозначения: р – растворимый, м – малорастворимый, н – нерастворимый,
- •Константы диссоциации Кд слабых электролитов
- •Распределение электронов в атоме
- •Список литературы
- •Крепышева Ирина Вадимовна
- •Учебное пособие для самостоятельной работы студентов
- •Нехимических специальностей и направлений
2.5. Водородная связь
Химическая связь, образованная положительно поляризованным водородом молекулы А-Н (или полярной группы –А-Н) и электроотрицательным атомом В другой или той же молекулы, называется водородной связью. Если водородная связь образуется между разными молекулами, она называется межмолекулярной, если связь образуется между двумя группами одной и той же молекулы, то она называется внутимолекулярной. Водородная связь между молекулами А-Н и В-R обозначается тремя точками
А-Н + В-R → А-Н…В-R
Водород в данном случае образует две химические связи, причем они не равноценны.
Образование водородной связи обусловлен тем, что в полярных молекулах А-Н или полярных группах –А-Н поляризованный атом водорода обладает уникальными свойствами: осутствием внутренних электронных оболочек, значительным сдвигом электронной пары к атому с высокой электроотрицательностью и очень малым размером. Поэтому водород способен глубоко внедряться в электронную оболочку соседнего отрицательно поляризованного атома.
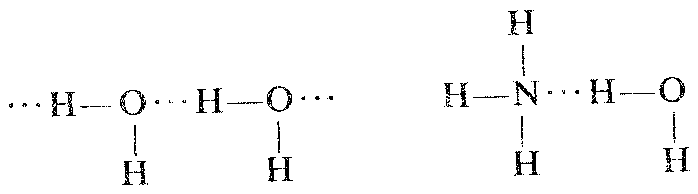
Атомы А и В могут быть одинаковыми, как при взаимодействии HF
![]()
но могут быть и разными, как при взаиодействии воды и фтороводорода.
Энергия водородной связи возрастает с увеличением электроотрицательности и уменьшением размеров атомов В. Поэтому наиболее прочные водородные связи возникают, когда в качестве атомов В выступают F, O или N. Несмотря на высокую электроотицательность у хлора, водородная связь –Н…Cl- относительно слабая из-за большого размера атома хлора. Длины водородных связей имеют промежуточное значение. Например, у воды длина связи О-Н – 0,096 нм, а связи О…Н – 0,177 нм.
При возникновении водородных связей образуются димеры, триммеры или полимерные структуры, например зигзагообразные структуры (HF)n или более сложные конфигурации, например у льда:
Образование межмолекулярных вдородных связей приводит к существенному изменению свойств веществ: повышению вязкости, диэлектрической постоянной, температур кипения и плавления и парообразования. Например, вода, фтороводород и аммиак имеют аномально высокие температуры кипения и плавления. Под влиянием водородных связей изменяются химические свойства. Например, HF – слабая кислота, в то время ее аналог HCl – сильная кислота.
Так как многие соединения содержат ковалентные полярные связи Н-О и H-N, то водородные связи очень распространены. Они проявляются не только в воде, но и в различных кристаллических веществах, полимерах, белках, живых организмах. Например, практически все соли образуют кристаллогидраты, в которых имеются водородные связи.
Важную роль водородные связи играют в белках, у кторых спиральные полимерные стуктуры объединяются связями N-H…O. Двойные спирали нуклеиновых кислот соединяются межмолекулярными водородными связями N-H…N и N-H…O.
2.6. Строение твердого тела
Твердые вещества могут находиться в аморфном или кристаллическом состоянии.
Таблица 2.4. Различия между аморфными и кристаллическими телами
|
Аморфные |
Кристаллические |
|
1) Не имеют определенной температуры плавления и температуры кристаллизации (тело постепенно разлагается, растекается) также постепенно затвердевает |
1) Имеют строго определенную температуру плавления и температуру кристаллизации. |
|
2) Подобно жидкостям текучи (кусок смолы в теплой комнате за несколько недель принимает форму диска) |
2) Не текучи |
|
3) Упорядоченность структуры наблюдается только на малых участках, структура аморфных тел характеризуется ближним порядком. |
3) В кристалле частицы расположены упорядоченно, на больших участках. Структура кристаллов характеризуется дальним порядком. |
|
4) Излом гладкий и ограничен овальными поверхностями. |
4) Излом ограничен плоскими поверхностями. |
Из аморфных веществ наиболее известно стекло, поэтому аморфное состояние еще называют стеклообразным. В аморфном соотоянии также могут находиться многие полимеры, смолы, простые вещества (Se, Si, Ag и др.), оксиды (SiO2, GeO2, B2O3 и др.), сульфаты, карбонаты, некоторые многокомпонентные неорганические соединения. Аморфные вещества изотропны, т.е. имеют одинаковые свойства во всех направлениях.
Подавляющее большинство твердых тел находятся в кристаллическом состоянии, поэтому в дальнейшем будет рассмотрено лишь это состояние.
Кристаллическая решетка. Упорядоченное расположение частиц в твердом теле изображается в виде решетки, в узлах которой находятся те или иные частицы, соединенные воображаемыми линиями. Монокристаллы характеризуются анизотропностью, т.е. зависимостью свойств от напрвления в пространстве. Следует, однако, отметить, что реальные вещества поликристаллические, т.е. состоят из множества кристаллов, ориентированных по разным осям координат, поэтому в поликристаллических телах анизотропия не проявляется.
1. В узлах молекулярных решеток находятся молекулы.
2. В узлах атомных решеток находятся атомы.
3. В узлах ионных решеток находятся, чередуясь положительно и отрицательно заряженные ионы. Они связаны друг с другом силами электростатического притяжения.
4. В узлах металлических решеток находятся атомы металлов, между которыми свободно движутся общие для этих атомов электроны.
Характеристики кристаллической решетки:
Координационное число – число частиц, непосредственно примыкающих к данной частице в кристалле. Чем больше координационное число, тем плотнее упаковка кристалла.
Постоянная решетки характеризует расстояние между центрами частиц, занимающих узлы в кристалле.
Энергия кристаллической решетки – энергия, необходимая для разрушения 1 моля кристалла и удаления частиц за пределы их взаимодействия. Если в узлах решетки находятся атомы или молекулы, то энергия решетки называется энергией сублимации. Единицей измерения энергии решетки, как и энергии химических связей, является кДж/моль.
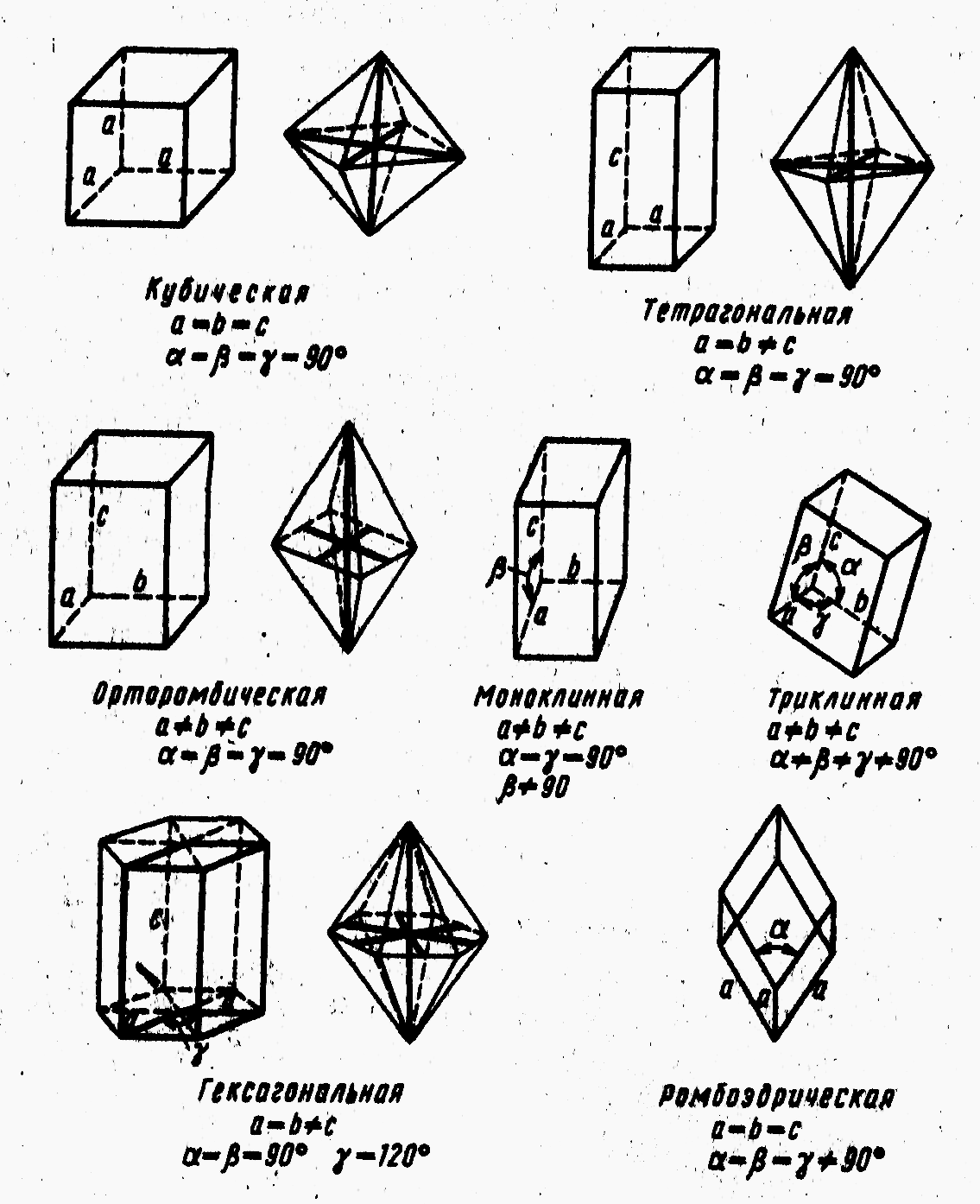
Элементарная ячейка – наименьшая часть кристалла, имеющая все особенности структуры данной решетки. При многократном повторении ячейки по трем измерениям получают всю кристаллическую решетку. Имеется семь основных ячеек (рис.2.11.)
|
|
|
Рис. 2.11. Геометрические фигуры, отвечающие элементарным ячейкам |
Таблица 2.5. Типы кристаллов и свойства веществ
|
Вид частиц в узлах |
Тип кристаллов | |||
|
Свойства веществ |
молекулярные |
атомно-ковалентные |
ионные |
металлические |
|
Частицы |
Молекулы |
Атомы |
Ионы |
Ионы |
|
Тип связей между частицами |
Вадерваальсовы силы, водородные |
Ковалентные |
Ионные |
Металлические |
|
Энергия связей |
Невысокая |
Высокая |
Высокая |
От средней до высокой |
|
Температура плавления |
Низкая |
Высокая |
Высокая |
От низкой до высокой |
|
Механические свойства |
Мягкие |
Очень твердые |
Твердые и хрупкие |
От мягких до очень твердых |
|
Электрическая проводимость |
Диэлектрики |
От диэлектриков до полупроводников |
Диэлекрики |
Электронная |
|
Примеры веществ |
Ar, O2, N2, CO2, H2O |
C, Ge, Si, SiO2,SiC |
KCl, CaF2, Na2CO3 |
Li, Ca, Zn, Ni |
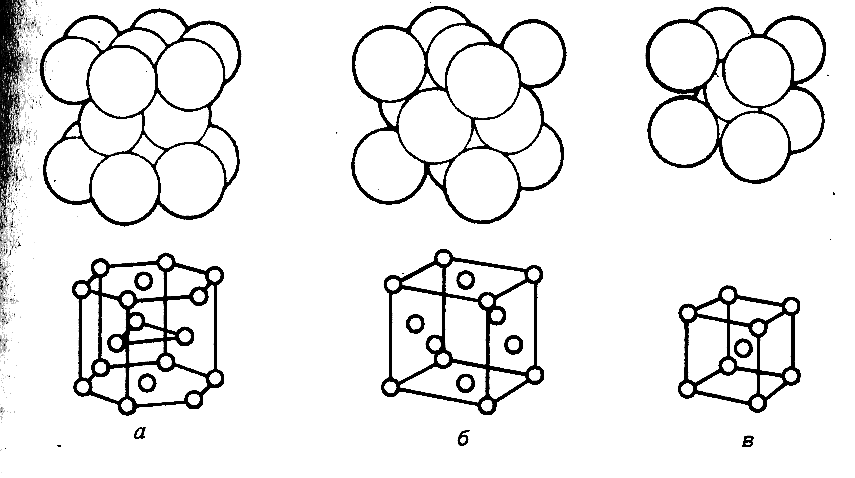
Тип кристаллической системы определяется природой и размерами частиц, видом химических связей между ними, температурой и другими факторами. Частицы размещаются в решетке таким образом, чтобы энергия системы была минимальна. Для частиц сферической формы это достигается при максимальном координационном числе, т.е. при наиболее плотной упаковке (рис.2.12.).
|
|
|
Рис.2.12. Трехмерное изображение упаковок шаров: а) гексагональная; б) кубическая гранецентрированная; в) кубическая объемно центрированная |
Некоторые вещества близкой химической природы образуют одинаковые кристаллические структуры. Такие вещества называют изоморфными. В таких структурах частицы могут замещать друг друга, например Mg2+ и Ca2+ в Сa2SiO4 и Mg2SiO4 или К+ и Rb+, а также Al3+ и Cr3+ в квасцах KAL(SO4)2 ∙ 12H2O. При замещении даже части ионов могут изменяться свойства вещества. Например, при замещении части Al3+ в корунде Al2O3 на ионы Cr3+ прозрачные кристаллы становятся красными (рубин), а на ионы Ti3+ и Fe3+ - синими (сапфир).
Многие соединения могут существовать также в двух или более кристаллических структурах. Такое явление называется полиморфизмом. В качестве примера полиморфизма можно указать существование SiO2 в виде гексагонального кварца, ромбического тридимита и кубического кристобалита. Полиморфные модификации существуют и у большинства простых веществ, в этом случае они называются аллотропными (по форме) модификациями. В качестве примера можно назвать аллотропные модификации углерода: алмаз, графит, карбин и фуллерен.
Дефекты в реальных кристаллах. Реальные твердые тела не педставляют собой идеального монокристалла, простирающегося по всему объему вещества, а состоят из отдельных монокристаллов, называемых кристаллитами, сросшихся друг с другом и имеющих межкристаллитную границу раздела. Отдельные кристаллиты в свою очередь имеют несовершенства, называемые дефектами.
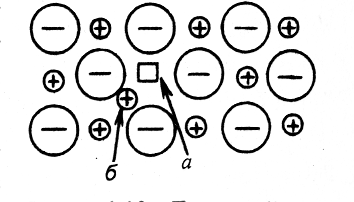
Различают точечные, линейные и плоские дефекты.
|
Рис.2.13. Точечный дефект в ионном кристалле в узле решетки (а) при переходе иона в междоузлие (б) |
1) Точечные дефекты – это либо отсутствие иона или атома в узлах решетки (вакансии) (рис.2.13, а), либо ионы или атомы, находящиеся между узлами решетки (рис.2.13, б). Точечные дефекты оказывают большое влияние на свойства полупроводниковых материалов. Вакансии переходят с одного места на другое. |
2) Линейные дефекты структуры называются дислокациями. Простейший вид дислокации - краевая дислокация – это обрывающийся край одной из атомных плоскостей внутри кристалла. Дислокации, подобно точечным дефектам, подвижны, особенно в металлических кристаллах.
3) Плоские дефекты представляют собой комбинации большого числа точечных и линейных дефектов.
Примесные дефекты обусловлены теми или иными примесями, попадающими в твердое тело при его кристаллизации. Такие примеси могут вызывать полупроводниковые свойства некоторых твердых тел с ковалентными кристаллами.
Из-за наличия дефектов некоторые ионные кристаллы имеют ионную проводимость. Такие твердые вещества, обладающие ионной проводимостью, называются твердыми электролитами.