
Hepatology-I-1
.pdf
Hepato_2003_Last_With_Index.qxd 10.02.2003 18:39 Page 441
X. ЦИРРОЗ ПЕЧЕНИ И ПОРТАЛЬНАЯ ГИПЕРТЕНЗИЯ
кол (берипласт). Это двухкомпонентный тканевой гель из концентрата че ловеческого фибриногена и тромбина. Кроме того, он содержит человече ский альбумин, L аргинина гидрохлорид, L изолейцин, глутаминат натрия, хлорид и цитрат натрия. Тиссукол обладает преимуществом вызывать ло кальный тромбоз сосудов без значительного повреждения окружающих тканей.
Методика эндоскопической склеротерапии осуществляется поэтап но, с динамическим контролем за эффективностью лечения. Лечебные се ансы проводят еженедельно. У большинства пациентов возможно амбула торное использование данного метода.
Склерозирование начинают с преимущественно интравазального введения препаратов. Склерозант вводят в каждый варикозный ствол, на чиная с зоны пищеводно желудочного перехода и далее в проксимальном направлении до уровня средней трети пищевода. В процессе каждой инъекции используют от 1 до 3 мл раствора. Кровотечение из точек вкола останавливают компрессией дистальным колпачком или паравазальным введением 0,5–2 мл склерозанта с обеих сторон от кровоточащей вены. После интравазального обеспечения основных венозных стволов исполь зуют паравазальное введение, что позволяет потенциировать суммарный эффект процедуры. Общий объем препарата не должен превышать 30 мл. Начиная с третьего сеанса используют преимущественно паравазальный способ, при котором введением препарата в подслизистый слой преследуют цель создания на его месте плотной фиброзной выстилки. Тем самым значи тельно снижается частота возникновения рецидива варикозной трансформа ции вен. На данном этапе профилактического лечения лекарственное вещество вводят в объеме 1–2 мл в пространство между варикозно расширенными ве нами в нижней трети пищевода. В случае возникновения постсклеротической язвы следует отступить от края последней на расстояние не менее 1–2 см.
Лечение продолжается до получения эффекта эрадикации либо до ичезновения факторов риска кровотечения. Для этого требуется в среднем 5–6 сеансов склеротерапии. Первые два или три сеанса проводятся с ин тервалом 5–8 дней, а последующие — 2–4 недели.
Результат лечения по данным эндоскопической картины можно рас ценить как:
удовлетворительный — при сохранении формы и размеров вен, соответствующих типу F3, но уменьшении выраженности вари козно расширенных вен и/или исчезновении других факторов риска кровотечения;
хороший — при изменении формы вен с F3 до F2 в сочетании с редукцией других неблагоприятных признаков;
441

Hepato_2003_Last_With_Index.qxd 10.02.2003 18:39 Page 442
РУКОВОДСТВО ПО ХИРУРГИИ ПЕЧЕНИ И ЖЕЛЧЕВЫВОДЯЩИХ ПУТЕЙ
отличный — при достижении формы вен F0–F1 с исчезновением остальных факторов риска (эффект эрадикации).
Динамический контроль осуществляется через 3 месяца после окон чания курса профилактического лечения, а в последующем один раз в пол года. В случае рецидива варикозного расширения вен в пищеводе до сте пени F3 с появлением «красных маркеров» лечение повторяется.
В первые 2–3 месяца после начала эндоскопического лечения риск кровотечения остается относительно высоким, что связано с неполной облитерацией имеющихся вариксов. В течение первых 2 месяцев частота рецидива у пациентов функциональной группы Child A составляет 9%, Child B — 26%, а Child C достигает 63%. После достижения эрадикации варикозно расширенных вен риск кровотечения у пациентов группы Child A составляет около 5%, а у больных менее благоприятных функциональных стадий снижается до 10–20%.
Эндоскопическое лигирование. Быстрое и успешное внедрение метода лигирования варикозно расширенных вен пищевода и желудка в программу профилактики и лечения варикозных кровотечений обусловлено рядом его преимуществ по сравнению со склеротерапией. Эндоскопическое лигирова ние быстрее позволяет достичь желаемого эффекта, более безопасно и лег че переносится пациентами.
Выделяют методику прямого и спирального лигирования.
При остром кровотечении выполняют прямое лигирование кровото чащего участка варикозной вены. Для решения этой задачи эндоскоп под водят к зоне дефекта варикозной вены. Лигатура накладывается непосред ственно на этот участок. В большинстве случаев достаточно одной аппли кации кольца (петли), чтобы достигнуть гемостаза. В ряде случаев необходимо осуществить дополнительное лигирование. В том случае, если первую лигатуру не удалось точно расположить в зоне повреждения, по следующее лигирование выполняют дистальнее места кровотечения в про екции варикса, тем самым прекращая кровоток по нему и достигая оста новки кровотечения.
В случае если не удается четко установить участок повреждения вены, проводится «спиральное» лигирование, когда эластичные кольца (лига турные петли) накладываются последовательно по спирали на каждый ва рикозный ствол. На каждый ствол используют от 2 до 4 колец до полной остановки кровотечения.
Профилактическое лигирование изначально предполагает спираль ный метод аппликации. Начиная от гастроэзофагеального перехода, лига туры накладываются таким образом, чтобы в одной плоскости располага лась лишь одна лигатура. Соблюдение данной методики предотвращает ра
442

Hepato_2003_Last_With_Index.qxd 10.02.2003 18:39 Page 443
X. ЦИРРОЗ ПЕЧЕНИ И ПОРТАЛЬНАЯ ГИПЕРТЕНЗИЯ
звитие стенозов в пищеводе. Возможно наложение до 10 лигатур за один сеанс. Вмешательство не должно повторяться вблизи постлигатурных язв. Чтобы предотвратить опасность кровотечения, следует отступать не менее 1 см от края язвы.
Облитерация варикозных вен тканевыми клеями. Эндоскопи ческая склеротерапия и лигирование не лишены целого ряда недостатков. Стандартные препараты, используемые для склеротерапии, являются до статочно агрессивными химическими агентами. Воспалительная реакция тканей пищевода вследствие введения склерозантов не всегда контролиру ема. Существенного снижения риска кровотечения при выполнении про граммы склеротерапии и лигирования можно ожидать через определенный интервал времени после достижения эффекта эрадикации. Кроме того, склеротерапия и лигирование оказались малоэффективными в отношении профилактики и остановки кровотечения из варикозных вен желудка. Все вышеперечисленное явилось предпосылкой для развития нового напра вления — использования для облитерации варикозно расширенных вен цианакрилатных клеевых композиций. Первые публикации об их примене нии вышли из клиник Франции и Германии в 1984–86 годах.
В настоящее время используются преимущественно 2 цианакрилат ных полимера: гистоакрил (n бутил 2 цианакрилат) и букрилат (изобу тил 1 цианакрилат). К особенностям тканевых клеев относится их замед ленная полимеризация в физиологическом растворе в течение 20 секунд. При контакте с кровью полимеризация происходит немедленно, что требу ет строго интравазального введения препарата. Введение гистоакрила в кровоточащий варикозный узел обеспечивает эффективную остановку кровотечения, так как образующийся полимер, приобретая в просвете со суда твердую консистенцию в виде «слепка» вены, надежно прекращает в ней кровоток.
Из всех эндоскопических методов облитерация тканевыми клеями яв ляется технически наиболее сложной. При выполнении облитерации вели ка роль фактора времени в успехе лечения. Все манипуляции должны вы полняться быстро, что требует специальной подготовки персонала.
Гистоакрил вводят строго интравазально проксимальнее участка раз рыва. Если нет уверенности в интравазальном положении иглы, следует вначале инъецировать физиологический раствор (при паравазальном вве дении происходит отек слизистой). Заполненный варикозный узел харак теризуется истечением гистоакрила из места разрыва. При больших раз мерах вариксов требуется большее количество препарата для остановки кровотечения (иногда 2 мл в пищеводе и 3–4 мл в желудке). N. Soehendra и соавт. (1997) рекомендуют при проведении облитерирующего лечения смешивать гистоакрил с 0,5–0,8 мл с липиодолом с целью предупрежде
443

Hepato_2003_Last_With_Index.qxd 10.02.2003 18:39 Page 444
РУКОВОДСТВО ПО ХИРУРГИИ ПЕЧЕНИ И ЖЕЛЧЕВЫВОДЯЩИХ ПУТЕЙ
ния быстрого затвердевания препарата и последующего рентгенологиче ского контроля.
Использование интравазального введения клеевых композиций по зволяет добиться гемостаза в 90–100% случаев. В связи с технической сложностью данного метода, которая определяется необходимостью обя зательной чёткой визуализацией источника геморрагии и строгого интра вазального введения препарата, использование клеевых композиций при любом кровотечении из варикозно расширенных вен пищевода и желудка нецелесообразно. Рационально использование цианакрилатов для оста новки кровотечения из варикозно расширенных вен желудка, когда стан дартные склерозанты мало эффективны, при массивных кровотечениях из вен пищевода, а также в случае ранних рецидивов кровотечений.
Преимущества метода утрачиваются при длительном лечении фле бэктазий пищевода. Результаты изолированного использования тканевых клеев для достижения долговременной программы эрадикации варикозно расширенных вен показали высокую частоту рецидивов, достигающую 47%. Вероятно, особенность строго интравазального введения гистоакри ла, отсутствие паравазального компонента и трудность облитерации ва риксов диаметром менее 3 мм являются причиной недостаточной эффек тивности цианакрилатов в профилактике рецидивов кровотечений.
Поздние кровотечения чаще всего связаны с образованием венозных дефектов в результате пролабирования полимерных «слепков» через их стенку в просвет желудочно кишечного тракта. Процесс заживления де фектов слизистой и язв пищевода после отхождения полимера завершает ся в конце 2 го месяца. С целью нивелирования недостатков облитерации вариксов тканевыми клеями рациональным является одновременное ис пользование стандартных склерозантов, то есть комбинированное лечение.
Динамика эндоскопической картины после эндоскопического лечения. Ранние эндоскопические признаки химически индуцированного асептического воспаления слизистой и подслизистого слоя пищевода после эндоскопической склеротерапии заключаются в изменении цвета варикоз ной венозной стенки с синеватого на белый, уменьшении количества и протяженности «красных маркеров», появлении белесоватого оттенка слизистой на участке склерозирования. Эти проявления соответствуют периоду отека поверхностных слоев пищевода и стенки вариксов с редук цией кровотока по ним. В течение следующего месяца, когда воспалительная инфильтрация сменяется развитием и прогрессированием склеротическо го процесса, узловатая форма вен трансформируется в извитую с умень шением их диаметра и степени выбухания в просвет. В меньшей степени уменьшается протяженность вен вдоль пищевода, практически полностью
444

Hepato_2003_Last_With_Index.qxd 10.02.2003 18:39 Page 445
X. ЦИРРОЗ ПЕЧЕНИ И ПОРТАЛЬНАЯ ГИПЕРТЕНЗИЯ
исчезают красные маркеры стенки. Максимальной выраженности лечеб ный эффект достигает через 2–3 месяца.
Эволюция эндоскопической картины после лигирования отличается, как по темпам развития, так и по характеру изменений. Непосредственно после наложения лигатур на варикозно расширенные вены последние спа даются выше уровня лигирования. На этом фоне определяются полипо видные участки тромбированных лигированных вен с затянутой петлей на основании. В течение 1–4 х суток происходит некроз зон странгуляции с последующим отторжением некротических масс и формированием на этом месте поверхностных язв. Отличительная особенность этих язв в том, что их дно не достигает мышечного слоя стенки пищевода, что способствует быстрому (обычно в течение 10–14 дней) рубцеванию без сужения про света пищевода. Лигатуры отторгаются в среднем в течение 7–12 дней. С использованием сеансов эндоскопического лигирования удается бы стрее добиться устранения основных эндоскопических факторов риска ра звития гастроэзофагеальных кровотечений.
Осложнения эндоскопической склеротерапии возникают при близительно в 20% случаев. Более чем у половины больных наблюдаются дисфагия, загрудинные боли, субфебрильная лихорадка. Все эти симптомы слабо выражены и разрешаются в течение нескольких дней. Поверхност ные некрозы слизистой возникают приблизительно в 30–80%, глубокие язвы — в 3–10%. В 2–13% случаев эти изменения могут привести к развитию кровотечения. Частота развития стриктуры пищевода составляет от 2% до 10%.
Наиболее тяжелым ранним осложнением склеротерапии является формирование глубоких некрозов стенки пищевода с последующим крово течением, перфорацией или пенетрацией в средостение и развитием меди астинита. Подобные повреждения стенки являются следствием глубокого введения большого объема склерозанта в мышечный слой. Другие источ ники ошибок — погрешности иглы (слишком длинная или слишком тол стая) и большое количество, а также высокая концентрация склерозирую щего вещества. В последние годы частота подобных осложнений уменьши лась, в результате совершенствования методики склеротерапии.
При проведении эндоскопического лигирования осложнения встречаются значительно реже. Поверхностные язвы возникают на месте отторгнувшихся некротизированных участков лигированных вен на 5–7 день после лечения. Образующиеся язвы более поверхностные, по сравнению с таковыми после эндоскопической склеротерапии, они быстрее эпителизируются (в среднем в течение 14 дней) не оставляя рубцовых изменений. Частота развития кровоте чений из индуцированных лигированием язв составляет от 0 до 8%. Также как
445

Hepato_2003_Last_With_Index.qxd 10.02.2003 18:39 Page 446
РУКОВОДСТВО ПО ХИРУРГИИ ПЕЧЕНИ И ЖЕЛЧЕВЫВОДЯЩИХ ПУТЕЙ
и при проведении склеротерапии, в первые дни после лечения пациентов мо гут беспокоить ретростернальные боли, транзиторная субфебрильная лихо радка и дисфагия. Однако, выраженность этих симптомов незначительна.
Частота развития осложнений при применении цианакрилатов соста вляет около 10%. Среди местных осложнений эндоскопического лечения флебэктазий пищевода наиболее часто встречаются стеноз — от 4 до 13% и язва пищевода — до 33%. При использовании гистоакрила возможно развитие тромбоэмболии лёгочной артерии. В качестве грозного осложне ния при применении цианокрилатов в смеси с липиодолом возможно ра звитие инсульта, которые обусловлены попаданием полимерных частиц тканевого клея в систему церебральных артерий: в присутствии липиодола время полимеризации цианакрилатов удлиняется, что и может послужить причиной миграции элементов препарата по сосудистому руслу.
Одним из факторов, сдерживающих применение полимеров в медици не, является мнение об их возможном канцерогенном действии. Однако, длительное цитотоксическое действие данных полимеров исключено, по скольку через короткое время цианакрилатные «препараты вен» отторга ются в просвет желудочно кишечного тракта.
Хирургическое лечение
По основной патогенетической направленности выделяют операции портосистемного шунтирования и портоазигального разобщения.
Снижение портального давления методом портосистемного шунтиро вания устраняет один из решающих патогенетических факторов возникно вения кровотечений из варикозно расширенных вен пищевода и желудка. Применение сосудистых портосистемных шунтов в клинической практике выдвинуло целый ряд проблем. Операционная травма зачастую становит ся непереносимой для большинства декомпенсированных больных цирро зом печени. Синдром портосистемной энцефалопатии возникает у 5–52 % оперированных больных. После портосистемного шунтирования снижа ются процессы регенерации печени. В выборе типа шунта существуют своеобразные «ножницы»: чем больше диаметр шунта, тем выраженнее декомпрессивный эффект вмешательства, но при этом выше послеопера ционная летальность, чаще возникает энцефалопатия, меньше продолжи тельность и ниже качество жизни пациентов. И наоборот, малый диаметр шунта сопровождается меньшими летальностью, энцефалопатией, уме ренным угнетением печеночной регенерации, но при этом часто оказыва ется неэффективным в снижении портального давления. Ряд исследовате лей находят, что практически любой тип сосудистых портосистемных ана
446

Hepato_2003_Last_With_Index.qxd 10.02.2003 18:39 Page 447
X. ЦИРРОЗ ПЕЧЕНИ И ПОРТАЛЬНАЯ ГИПЕРТЕНЗИЯ
стомозов способствует прогрессированию дистрофических процессов в печени и часто осложняется развитием печёночной энцефалопатии. Глав ный недостаток портосистемных анастомозов связан с существенным сни жением портальной перфузии печени и увеличением объема шунтирую щейся крови.
Патогенетически обоснованным при циррозе печени является селектив ное дренирование гастролиенальной зоны. При этом преследуются цели как декомпрессии кардиоэзофагеальной зоны, так и сохранения незначительной гипертензии в системе воротной вены, обеспечивающей поддержание пор тальной перфузии. Одним из вариантов селективного портосистемного шун тирования, отвечающего отмеченным условиям, является дистальный спле норенальный анастомоз по Warren. Недосток дистального спленоренального шунтирования связан с риском травмы поджелудочной железы.
Возлагавшиеся на начальном этапе надежды на селективные шунты с целью неполной декомпрессии портального кровотока и сохранением пер фузии печени не оправдались. Исследования показали, что изначально селективные они достаточно быстро по своим гемодинамическим параме трам приближаются к неселективным портосистемным анастомозам.
В настоящее время больше внимание уделяется не селективности шунтирования, а степени портальной декомпрессии. Доминирующую пози цию занимает концепция парциальной (дозированной, частичной) порталь ной декомпрессии. Оптимальным считается диаметр анастомоза 6–8 мм. При этом существенно снижается риск кровотечения, а снижение функции печени и усугбление портосистемной энцефалопатии не выражены.
Процедура чрезъяремного внутрипеченочного портосистемного шун тирования является одной из последних новаторских технологий, позво ляющей выполнить эффективную декомпрессию портальной системы. В англоязычной научной литературе для обозначения этого вмешательства стало общепринятым использовать аббревиатуру TIPS (Transjugular in trahepatic portosystemic shunt).
Идея создания портальной декомпрессии путем чрескожного формиро вания внутрипеченочного соустья между крупными печёночными и воротной венами впервые была сформулирована и осуществлена в эксперименте J. Rosch (1969). Разработка компактных металлических сосудистых эндо протезов в конце 80 х годов позволила вывести процедуру TIPS на клини ческую сцену и обеспечила техническую основу успешного формирования венозно портальной фистулы в паренхиме печени. Первое клиническое ис пользование процедуры было выполнено G. Richter и соавт. (1990). Начи ная с этого времени началось повсеместное внедрение методики TIPS в клиническую практику.
447

Hepato_2003_Last_With_Index.qxd 10.02.2003 18:39 Page 448
РУКОВОДСТВО ПО ХИРУРГИИ ПЕЧЕНИ И ЖЕЛЧЕВЫВОДЯЩИХ ПУТЕЙ
«Технический успех» TIPS (т. е. успешное вмешательство и выжива емость пациентов в течение 30 дней) достигает высоких значений и соста вляет 93–100%. Отсутствие рецидива кровотечения в течение 1 месяца наблюдается в 83% случаев [Richter G., Roeren T., 1995]. Смертность свя занная с проведением вмешательства составляет 0–3 % и в значительной степени зависит от исходного состояния пациентов. Летальность выше при выполнении вмешательства в экстренном порядке. Наибольшее число осложнений отмечается среди пациентов Child С и при наличии асцита, свидетельствующего о декомпенсированной функции печени. Основными причинами летальности в течение первых 30 дней является полиорганная недостаточность и кровотечение в случае тромбоза шунта. Частота реци дива кровотечения и возникновения энцефалопатии сравнимы с результа тами операций портосистемного шунтирования.
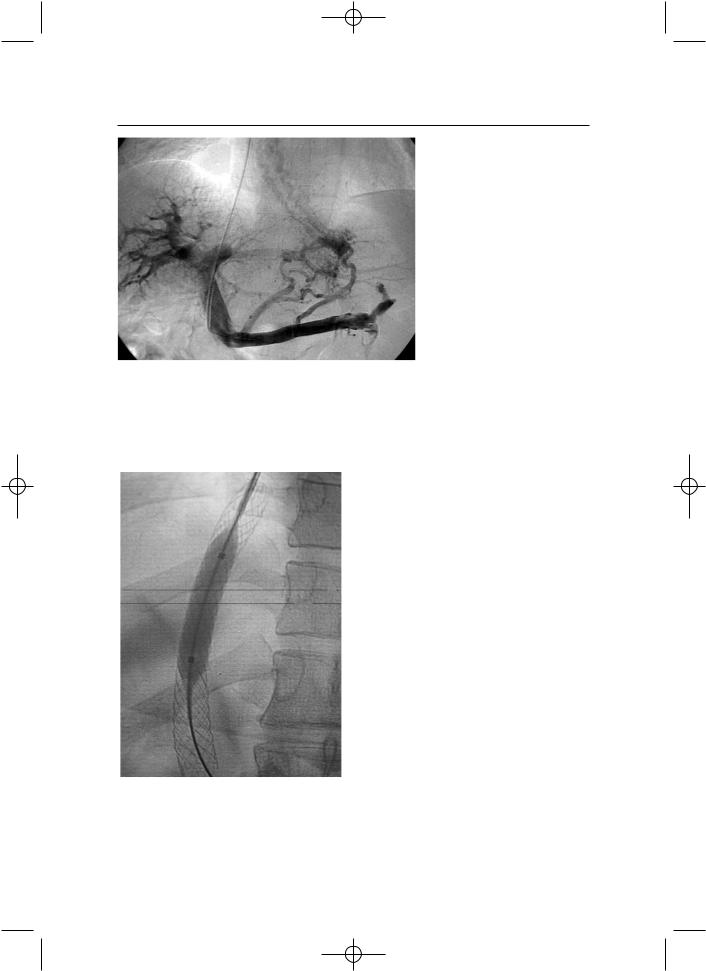
На рис.6.5 представлен этап процедуры TIPS. В связи с относительно высокой частотой внутрипеченочного шунта к стенозированию необходим более тщательный послеоперационный мониторинг с использованием цветного дуплексного исследования (рис. 10.5.).
У 90–95% пациентов со стенозом (рис. 10.6) или обтурацией шунта возможно выполнение баллонной дилатации (рис. 10.7, 10.8). При про грессирующем ухудшении функции печени и рефрактерной к консерватив ной терапии энцефалопатии можно обтурировать шунт и перейти к друго му методу лечения.
Наряду с очевидными положительным сторонами данного вмеша тельства остаются многочисленные нерешенные проблемы. Среди них высокая склонность внутрипеченочных шунтов к стенозированию и обли терации — до 20–30% в год, а по данным M. Ros sle (1997) частота подоб ного осложнения достига ет 50%. Не оправдались надежды на эффективное решение проблемы лече ния асцитических форм заболевания. В результате TIPS, как и других шунти рующих операций, ухуд шается гиперкинетиче
Рис. 6.5 Этап формирования внутрипеченочного |
ский циркуляторный статус |
|
портосистемного шунта (ТIPS). Визуализируется |
и снижается портальная |
|
расширенная левая желудочная вена с заполнением |
||
синусоидальная перфу |
||
расширенных вен пищевода |
||
(оператор — д.м.н. В.К. Рыжков) |
зия. |
448

Hepato_2003_Last_With_Index.qxd 10.02.2003 18:39 Page 449
X. ЦИРРОЗ ПЕЧЕНИ И ПОРТАЛЬНАЯ ГИПЕРТЕНЗИЯ
Параллельно с модификацией шунтирующих операций в хирургии портальной гипертензии распространились оперативные вмешательства, имеющие принципиально другую направленность — операции портоази гального разобщения. Основными преимуществами последних являются сохранение портальной перфузии печени, отсутствие усугубления порто системной энцефалопатии и сохранение исходной анатомии элементов портального бассейна, что сохраняет благоприятные условия для после дующей трансплантации.
В соответствии с направленностью основного оперативного приема различают операции пересечения реанастомоза (транссекция) и деваску ляризации (деконгестии) пищевода или желудка.
Взависимости от доступа различают следующие виды вмешательств:
—трансабдоминальные: портоазигальная дисконнекция по Tanner, гастроэзофагеальная деконгестия по Hassab (со спленэктомией), эзофагогастральная деваскуляризация с селективной прокси мальной ваготомией и фундопликацией;
—трансторакальные: трансторакальное прошивание вариксов по Boerema–Crile, по Nissen–Rapant, трансторакальная субмукоз ная транссекция пищевода по Walker–Stelzner;
—комбинированные вмешательства: обширная деваскуляризация ди стального отдела пищевода и проксимального отдела желудка в со четании транссекцией пищевода, ваготомией и пилоропластикой со спленэктомией (операция Sugiura–Futagawa).
Эффективность опе раций разобщения в от ношении частоты рециди вов кровотечений зависит от обширности оператив ного вмешательства. При выполнении операции в объёме транссекции пи щевода частота повтор ных геморрагий остаётся достаточно высокой. Бо лее обнадёживающие ре зультаты получены при включении в оператив ный прием элементов де васкуляризации пищево да и желудка. K. J. Paquet
Рис. 6.6 Пациент Ф. Допплерография внутрипеченочного портосистемного шунта (ТIPS). 80% окклюзия шунта
449
Hepato_2003_Last_With_Index.qxd 10.02.2003 18:39 Page 450
РУКОВОДСТВО ПО ХИРУРГИИ ПЕЧЕНИ И ЖЕЛЧЕВЫВОДЯЩИХ ПУТЕЙ
|
|
и A. Lasar (1995) реко |
||
|
|
мендуют всегда сочетать |
||
|
|
транссекцию с операциями |
||
|
|
деваскуляризации, счи |
||
|
|
тая, что только в резуль |
||
|
|
тате обширного разобщения |
||
|
|
может быть значительно |
||
|
|
снижен риск кровотече |
||
|
|
ния. Наименьшая частота |
||
|
|
рецидивов геморрагии на |
||
|
|
блюдается при обширной |
||
|
|
деваскуляризации дисталь |
||
|
|
ного отдела пищевода и |
||
Рис. 6.7 Пациент Ф. Портограмма через 4 мес. |
проксимального |
отдела |
||
желудка в сочетании с |
||||
после формирования внутрипеченочного портосистем: |
||||
ного шунта (ТIPS). 80% окклюзия шунта. |
транссекцией пищевода, |
|||
Окклюзия шунта улучшила контрастирование |
ваготомией и пилоропла |
|||
внутрипечечных разветвлений воротной вены |
стикой со спленэктомией |
|||
(оператор — д.м.н. В.К.Рыжков) |
||||
(операция Sugiura Futa |
||||
|
|
|||
|
gawa). В 1984 году M. Sugiura сооб |
|||
|
щил о результатах подобных опера |
|||
|
ций у 636 пациентов с циррозом пече |
|||
|
ни. Частота рецидива кровотечения в |
|||
|
течение 15 лет составила 6% , при |
|||
|
чем 185 пациентам из 636 операция |
|||
|
выполнялась с целью первичной про |
|||
|
филактики. Однако при операции Su |
|||
|
giura–Futagawa отмечена |
низкая |
||
|
послеоперационная летальность и |
|||
|
высокая выживаемость как после эк |
|||
|
стренных, так и после плановых опе |
|||
|
раций лишь при их исполнении руками |
|||
|
авторов. |
|
|
|
|
Новым этапом в хирургическом |
|||
|
лечении пищеводно желудочных кро |
|||
|
вотечений при портальной гипертен |
|||
|
зии явилось использование сшиваю |
|||
Рис. 6.8 Пациент Ф. Баллонная |
щих аппаратов, которые позволили |
|||
вывести традиционный хирургический |
||||
дилатация стеноза внутрипеченочного |
||||
портосистемного шунта |
прием на новый технологический уро |
|||
(оператор — д.м.н. В.К.Рыжков) |
вень. Операция предполагает транс |
|||
|
||||
450
