
- •Группы риска по развитию рахита.
- •Лекарственные препараты витамина д:
- •Рекомендации по дозам холекальциферола для профилактики гиповитаминоза д
- •Патогенез
- •Клиника
- •Диагностика
- •Лечение
- •3.Гипервитаминоз д. Причины. Патогенез. Клинические формы. Диагностика. Дифференциальная диагностика. Лечение. Осложнения
- •Этиология
- •Патогенез
- •Клиника
- •Диагностика
- •Дифференциальный диагноз
- •Лечение
- •Осложнения и исход
- •4.Атопический дерматит. Этиология. Патогенез. Клиника. Диагностика. Дифференциальный диагноз. Современные принципы терапии. Исходы. Атопический дерматит
- •Этиология
- •Патогенез
- •Диагностика
- •Дифференциальная диагностика
- •Лечение
- •5.Токсикоз у детей раннего возраста. Этиология. Патогенез. Клиника. Диагностика. Дифференциальный диагноз. Современные принципы терапии. Исходы
- •7.Хронические расстройства питания. Питания (гипотрофия, паратрофия, гипостатура). Классификация. Этиология. Патогенез. Клиника. Диагностика. Лечение хронические расстройства питания
- •Этиология
- •Классификация хронических расстройств питания у детей раннего возраста (г. И.Зайцева, л. А. Строганова, 1981):
- •Основные клинические проявления гипотрофии у детей раннего возраста
- •Этиология
- •Патогенез
- •Клинические проявления
- •Диагноз и дифференциальный диагноз
- •Диагностика
- •Принципы диетотерапии у больных гипотрофией в период выяснения толерантности к пище
- •8.Железодефицитная анемия у детей раннего возраста. Этиология. Патогенез. Классификация. Клиника. Диагностика. Дифференциальная диагностика. Лечение. Профилактика железодефицитная анемия
- •Этиология
- •Патогенез
- •9.Острые пневмонии у детей раннего возраста. Этиология. Патогенез. Классификация. Клинические проявления пневмоний различных форм. Диагностика. Лечение. Осложнения
- •Типичные ошибки
- •10. Деструктивная пневмония у детей раннего возраста. Этиология. Клиника. Особенности клинического течения и диагностики в зависимости от этиологии пневмонии. Диагностика. Лечение
- •Лечение:
- •11. Острый бронхит у детей раннего возраста. Этиология. Патогенез. Классификация. Особенности проявлений в зависимости от клинических форм. Диагностика. Лечение
- •Этиология
- •Классификация впс
- •Диагностика впс
- •Критерии степени тяжести ба
- •Дифференциальная диагностика ба и обструктивного бронхита у детей раннего возраста
- •Этиология
- •Патогенез
- •Клиническая картина
- •Диагностика
- •Лечение
- •18.Хронические гастриты и гастродуодениты: классификация, этиология, патогенез. Клиника, диагностика, лечение. Диспансерное наблюдение. Хронический гастрит, гастродуоденит
- •20.Острый и хронический гломерулонефрит: этиология, патогенез, классификация. Клинические проявления различных форм. Дифференциальная диагностика. Принципы лечения различных форм.
- •21. Острый пиелонефрит: этиология, патогенез, классификация. Особенности клинической картины у детей различного возраста. Диагностика. Принципы лечения
- •Классификация пиелонефрита у детей (м.Я. Студеникин и соавт., 1980 г. С дополнениями в.Г. Майданника и соавт., 2002)
- •26.Врождённая дисфункция коры надпочечников (адреногенитальный синдром). Классификация. Клиника вирильной и сольтеряющей форм. Дифференциальный диагноз. Неонатальный скрининг. Лечение и профилактика.
- •Жалобы и анамнез
- •Физикальное обследование
- •Лабораторная диагностика
- •3.3Терапия радиоактивным йодом
- •4. Узловой/многоузловой зоб, диагностика у взрослых и детей
- •5. Узловой/многоузловой зоб, лечение у взрослых и детей
- •28.Тиреоидные гормоны их физиологическая роль в различные периоды онтогенеза. Симптомы гипо – и гипертиреоза у детей.
- •29.Диффузный токсический зоб у детей и подростков. Этиология. Патогенез. Клинические синдромы. Диагностика. Лечение. Диспансерное наблюдение.
- •4.Лечение
- •30.Гипотиреоз у детей и подростков. Классификация, патогенез первичного и вторичного гипотиреоза. Клинические синдромы. Лечение и профилактика. Критерии эффективности лечения гипотиреоза.
- •31.Врожденный гипотиреоз. Группа риска. Клинические признаки в периоде новорожденности. Скрининг новорожденных. Критерии диагноза
- •II этап — медико-генетическая лаборатория
- •32.Определение понятия «ожирение». Классификация. Конституционально-экзогенное и гипоталамическое ожирение. Этиология. Клинические проявления. Дифференциальный диагноз. Лечение. Прогноз.
- •2. Диагностика
- •2.4 Инструментальная диагностика
- •33.Критерии оценки физического развития. Нарушение роста у детей. Гипофизарный нанизм. Гигантизм. Низкорослость. Дифференциальный диагноз. Лечение. Прогноз.
- •35. Хроническая недостаточность коры надпочечников. Этиология. Патогенез, клиническая картина. Неотложная помощь. Лечение. Прогноз.
- •36. Болезнь и синдром Иценко-Кушинга. Определение. Этиология. Клиническая картина. Осложнения. Диагностика. Дифференциальный диагноз. Лечение.
Дифференциальная диагностика ба и обструктивного бронхита у детей раннего возраста
Признаки |
Бронхиальная астма |
Обструктивный бронхит |
Возраст первых проявлений |
Чаще у детей старше 1 года |
Первый год жизни |
Появление бронхообструктивного синдрома |
С 1-го дня ОРВИ |
На 3-й день ОРВИ и позднее |
Эффект бронхолитической терапии
|
Высокий |
Умеренный |
Повторяемость бронхообструктивного синдрома |
3 и более эпизодов в год |
Менее 3 эпизодов |
Наследственная отягощенность по аллергическим заболеваниям |
имеется |
Нет |
Наличие в анамнезе у ребенка других аллергических заболеваний (атопический дерматит, аллергический ринит) |
имеется |
Нет |
Наличие катаральных явлений |
возможно |
Всегда |
При инородных телах в дыхательных путях обычно отмечают четкое время начала ухудшения в состоянии ребенка, проявляющееся приступом сухого мучительного кашля. Очень важно расспросить о связи приступа кашля с возможностью вдыхания ребенком мелких предметов, нередко аспирация происходит во время приема пищи. Для инородного тела характерна локальность физикальных изменений в легких.
Лечение бронхиальной астмы
Элиминационные мероприятия
Согласно современным представлениям элиминационные мероприятия должны быть индивидуальными для каждого больного, направленными на уменьшение действия бытовых, клещевых аллергенов, аллергенов домашних животных. Необходимо из комнаты убрать мягкую мебель, ковры; перьевую подушку заменить на синтетическую, ежедневно проводить влажную уборку. Хорошие результаты дает использование комнатных гипоаллергенных очистителей воздуха. В квартире не должны содержаться домашние животные. Следует соблюдать гипоаллергенную диету.
Основное лечение бронхиальной астмы заключается в назначении базисной противовоспалительной терапии, под которой понимают регулярное длительное применение препаратов, купирующих воспаление в слизистой оболочке дыхательных путей. Объем базисной терапии определяется тяжестью и уровнем контроля бронхиальной астмы, возрастом больных детей, характером сопутствующей патологии и корригируется в зависимости от достигаемого эффекта.
Средства базисной терапии
Ингаляционные глюкокортикостероиды (ИГКС) в настоящее время являются наиболее эффективными противовоспалительными препаратами для лечения БА и могут назначаться с 6 мес. жизни. Уменьшение воспаления под действием ИГКС в слизистой оболочке бронхов сопровождается уменьшением их гиперреактивности, снижением частоты обострений БА, способствует достижению ремиссии.
Современные ИГКС (фликсотид, беклазон ЭКО, альвеско, пульмикорт) отличаются по биодоступности и активности, оказывают минимальное общее воздействие. Начальная доза ИГКС назначается соответственно с тяжестью заболевания, доза каждые 3 месяца пересматривается и снижается до минимальной поддерживающей.
Антагонисты лейкотриеновых рецепторов представлены антагонистами рецепторов цистеиниловых лейкотриенов I субтипа (монтелукаст). Они обладают противовоспалительным действием с небольшим бронхолитическим эффектом, тем самым снижают частоту обострений, улучшают функцию легких. Используются как монотерапия при легкой БА, в комбинации с другими видами базисной терапии – при более тяжелых формах заболевания. Не рекомендуется резкая замена терапии ИГКС антагонистами лейкотриеновых рецепторов. В РФ зарегистрирован монтелукаст (сингуляр, синглон) 4 мг у детей 2-5 лет, 5 мг у детей 6-14 лет, 10 мг у детей 15 лет и старше, таблетка принимается один раз в сутки.
Ингаляционные β2-агонисты длительного действия включают формотерол и сальметерол, продолжительность действия которых составляет 12 часов. Их фармакологическое действие связано со способностью расслаблять гладкую мускулатуру бронхов, усиливать мукоцилирный транспорт. При длительном применении отмечается небольшое противовоспалительное действие вследствие снижения сосудистой проницаемости, уменьшения выделения медиаторов из тучных клеток и базофилов, также некоторое снижение бронхиальной гиперреактивности, но недостаточное, чтобы использовать их в качестве монотерапии. Применение β2-агонистов длительного действия в качестве монотерапии противопоказано (!), поэтому наиболее эффективно в качестве базисной терапии использование их комбинации с ИГКС. В настоящее время разработаны комбинированные препараты (будесонид+ формотерол=симбикорт, форадил комби; флутиказонпропионат+салметерол =серетид), применение которых у детей предпочтительно, так как исключает возможность изолированной отмены ИГКС.
Также ранее для купирования воспаления в бронхах использовали Кромоны (кромогликат натрия - интал, недокромил натрия –тайлед минт). В настоящее время препараты данной группы не применяются.
Системные глюкокортикостероиды, использование которых показано только при тяжелом обострении заболевания, в основном короткими курсами (3-5 дней). В этих случаях после достижения эффекта нет необходимости в постепенном снижении дозы как при пероральном, так и парентеральном применении.
Генноинженерные биологические препараты (ГИБП).
Антитела к Ig E - Ксолар (омализумаб) связывают свободно циркулирующие IgE и предотвращают их взаимодействие с высоко аффинными рецепторами на поверхности тучных клеток и базофилов. Тем самым снижается уровень свободного IgE, который является пусковым фактором каскада аллергических реакций. Омализумаб (ксолар) применяется у детей старше шести лет с персистирующей атопической среднетяжелой и тяжелой БА, симптомы которой недостаточно контролируются применением ИГКС. Назначается в виде регулярных подкожных инъекций 1или 2 раза в месяц в зависимости от уровня общего IgE и массы тела пациента.
Аллергенспецифическая иммунотерапия (АСИТ) находит широкое применение в комплексном лечении БА в фазу ремиссии заболевания. Данный метод позволяет вводить больному в возрастающих концентрациях причинно-значимый аллерген, ответственный за клинические появления. С помощью АСИТ формируется иммунологическая толерантность, снижается способность аллергена запускать аллергическую реакцию. Эффективность этого метода обусловлена снижением активности и пролиферации Т-лимфоцитов-хелперов и увеличением продукции блокирующих IgG-антител. Существуют различные методы АСИТ, отличающиеся по способу введения лечебного аллергена: подкожный, пероральный, сублингвальный. АСИТ проводится детям с доказанной IgE-зависимой БА и выявленной сенсибилизацией к определенным видам аллергенов. АСИТ можно проводить с 5-летнего возраста. После введения аллергена ребенок должен наблюдаться под наблюдением врача в течение 30 минут. Противопоказанием для проведения АСИТ является наличие обострения БА (ОФВ<80%), острые респираторные и другие инфекционные заболевания, сопутствующие заболевания в стадии декомпенсации (болезни почек, печени, сердца, сахарный диабет и др.) Продолжительность специфической иммунотерапии составляет 3 года.
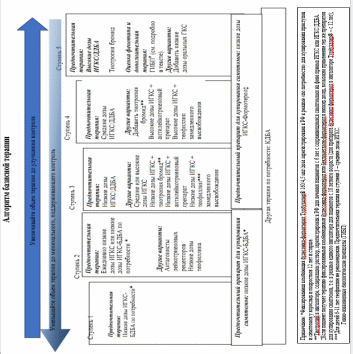
Характер проводимой базисной противовоспалительной терапии определяется тяжестью течения заболевания (см. Алгоритм базисной терапии).
Больные с легкой интермиттирующей бронхиальной астмой, как правило, не нуждаются в базисной терапии. В периоды обострения заболевания возможны короткие курсы антагонистов лейкотриеновых рецепторов (сингуляр).
При легком персистирующем течении назначают низкие дозы ингаляционных глюкокортикостероидов (100-200 мкг/сутки) или антагонисты лейкотриеновых рецепторов в виде монотерапии. Каждые 3 месяца объем базисной терапии пересматривается в зависимости от достигнутого эффекта. Детям раннего возраста препараты ингалируют с помощью специального устройства – спейсера, представляющего собой пластиковую колбу, в которую сначала впрыскивается препарат, а затем ребенок спокойно из неё дышит.
При среднетяжелом течении назначают ингаляционные глюкокортикостероиды в средних дозах (200 – 400 мкг/сутки), которые обладают мощной противовоспалительной активностью. Их противовоспалительный эффект связан со способностью ингибировать активность фосфолипазыА2, уменьшать синтез Т-лимфоцитами цитокинов, увеличивать экспрессию β-2-адренорепторов. Для лечения используются фликсотид, беклазон Эко, альвеско. Ингаляционные кортикостероиды не имеют серьезных побочных эффектов. Менее чем у 2% пациентов отмечается оральный кандидоз, профилактика которого заключается в использовании спейсера и полоскании рта водой после ингаляции.
Современные ингаляционные кортикостероиды оказывают минимальное общее воздействие, не получено достоверных данных об их депрессивном влиянии на гипоталамо-гипофизарно-надпочечниковую систему. При нестабильном состоянии больных к ингаляционным ГКС следует добавить β2-агонисты длительного действия – формотерол (форадил, атимос) или сальметерол (серевент). Оба препарата оказывают выраженный бронхорасширяющий эффект, сохраняющийся в течение 12 часов. Они также улучшают мукоцилиарный клиренс, снижают бронхиальную гиперреактивность. Форадил ингалируется по 12 мкг дважды в день. Начало действия форадила – 5 минут, поэтому он может использоваться и для купирования приступа удушья. В лечении бронхиальной астмы высокой эффективностью обладают комбинированные препараты, содержащие ингаляционный глюкокортикостероид и пролонгированный β2-агонист. Для лечения детей с бронхиальной астмой используются серетид (комбинация флутиказона и сальметерола) и симбикорт (комбинация будесонида и формотерола). Выпускаются эти препараты как в виде порошковых ингаляторов (серетид, симбикорт), так и в виде дозированных ингаляторов (серетид). Также возможно добавление в схему терапии антагонистов лейкотриеновых рецепторов (сингуляр) с целью контроля лейкотриенового пути развития воспаления. Сингуляр принимается внутрь 1 раз в день вечером по 4 мг (2-5 лет), или 5 мг (6-12 лет), или 10 мг (старше 12 лет).
При тяжелом течении используют ИГКС в высоких дозах от 600 мкг/сутки. В качестве стартовой терапии предпочтительны комбинированные препараты (серетид, симбикорт, форадил-комби). В лечение включают также антагонисты лейкотриеновых рецепторов.
При отсутствии стабильного состояния при тяжелой бронхиальной астме на фоне применения ИГКС в лечении детей старше 12 лет возможно использование антител к IgЕ (Ксолар).
Значительно реже для предупреждения развития приступов удушья используют теофиллины длительного действия. Теофиллин ингибирует активность фосфодиэстеразы, что приводит к повышению уровня цАМФ в тканях и расслаблению гладкой мускулатуры бронхов. Суточная доза пролонгированных теофиллинов (теотард) составляет 12—15 мг/кг массы тела в 2 приема.
Лечение в периоде обострения
Для купирования приступа удушья используют β2-агонисты короткого действия (сальбутамол, беротек, вентолин), антихолинергические препараты (ипратропия бромид – атровент), их комбинацию (β2-адреномиметик/ипратропия бромид - беродуал).
Короткодействующие β2-агонисты при ингаляционном применении дают быстрый, в течение 5 минут, бронхолитический эффект, сохраняющийся в течение 3-4 часов. Показаны они при нетяжелых приступах бронхиальной астмы. Ингалировать их лучше через небулайзер, так как этот прибор дробит лекарственные препараты до 4-5 микрон, тем самым способствуя их проникновению вплоть до бронхиол. При среднетяжелом и тяжелом обострении астмы лучшим средством ликвидации бронхоконстрикции является назначение комбинированного препарата (беродуал), который ингалируют через небулайзер каждые 20 минут в течение 1 часа в адекватной возрасту ребенка дозе:
- новорожденные и дети грудного возраста – 1 капля/кг массы тела, но не более 10 капель;
- до 6 лет (масса тела до 22 кг) 10 капель на 1 ингаляцию;
- старше 6 лет – 10-20 капель.
Также при среднетяжелом и тяжелом обострении в комплекс бронхолитической терапии включают ингаляционные кортикостероиды – будесонид суспензия (пульмикорт). Начальная доза суспензии пульмикорта составляет 0,5мг 2 раза в день.
Необходимо помнить, что общий объем физ. раствора вместе с лекарственными препаратами в стаканчике небулайзера должен быть не менее 4мл!
Больным с тяжелым приступом удушья дополнительно вводится эуфиллин внутривенно в виде 2,4% раствора в дозе 3—4 мг/кг и преднизолон 1-2 мг/кг массы тела.
Ингаляционные антихолинергические препараты (атровент) блокируют мускариновые рецепторы, обеспечивая бронходилатирующий эффект, развивающийся через 30—40 минут после ингаляции. Наиболее эффективны антихолинергические препараты при «влажной» астме, развивающейся на фоне ОРВИ, а также при психогенной зависимости. Их сочетание с β2-агонистами (беродуал) обеспечивает синергический эффект.
При тяжелом приступе удушья и астматическом статусе ребенку проводят оксигенотерапию через носовые катетеры, в течение часа каждые 20 минут делают по одной ингаляции сальбутамола или беротека через небулайзер, назначают регидратационную терапию.
При проведении инфузионной терапии используют изотонический раствор хлорида натрия и 5% раствор глюкозы (в соотношении 1:1) в дозе 10—20 мл/кг массы со скоростью 12—14 капель/минуту. В течение 15—20 минут вводят 2,4% раствор эуфиллина в дозе 5 мг/кг, в последующем эуфиллин вводится при непрерывной инфузии в дозе 1 мг/кг/час или дробно в суточной дозе 15—20 мг/кг. Одновременно назначают внутривенное введение преднизолона в дозе 2 мг/кг, половина дозы которого вводится струйно, а оставшаяся часть — капельно. Абсолютным показанием для назначения преднизолона перорально является II и III стадия астматического статуса. Назначается он в этом случае в дозе 1 мг/кг/сутки коротким курсом в течение 10 дней.
При сочетании бронхиальной астмы с атопическим дерматитом, пищевой аллергией, аллергическим ринитом в лечении используются антигистаминные препараты 2 поколения (зиртек, кларитин, эриус, рупафин). Они не проникают через гематоэнцефалический барьер, тем самым не оказывая седативного действия, им не свойственно явление тахифилаксии.
В фазе обострения заболевания в лечении также используются отхаркивающие и разжижающие мокроту средства (амброксол, ацетилцистеин, карбоцистеин).
Если на фоне базисной терапии БА у ребенка отмечаются ОРВИ такого больного необходимо вести согласно практическим рекомендациям по терапии бронхиальной обструкции (см. Таблицу).
Практические рекомендации по терапии бронхиальной обструкции и обострений бронхиальной астмы
Состояние |
Терапия обострения: препараты, доза, кратность применения |
Длительность терапии |
Удовлетворительное. Симптомы при нагрузке. SatO2 ≥ 95% |
β2-агонист КД в монотерапии или в комбинации с ипратропия бромидом; при необходимости будесонид суспензия 0,5 мг 2 раза в день |
5-7 дней, далее уменьшение дозы на 50% до разрешения симптомов |
Средней тяжести. Симптомы в покое, участие вспомогательной мускулатуры в дыхании, ретракция грудной клетки. ЧДД увеличена, ЧСС ≤ 200 уд/мин (у детей до 3 лет) или ≤180 уд/мин (у детей 4-5 лет). SatO2 ≤ 92% |
β2-агонист КД в монотерапии или в комбинации с ипратропия бромидом 3 раза в течение первого часа и далее по потребности. Будесонид суспензия 0,5 мг 2 раза в день (первые 2 ингаляции с интервалом 1 час). При положительной динамике (уменьшение одышки, ЧДД, нормализации сатурации) последующие ингаляции через 6-8 часов |
|
Тяжелое. Выраженные симптомы в покое, участие дополнительной мускулатуры в дыхании, ретракция грудной клетки. Трудности разговора. Цианоз. ЧДД – 150% нормы, ЧСС ˃ 200 уд/мин (у детей до 3 лет) или ˃ 180уд/мин (у детей 4-5 лет). SatO2 < 92% |
Госпитализация. β2-агонист КД в монотерапии или в комбинации с ипратропия бромидом( беродуал) 3 раза в течение первого часа и далее по потребности. Будесонид суспензия 1 мг 2 раза в день. По показаниям: системные глюкокортикостероиды (дексаметазон 0,15-0,6 мг/кг внутримышечно или преднизолон 2-5 мг/кг внутримышечно) |
До разрешения симптомов |
В фазе ремиссии заболевания достаточно эффективной является аллергенспецифическая иммунотерапия (АСИТ). Также может быть рекомендовано санаторно-курортное лечение на курортах Кавказских минеральных вод (Кисловодск), спелеотерапия.
Диспансеризация детей с бронхиальной астмой должна осуществляться участковым врачом-педиатром, а также детским аллергологом-иммунологом. Дети с бронхиальной астмой легкого и среднетяжелого течения осматриваются участковым педиатром один раз в квартал, а аллергологом 2 раза в год. При тяжелом течении участковый педиатр осматривает ребенка 1 раз в 2 месяца, а аллерголог 1 раз в квартал, ЛОР-врач и стоматолог консультируют ребенка 1—2 раза в году. Вакцинация проводится детям с бронхиальной астмой легкой и средней степени тяжести, а при тяжелом течении — только по строгим эпидемиологическим показаниям и только в стационаре. Иммунизации не подлежат дети при обострении заболевания.
16.Бронхоэктатическая болезнь и локальный пневмосклероз: этиология, предрасполагающие факторы, патоморфологические изменения и их варианты. Клинические проявления различных вариантов. Осложнения и исходы. Принципы лечения. Показания к хирургическому лечению
Бронхоэктазы представляют собой локализованное необратимое расширение бронхов, сопровождающееся воспалительными изменениями в бронхиальной стенке и окружающей паренхиме с развитием фиброза.
Бронхоэктатическая болезнь (БЭБ) – это заболевание, основным патоморфологическим субстратом которого является локальное расширение бронхов, сопровождающееся хроническим нагноительным процессом.
Локальный пневмосклероз – это склеротический процесс преимущественно дистальных отделов бронхов и перибронхиальных тканей в одном или нескольких сегментах, приводящий к рубцовому сморщиванию пораженного участка легочной ткани.
Этиология.
По характеру причин, ведущих к формированию БЭБ, выделяют
первичные и вторичные бронхоэктазы.
Этиология первичных бронхоэктазов:
- неблагоприятный исход острой пневмонии;
- аспирация инородного тела;
- хроническая аспирация пищи.
Этиология вторичных бронхоэктазов:
- пороки развития трахеобронхиального дерева;
- бронхолегочная дисплазия;
- первичная цилиарная дискинезия;
- первичные иммунодефицитные заболевания.
Наиболее часто причинами БЭБ являются вторичные факторы.
Видом и вирулентностью возбудителя в основном обусловлена тяжесть обострения уже имеющегося хронического заболевания. Чаще других в мокроте больных БЭБ обнаруживается гемофильная палочка (60-70%), гемолитический стрептококк, моракселла. Возможны смешанные варианты микрофлоры: вирусно-бактериальная, микоплазменно-бактериальная.
Патоморфология.
Морфологические изменения при БЭБ и локальном пневмосклерозе представляют собой совокупность локализованного хронического бронхита, бронхоэктазов ателектатического и эмфизематозного процесса, а также склеротических изменений в пораженной зоне легких с учетом преобладания того или иного процесса.
В свою очередь склеротические изменения легочной ткани также имеют три варианта:
I вариант — ателектатический пневмосклероз, при котором вся
Легочная ткань замещена склеротической со сдавлением всех компонентов сегмента (мелкие бронхи и сосуды).
II вариант — гипателектатический пневмосклероз, при котором отмечается
некоторая воздушность легочной ткани из-за участков чередования полного ателектаза с гипо - и дисателектатической тканью.
III вариант — дисателектатический пневмосклероз, при котором объем сегмента сохранен из-за преобладания в нем эмфизематозных альвеол.
Степень выраженности деформации бронхов варьирует от сужения или
умеренного расширения до различной формы бронхоэктазов. Сопутствующее поражение сосудистого русла заключается в перекалибровке сосудов, фиброзе интимы, замещении мышечного слоя эластической тканью.
Бронхоэктазы принято подразделять на цилиндрические, мешотчатые, смешанные. Описываются также кистовидные, веретенообразные и варикозные бронхоэктазы.
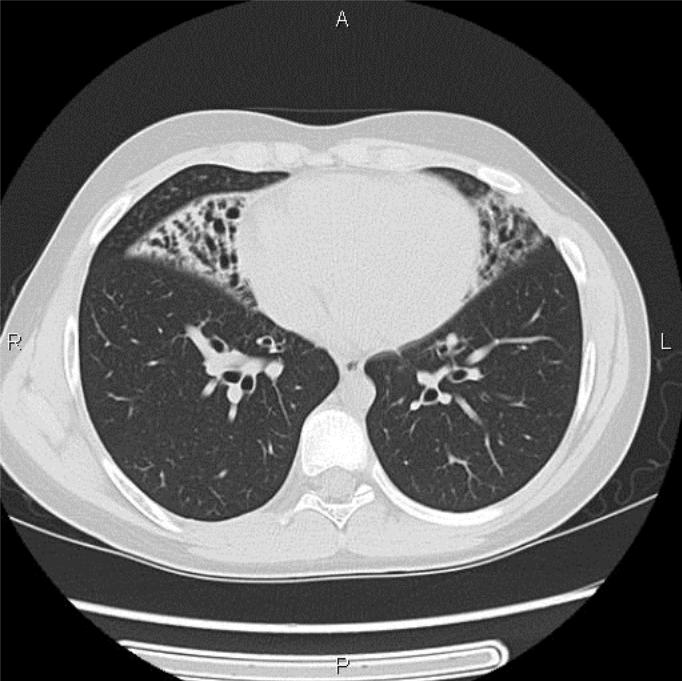
Рисунок. Цилиндрические бронхоэктазы.
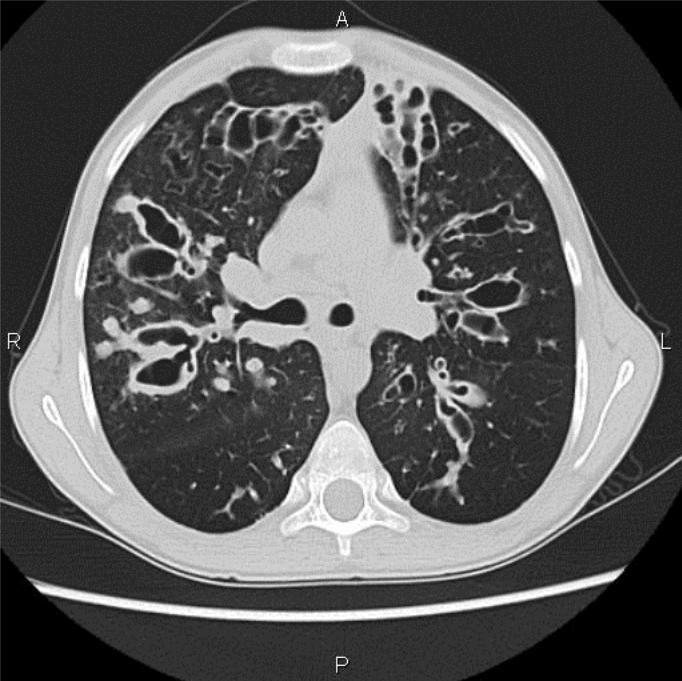
Рисунок. Мешотчатые бронхоэктазы.
Патогенез.
В патогенезе формирования пневмосклероза ведущую роль играют нарушения бронхиальной проходимости и ателектаз. Формирование БЭБ происходит во время текущего, затяжного сегментарного процесса, заканчивающегося развитием соединительной ткани в легком и деформацией бронхов, которые протекают параллельно. Основой патологии при БЭБ является бронхиальный процесс, протекающий в структурно измененных и функционально неполноценных бронхах. Воспалительный процесс, начавшись в слизистой оболочке бронхов, постепенно распространяется по продолжению. Прогрессирующее поражение бронхиального дерева характеризуется изменением секреторного аппарата слизистой оболочки, сопровождается гиперсекрецией и увеличением вязкости мокроты (дискринией). Изменение реологических свойств слизи в сочетании с поражением реснитчатого эпителия приводит к нарушению механизма очищения бронхов (мукоцилиарной недостаточности). Создавшиеся условия способствуют развитию патогенной флоры и распространению воспалительно-деструктивного процесса на более глубокие слои бронхиальной стенки (панбронхит). Пораженные участки мышечного, эластического и хрящевого слоев впоследствии замещаются рубцовой тканью. Нарушение бронхиальной проходимости, обусловленное перечисленными органическими и функциональными изменениями, способствует снижению аэрации в нижележащих отделах легких. Особенно быстро ателектатические изменения формируются на фоне врожденного или приобретенного снижения активности сурфактанта. Напротив, неполная обструкция бронхов мелкого калибра способствует уменьшению объемной скорости движения воздуха и во время вдоха, и во время выдоха, что приводит к увеличению остаточной емкости и развитию эмфиземы. Такое чередование гипо - и гипервентилируемых участков (асинхронная вентиляция) с различным внутриальвеолярным давлением является основой для коллатеральной вентиляции. Поступление воздуха с низким содержанием кислорода в гиповентилируемые участки из эмфизематозных через межальвеолярные ходы (поры Кона) является компенсаторным, но недостаточно совершенным механизмом.
Длительное воспаление в легочной ткани приводит к глубоким нарушениям иннервации, лимфо - и кровообращения, которые, в свою очередь, поддерживают и усугубляют склеротический процесс Перечисленные морфологические изменения в сочетании с нарушением мукоцилиарного клиренса резко изменяют функцию внешнего дыхания (изменение объемов вентиляции, легочных объемов, механики дыхания) первоначально без изменения газового состава крови. Одним из компенсаторных механизмов, обеспечивающих нормальный газовый состав крови на этом этапе, является повышение объема вентиляции и работы дыхания. Дальнейшее нарушение функции аппарата внешнего дыхания характеризуется развитием артериальной гипоксии, которая обусловлена снижением парциального давления кислорода в альвеолах, несоответствием вентиляции и кровотока, нарушением диффузии газов, шунтированием венозной крови в артериальное русло. При усугублении процесса в легких снижается также их выделительная способность, что приводит к накоплению в крови углекислого газа (гиперкапнии).
Вышеперечисленные изменения являются основой для нарушения функции многих органов и тканей и, прежде всего, сердечно-сосудистой системы. В патогенезе легочного сердца играют роль анатомические изменения (сужение легочных сосудов, фиброз их интимы вплоть до обтурации просвета) и функциональные факторы (альвеолярная гипоксия), на основе которых возникают стойкий спазм легочных артериол (рефлекс Эйлера — Лильестранда) и повышение сосудистого сопротивления в малом круге кровообращения. Поскольку при БЭБ величина легочного кровотока длительно остается неизменной, такая ситуация ведет к повышению давления в системе легочной артерии (легочная гипертензия) и перегрузке правых отделов сердца.
Клиническая картина БЭБ.
Клиника определяется характером и распространенностью бронхолегочного процесса, периодом заболевания, особенностью его течения, наличием осложнений.
Наиболее частой локализацией процесса является нижняя доля левого легкого. Реже изменения локализуются в нижней и средней доле правого легкого.
Ограниченный процесс характеризуются поражением от 1 до 3 сегментов. Течение заболевания чаще неосложненное, обострения не чаще 2—3 раз в год. Вне обострения дети мало отличаются от своих здоровых сверстников, удовлетворительно переносят физические нагрузки, признаки ДН и ССН отсутствуют. Только у 4-8% больных отмечается снижение уровня физического развития. Типичным симптомом является кашель с мокротой преимущественно по утрам. Мокрота выделяется в виде сгустков и почти всегда имеет неприятный запах. Постепенно кашель усиливается, а количество мокроты, приобретающей гнойный характер, увеличивается до 20-50 мл. При перкуссии над очагом поражения нередко определяется укорочение перкуторного звука. Аускультативно выслушиваются локальные мелко - и среднепузырчатые влажные хрипы.
При распространенном процессе (наличии бронхоэктазов более чем в 3 сегментах) заболевание приобретает тяжелое течение. Количество обострений при этой форме превышает 4 раза в год. В период обострения состояние больных расценивается как тяжелое или средней тяжести. Больные жалуются на недомогание, слабость, одышку в покое или при незначительной физической нагрузке. Всех пациентов беспокоит влажный кашель с большим количеством гнойной мокроты. При стоянии мокрота может разделяться на 3 слоя: верхний — пенистый, средний — жидкий светлый, прозрачный, нижний – гнойный. При осмотре больного отмечается снижение уровня физического развития, которое коррелирует с тяжестью процесса в легких. Грудная клетка нередко деформирована: килевидное выбухание грудины или ее западание, несимметричная грудная клетка с уплощением над зоной пневмосклероза. При тяжелом течении процесса отмечается классический симптом хронического бронхолегочного процесса – своеобразная деформация концевых фаланг пальцев (пальцы Гиппократа или «барабанные палочки») и формы ногтей («часовые стекла»). При перкуссии у большинства больных определяется «мозаичность» звука: чередование коробочного оттенка легочного звука с его притуплением. Наиболее типичная аускультативная симптоматика – локализованные стабильные влажные хрипы над очагами поражения, а при выраженных бронхоэктазах – наличие звонких, трескучих хрипов на фоне бронхиального дыхания. Такое сочетание звуковой симптоматики напоминает характерный «пулеметный» треск. Симптомы дыхательной недостаточности, как правило, достигают 1 или 2 степени. Нередко выявляются изменения со стороны других органов и систем и, в первую очередь, со стороны сердечно-сосудистой системы: расширение границ сердца вправо, тахикардия, приглушенность тонов сердца, акцент II тона над легочной артерией.
Течение.
Течение БЭБ характеризуется сменой обострений и ремиссий. Обострения могут протекать по пневмоническому типу, особенно у детей младшего возраста, и по бронхиальному типу. Регресс симптомов при пневмоническом типе обострения занимает 2-3 месяца, а при бронхиальном несколько короче – от 3 до 6 недель.
Исход заболевания.
Исход заболевания зависит от стадии процесса, правильности терапии и наличия осложнений. При адекватной и регулярной терапии у подавляющего большинства больных прогрессирование заболевания отсутствует.
Из осложнений в детском возрасте чаще других встречаются эмфизема легких и легочное сердце.
Эмфизема легких представляет собой анатомическую альтерацию легких, характеризующуюся патологическим расширением воздушных пространств, расположенных дистальнее терминальных бронхиол, и сопровождающуюся
деструктивными изменениями альвеолярных стенок. Наиболее характерными
клиническими проявлениями эмфиземы являются экспираторный тип одышки, коробочный оттенок легочного звука, уменьшение границ относительной сердечной тупости, низкое расположение и ограничение движения нижних границ легких. Аускультативно обычно выслушивается ослабленное дыхание с удлиненным выдохом. Рентгенологически выявляются, повышение прозрачности легочных полей, низкое расположение диафрагмы, «каплевидное сердце». Исследование функции внешнего дыхания выявляет снижение скоростных показателей (объема форсированного выдоха за 1 секунду, индекса Тиффно) и жизненной емкости легких, увеличение остаточной емкости легких.
Понятие «легочное сердце» включает в себя гипертрофию миокарда или дилатацию правого желудочка, легочную гипертензию, недостаточность кровообращения по правожелудочковому типу. Объективно при перкуссии определяют увеличение границ сердца преимущественно вправо, при аускультации обнаруживают усиление и расщепление II тона над легочной артерией. Рентгенологическими признаками легочной гипертензии являются выбухание ствола легочной артерии, усиление легочного рисунка и корней легкого при относительно светлой периферии. На ЭКГ отмечаются признаки гипертрофии миокарда правого желудочка, изменение зубца Р по типу «Р-рulmоnalе».
Диагностика БЭБ и локального пневмосклероза.
При обострении в крови отмечаются лейкоцитоз, нейтрофилез, увеличенная СОЭ. В биохимическом анализе крови выявляется гипопротеинемия, гипоальбуминемия, гипергаммаглобулинемия, увеличение фибриногена, уровня СРБ.
При микроскопии в мокроте находят лейкоциты, эритроциты, эластические волокна, кристаллы Шарко—Лейдена, фибриллы Куршмана, пробки Дитриха.
При рентгенографии органов грудной полости выявляют деформацию легочного рисунка и признаки локального пневмосклероза в виде сморщивания или уплотнения пораженных сегментов, возможно, со смещением органов средостения в сторону поражения, подъемом купола диафрагмы. При бронхоэктазах отмечаются своеобразные кольцевидные тени, мешотчатая форма бронхоэктазов характеризуется картиной «сотового легкого».
В настоящее время компьютерная томография (РКТ, СКТ) является основным методом диагностики БЭ, этот метод способен выявить все структурные изменения лёгочной паренхимы, перестройку сосудисто-бронхиальной архитектоники, оценить состояние лёгочной ткани вокруг измененных бронхов. Принято выделять прямые и косвенные признаки БЭ. К прямым относят расширение просвета бронхов, отсутствие нормального уменьшения диаметра бронхов по направлению к периферии, видимость просветов бронхов в кортикальных отделах лёгких (в норме мелкие бронхи не видны на расстоянии менее 1-2 см от плевры). Бронх считается расширенным, если его внутренний просвет значительно превышает диаметр сопутствующей ему парной ветви лёгочной артерии (симптом «перстня» или «кольца с камнем»). Косвенные признаки включают утолщение или неровность стенок бронхов, наличие мукоцеле, неравномерную воздушность лёгочной ткани в зоне расположения изменённых бронхов.
С помощью КТ можно установить или предположить этиологию бронхоэктазов. Например, диагностировать врожденные пороки развития бронхов. Помимо КТ, в последнее время появились данные о достаточно высокой информативности в диагностике БЭ магнитно-резонансной томографии.
Важным в диагностике БЭБ является трахеобронхоскопия, которая показана всем больным, как с целью диагностики, так и с лечебной целью. Этот метод может быть использован и в периоде обострения, и в периоде ремиссии. Помимо визуальной оценки состояния слизистой бронха можно получить различный материал для исследования (секрет, биоптат слизистой оболочки бронха, мазки-отпечатки со слизистой оболочки) для патоморфологического, бактериологического и иммунологического исследования.
Сведения о состоянии функции внешнего дыхания получают при спирометрии. Спирометрия позволяет оценить легочную вентиляцию (ритм, частота дыхания, минутный объем дыхания), изучить величину дыхательных объемов (резервный объем вдоха и выдоха, остаточный объем, жизненная емкость легких), а также оценить механику дыхания, о которой судят по величине бронхиального сопротивления, объемной скорости вдоха и выдоха, максимальной вентиляции легких. У 70% детей отмечается вентиляционная
недостаточность (ВН), чаще по рестриктивному или смешанному типу.
Дифференциальный диагноз.
Наиболее частые нозологические формы для дифференциального диагноза при бронхоэктазах: инородное тело бронха (КТ, трахеобронхоскопия); врожденные аномалии бронхиального дерева (КТ, трахеобронхоскопия); муковисцидоз (потовый тест, эластаза кала, молекулярно-генетическое исследование, микробиологическое исследование мокроты с определением чувствительности к антибактериальным препаратам); туберкулезная инфекция (консультация фтизиатра, проба Манту, при необходимости – тест с аллергеном туберкулезным рекомбинантным в стандартном разведении, диаскин тест, квантифероновый тест, T-spot); первичное иммунодефицитное состояние (необходима консультация аллерголога-иммунолога, определение уровней иммуноглобулинов основных классов (G, M, A, Е), а также, по показаниям, субклассов иммуноглобулинов, уровня и функции T клеток, В клеток, фагоцитоза, компонентов комплемента, естественных киллеров, тесты на ВИЧ; первичная цилиарная дискинезия – характерные клинические проявления (триада Картагенера у половины больных ПЦД: хронический бронхит, хронический синусит, обратное расположение внутренних органов) световая и электронная микроскопия биоптата слизистой оболочки носа и/или бронха, как скрининг-метод может быть использовано исследование уровня оксида азота в выдыхаемом назальном воздухе (у большинства пациентов с первичной цилиарной дискинезией он снижен); аспирационные процессы (аускультация до и после кормления; консультация гастроэнтеролога, а также трахеобронхоскопия и эзофагогастродуоденоскопия с красителем); аллергический бронхолегочный аспергиллез (высокий уровень общего IgE, значительное повышение (в 2 раза и более) специфических IgE и IgG к Aspergillus fumigatus, проведение кожного тестирования с антигеном Aspergillus fumigatus).
Терапевтическая тактика БЭБ предусматривает выполнение следующих мероприятий:
• режим дня, диета;
• восстановление дренажной функции бронхов;
• антибактериальная терапия при обострении процесса;
• муколитическая терапия;
• иммуномодулирующая терапия;
• физиотерапия, ЛФК, дыхательная гимнастика;
• решение вопроса о хирургическом лечении;
• санаторно-курортное лечение
Диетотерапия. Рекомендована сбалансированная, высококалорийная диета с повышенным содержанием белка, витаминов. При декомпенсации сердечной деятельности назначается диета №10.
Антибактериальную терапию начинают с первых дней обострения, соблюдая те же принципы, что и при лечении острой пневмонии. Коррективы в антибактериальную терапию вносят с учетом бактериологического исследования мокроты.
Выбор антибиотика при БЭБ
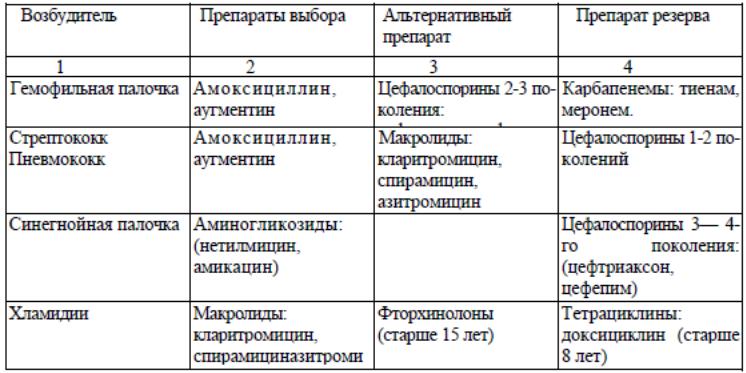
Критериями эффективности АБ терапии являются: положительная клиническая динамика, слизистый характер мокроты и уменьшение показателей активности инфекционного воспаления: нормализация СОЭ, снижение лейкоцитоза, нормализация уровня СРБ.
Для улучшения дренажной функции бронхов применяют отхаркивающие средства, позиционный дренаж, массаж грудной клетки, фитотерапию, дыхательную гимнастику.
Отхаркивающие средства в зависимости от механизма действия классифицируются следующим образом:
• средства муколитического действия, разжижающие мокроту путем изменения ее химико-физических свойств (амброксол, N-ацетилцистеин, карбоцистеин);
• средства, стимулирующие процесс отхаркивания (мукомоторики): сироп корня солодки, проспан, глицирам, мукалтин;
• регидратанты слизистого секрета, увеличивающие водный компонент мокроты: изотонический раствор хлорида натрия, стерильная вода.
Целесообразно сочетание разных способов введения отхаркивающих средств: энтерального, ингаляционного.
Для эвакуации мокроты используют также вибрационный массаж и постуральный дренаж. Больному придают положение с опущенным головным концом постели и поднятой тазовой частью, чем обеспечивается отток секрета из наиболее часто поражаемых и плохо дренируемых нижних долей легких. Вибрационный массаж достигается похлопыванием по грудной клетке на выдохе в целях выдавливания мокроты в более крупные бронхи.
При отсутствии эффекта от проводимой медикаментозной терапии необходимо санировать бронхиальное дерево путем проведения лечебной бронхоскопии. Проводят не более 3-4 бронхоскопий (1-2 раза в неделю).
Рекомендовано рассмотреть вопрос о назначении ингаляционных бронхоспазмолитических препаратов (β2-агонистов) у детей с БЭБ при положительной пробе с бронхоспазмолитиком при исследовании функции внешнего дыхания и при клинической эффективности, а также, при необходимости, перед проведением кинезитерапии. Могут применяться: сальбутамол (вентолин), фенотерол (беротек) для длительной терапии – пролонгированные препараты: формотерол (форадил). Также могут быть использованы ипратропия бромид (атровент) или ипратропия бромид+фенотерол (беродуал). Все препараты назначаются в возрастных дозировках.
Рекомендовано применение дорназы альфа (Пульмозим) детям с бронхоэктазами муковисцидозной этиологии. Рекомбинантная человеческая дорназа альфа – генно-инженерный вариант природного фермента человека, который расщепляет внеклеточную ДНК. Накопление вязкого гнойного секрета в дыхательных путях играет роль в нарушении функции внешнего дыхания и в обострениях инфекционного процесса у больных муковисцидозом. Гнойный секрет содержит очень высокие концентрации внеклеточной ДНК – вязкого полианиона, высвобождающегося из разрушающихся лейкоцитов, которые накапливаются в ответ на инфекцию. In vitro дорназа альфа гидролизирует ДНК в мокроте и выражено уменьшает вязкость мокроты при муковисцидозе. Доза препарата составляет 2,5 мг (соответствует содержанию препарата в 1 ампуле – 2,5 мл неразведенного раствора, 2500 МЕ) 1 раз в сутки. У большинства пациентов оптимального эффекта удается достичь при постоянном ежедневном применении Пульмозима. Следовательно, пациентам необходимо рекомендовать ежедневное применение препарата без перерыва.
Иммуномодулирующая терапия. Иммуномодуляторы – лекарственные средства, которые в терапевтических дозах восстанавливают нарушенную иммунную защиту организма от инфекционных агентов. Цели назначения иммуномодуляторов при БЭБ: повысить эффективность этиотропной противоинфекционной терапии, увеличить длительность ремиссии и снизить частоту обострений (и госпитализаций!), предупредить развитие инфекционных осложнений, нормализовать измененные показатели иммунной системы.
Классификация иммуномодуляторов по происхождению (Р.М. Хаитов, В.В. Пинегин, 2004г.).
Группа |
Подгруппа |
Название |
Микробные |
Естественные |
Рибомунил |
Бронхомунал, бронховаксом, исмиген |
||
Имудон |
||
ИРС-19 |
||
Полусинтетические |
Ликопид |
|
Тимические |
Естественные |
Тактивин |
Тималин |
||
Тимостимулин |
||
Синтетические |
Тимоген |
|
Бестим |
||
Имунофан |
||
Костномозговые |
Естественные |
Миелопид |
Синтетические |
Серамил |
|
Цитокины |
Естественные |
Лейкинферон |
Суперлимф |
||
Рекомбинантные |
Ронколейкин |
|
Беталейкин |
||
Лейкомакс |
||
Нейпоген |
||
Нуклеиновые кислоты |
Естественные |
Натрия нуклеинат |
Деринат |
||
Синтетические |
Полудан |
|
Растительные |
- |
Иммунал |
Химически чистые |
Низкомолекулярные |
Левамизол |
Диуцифон |
||
Галавит |
||
Гепон |
||
Глутоксим |
||
Аллоферон |
||
Высокомолекулярные |
Полиоксидоний |
В последнее время широко используется современный иммуномодулятор Пидотимод (Имунорикс), который стимулирует и регулирует клеточный и гуморальный иммунитет в условиях иммунодефицита, действует на Т-клеточный иммунитет – усиливает активность естественных киллеров и активирует фагоцитоз; на гуморальный иммунитет – увеличивает продукцию цитокинов. Также свою высокую эффективность в терапии БЭБ показали внутривенные иммуноглобулины (ВВИГ), состоящие из иммуноглобулинов М + G (Пентаглобин) или только IgG (Привиджен, Гамунекс, Октагам) с широким спектром функционально неповрежденных антител к различным инфекционным агентам. Механизм действия ВВИГ включает в себя не только заместительный, но и высокий иммуномодулируюший эффект.
Важным компонентом лечения БЭБ является физиотерапия. При обострении эффективна высокочастотная электротерапия (индуктотермия, СВЧ, ЭВТ). В последующем в комплекс физиотерапевтических мероприятий включают озокерито- и парафинолечение. В фазе ремиссии используют родоновые, кислородные, сульфидные ванны, грязелечение.
Оперативное лечение проводят крайне редко, у больных с локальными бронхоэктазами, упорной рецидивирующей пневмонией одной и той же локализации, частыми кровотечениями, инфицированием или длительным сегментарным коллапсом легкого, обычно только в тех случаях, когда исчерпаны возможности консервативной терапии. Решение об операции зависит от ряда факторов: частоты и тяжести кровохарканья, локализации кровотечения (из зоны БЭ), наличия локальных или диффузных БЭ. Их рецидивы возникают у 20% больных после операции. Хирургическое вмешательство, как правило, осуществляют детям не моложе 7 лет. Оперативное лечение наиболее показано при односторонних процессах в бронхах. При двустороннем поражении производят экономную частичную резекцию наиболее пораженного участка.
Кинезитерапия – один из важных компонентов комплексного лечения при БЭБ. Главная цель проведения кинезитерапии – очищение бронхиального дерева от скоплений мокроты, предрасполагающих к развитию инфекционных заболеваний бронхолёгочной системы. Наиболее часто используют следующие методики кинезитерапии:
- постуральный дренаж;
- перкуссионный массаж грудной клетки;
- активный цикл дыхания;
- контролируемое откашливание.
Эффективность тех или иных методов варьирует в зависимости от индивидуальных особенностей пациентов. Чем младше ребёнок, тем более пассивные методики дренирования следует использовать. Новорождённым выполняют только перкуссию и компрессию грудной клетки. По мере роста ребёнка следует постепенно вводить более активные методики, обучая пациентов технике контролируемого откашливания.
Фитотерапия: целесообразно назначать сборы трав по А. И. Чистяковой, обладающий преимущественно противовоспалительным и антисептическим действием (девясил, корень солодки, подорожник, чабрец, мать-и-мачеха), а затем чередовать назначение различных грудных сборов, содержащих алтей, душицу, анис, сосновые почки.
17. Дисфункция желчевыводящих путей: этиология, патогенез, классификация. Клиническая картина различных видов. Основные клинические синдромы. Клинико-инструментальные методы диагностики. Лечение
ДИСФУНКЦИИ БИЛИАРНОГО ТРАКТА
Дисфункции билиарного тракта - клинический симптомокомплекс, развивающийся в результате моторно-тонической дисфункции желчного пузыря, желчных протоков и сфинктеров без признаков органического поражения.
