
Диссертация на соискание учёной степени
.pdfобъединением локальных событий высвобождения Са2+ в независимых диадных пространствах. Другими словами, в теории локального контроля основным утверждением является то, что взаимное близкое расположение L-
каналов и отдельных кластеров RyR-каналов лежит в основе градуального высвобождения Са2+ и развития силы сокращения клетки в целом [62].
Существование локального контроля было подтверждено при проведении экспериментов с использованием конфокальной микроскопии по наблюдению локальных событий высвобождений из СР – Са2+-спарков [49-51].
Исследования количественных соотношений между L-каналами и RyR-
каналами [4] также подтвердило предположения данной теории. Было выявлено, что соотношение числа RyR-каналов к числу L-каналов равно 1 : 2
для клеток скелетной мышцы и 1 : 6 для кардиомиоцитов.
До настоящего времени в литературе ведутся дискуссии по вопросу процесса закрытия RyR-каналов и последующего завершения процесса высвобождения Са2+ из СР. Как уже было отмечено ранее, эксперименты указывают на тот факт, что завершение локальных процессов высвобождения могут происходить при сохранении достаточно высокой концентрации Са2+ в
люмене.
Существует несколько предположений касательно закрытия групп RyR-
каналов в ВЕ. Одна из теорий основана на экспериментальных данных по изучению динамики изолированных RyR-каналов в липидных бислоях [34] и
связана с предположением существования инактивационного состояния RyR-
канала – состояние, при котором ионы Са2+ связываются с так называемым инактивационным центром, что приводит к переходу канала в непроводящее состояние. Переход в инактивационное состояние, как и выход из него,
характеризуется достаточно малой вероятностью. Данная гипотеза была обобщена и для кластера взаимодействующих каналов в клетке в целом. В
численных моделях, представленных в работах [17, 18, 25], RyR-каналы переходят в инактивационное состояние с течением времени, что и обеспечивает завершение локальных высвобождений.
31
Вторая гипотеза носит название стохастического истощения (stochastic attrition) канала и основана на идеях случайности переходов канала из одного состояния в другое. Предполагается, что существует вероятность перехода всего кластера в закрытое состояние. Было показано [60], что эта модель может работать с относительно небольшим количеством RyR-каналов в кластере
(<10), так как с увеличением числа каналов резко падает вероятность одновременного перехода в закрытое состояние и растет время ожидания этого события. Экспериментальные данные, приведенные в [63-66], говорят о достаточно резком завершении локальных высвобождений.
Следующая теория связана с истощением люмена (luminal Ca2+ depletion effect) в процессе высвобождения и основана на большом количестве экспериментальных данных, подтверждающих зависимость вероятности открытия RyR-каналов от концентрации Са2+ в люмене [20, 21]. Как уже было сказано в разделе 1.3, вероятность пребывания канала в открытом состоянии зависит от уровня trans[Ca] в липидных бислоях, однако в живых клетках при физиологических условиях зависимость Popen от концентрации Са2+ люмене не столь существенна для того, чтобы считать истощение люмена единственной причиной завершения процесса высвобождения.
На основе анализа приведенных выше гипотез можно заключить следующее: ни один из механизмов этих моделей не был признан как единственный и первоочередной. Тем не менее, при моделировании кластера
RyR-каналов необходимо учитывать такие особенности, как стохастическое поведение каналов и кооперативную динамику кластера каналов. Также следует учитывать влияние ионов Са2+ в trans и cis-частях.
1.9 Моделирование активности клеток водителей сердечного ритма
Автоматизм сердца, то есть способность сердечной мышцы к периодическому сокращению без внешней стимуляции за счёт собственных внутренних механизмов, играет одну из ключевых ролей в обеспечении
32
непрерывной циркуляции крови, поддержании постоянства артериального давления и функционирования сердечно-сосудистой системы в целом.
Единый ритм сокращения сердца формируется в так называемом
синоатриальном узле (САУ) (Sinoatrial Node) сердца, находящемся в стенке правого предсердия, откуда волна возбуждения распространяется по всему миокарду [67]. Единый ритм возможен вследствие взаимной синхронизации огромного количества (десятков тысяч) [3] автоколебательных пейсмейкеров,
клеток САУ.
Вопрос о природе автоколебательной динамики клеток водителей сердечного ритма является открытым многие годы, и по поводу причин возникновения автоосцилляционного режима этого рода клеток до сих пор нет единого мнения [68-70].
Способностью к спонтанной генерации потенциала действия в той или иной степени обладают кардиомиоциты всех отделов проводящей системы, однако,
их собственная ритмическая активность подавлена возбуждением,
зарождающимся в синоатриальном узле, и снижается по мере пространственной удалённости от САУ, что позволяет говорить о явлении
«градиента автоматии» [71]. Такие кардиомиоциты получили название латентных водителей ритма, поскольку роль пейсмейкеров они приобретают только в случае повреждения ритмогенных структур синоатриального узла,
либо утраты связи с ними.
Клетки САУ существенно отличаются от клеток рабочего миокарда видом потенциала действия. В состоянии покоя сердечной мышцы (в диастолу)
значения мембранного потенциала рабочего миокарда приближаются к значениям потенциала покоя (- 80 мВ). Кардиомиоциты САУ, напротив,
отличаются наличием особой фазы потенциала действия – «медленной диастолической деполяризацией» (ДД) (рис. 1.19). После окончания потенциала действия мембранный потенциал не стабилизируется на уровне максимального диастолического (-60/-70 мВ), а медленно снижается с почти постоянной
33
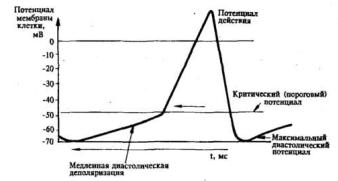
скоростью до тех пор, пока он не достигнет критического значения, после чего возникает очередной потенциал действия.
Рис. 1.19. Спонтанные изменения мембранного потенциала клетки водителя сердечного ритма.
Фаза (ДД) [72] считается одной из важнейших причин, обусловливающих периодически повторяющуюся активность миокарда, и, соответственно,
определяющих сердечный ритм. По этим причинам она закономерно стала объектом множества исследований, целью которых стало выяснение тонких клеточных механизмов, лежащих в основе её генерации.
1.9.1 Современные представления об авторитмической активности пейсмейкеров
На протяжении долгого времени многие исследователи [67, 69] при моделировании клеток водителей сердечного ритма основывались на предположении, что единственной причиной наличия фазы ДД служат внешние мембранные ионные токи. Действительно, существуют экспериментальные доказательства существования в пейсмейкерах специфических мембранных токов, названных “funny” (от англ. «забавный», «необычный»), I f [5, 73, 74].
Также экспериментально продемонстрировано участие I f тока в запуске процесса ДД и в регуляции скорости протекания этого процесса под влиянием химических агентов [74]. Показано, что снижение величины I f тока снижает скорость ДД и увеличивает время достижения пороговых значений мембранного потенциала, что обусловливает снижение частоты сердечных сокращений.
34
В работах [73, 75] был предложен следующий механизм возникновения ДД.
Ток I f инактивируется во время начала ПД и активируется во время
реполяризации, когда напряжение достигает порогового значения (-40мВ).
Медленная активация I f заставляет потенциал мембраны медленно
деполяризоваться до порогового уровня с последующей активацией входящего кальциевого тока и генерацией нового ПД [73].
Следует отметить, что до недавнего времени представление о
формировании ПД в пейсмейкерных клетках посредством мебранных токов было главенствующим и в теориях, и в математических моделях [67, 76].
1.9.2 Концепция внутренних Са2+-«часов»
Еще в 1943 г. Бозлер [77] предсказал существование внутренних химических осцилляторов в клетках ритмоводителей, однако их природа до сих пор остается предметом дискуссий [78-81].
Недавние эксперименты по изучению кальциевой динамики в клетках водителей ритма [79, 82-84] показали, что даже при отсутствии стимуляции со стороны внешних мембранных токов наблюдаются спонтанные периодические высвобождения Ca2 из терминальных цистерн СР. Данный факт напрямую подтверждает существование внутренних кальциевых осцилляторов, так называемых кальциевых «часов». Роль Са2+-«часов» выполняет система Са2+-
высвобождающих единиц. События высвобождения Са2+ из СР являются периодическими и запускают Na2+-Ca2+ обменный ток, играющий триггерную роль в формировании ПД в клетках САУ.
1.9.3 Модель Мальцева-Лакатты
Авторы работ [81, 85-89] высказали предположение, что самосогласованное взаимодействие внутреннего Ca2 осциллятора с мембранными «часами»
(периодическими изменениями мембранного потенциала) обеспечивают надежность работы ритмоводителей в достаточно широком диапазоне
динамических параметров.
35
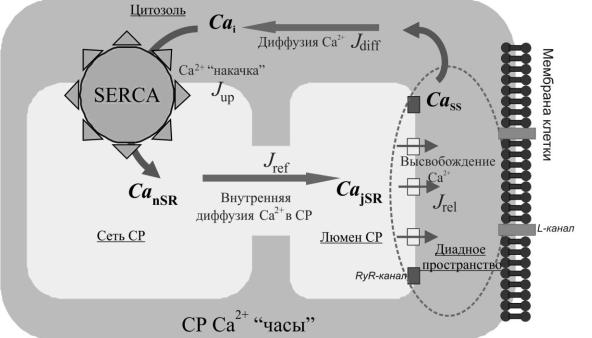
Сравнительно недавно в 2009 году Мальцев и Лакатта [87] разработали модель клеток САУ (ML-модель), которая описывает самосогласованное взаимодействие внутренних Са2+-«часов» и внешнего мембранного осциллятора и позволяет исследовать механизмы формирования и устойчивости колебаний концентрации Ca2 в различных отделах сердечной клетки.
Рис. 1.20. Схема Ca2 потоков между отделами кардиомиоцитов. i – цитозоль клетки;
nSR (sarcoplasmic reticulum network) – сеть СР;
jSR (junctional SR) – терминальные цистерны (люмен) СР;
SS(subspace) – субпространство.
Всвоих работах авторы основывались на широко известной модели структуры клетки (рис. 1.20), состоящей всего из четырех основных компонентов: диадного пространства, цитозоля, сети СР и просвета ТЦ
(люмена) СР.
Была использована "теория эффективного среднего поля", в которой концентрации Ca2 в диадном пространстве и в люмене СР ( CaSS ,CajSR ,
соответственно) являются главными управляющими величинами.
Проводимость RyR-каналов рассматривалась в упрощенном виде как некая
36
функция концентрации высвобождающегося Ca2 в диадном пространстве. Для описания внешнего мембранного осциллятора авторы применили теорию мембранных токов ионов Са2+, Na2+, Mg2+ и K+ (модель Кураты) [85], а для описания кинетики внутриклеточного Ca2 модель Шэннона [90], что при объединении дало систему 29 дифференциальных уравнений. Было показано,
что изолированный СР действительно может вести себя как самоподдерживающийся осциллятор, который можно описать простейшим механизмом «накопление-сброс». В ML-модели малое “первичное” спонтанное высвобождение Ca2 из люмена в диадное пространство является своеобразным триггером, инициирующим колебательную динамику всей системы. Когда концентрация CaSS достигает некоторого критического значения, она усиливает процесс «вторичного» высвобождения Ca2
посредством механизма КВВК. Это достаточно сильное высвобождение Ca2 в
свою очередь резко уменьшает уровень CajSR , а высвобожденный Ca2
поглощается сетью СР ( CanSR ). Длительность задержки между высвобождениями определяется скоростью закачки Ca2 из цитозоля в сеть СР,
диффузии из сети СР в люмен, высвобождения из люмена в диадное пространство и диффузии из диадного пространства в цитозоль. В процессе заполнения люмена и достаточно медленного увеличения CajSR происходит постепенное открытие RyR-каналов, затем имеет место следующее высвобождение и т.д.
ML-модель самосогласованных осцилляторов, казалось бы, способна описать все недавно обнаруженные особенности функционирования клеток ритмоводителей, однако, будучи чисто феноменологической, она, как и все интегративные модели, не учитывает ряд важнейших биофизических особенностей субклеточных элементов, в частности, структуру RyR-каналов огромных наноскопических белков, их кооперативное взаимодействие,
пространственно-временную структуру Ca2 -высвобождений, формируемых системой высвобождающих единиц. Спорным представляется и основное
37
предположение ML-модели относительно CaSS2 как основного активатора RyR-
каналов. Это представление противоречит многочисленным экспериментальным фактам, свидетельствующим о важной роли
«люменальной» активации [14, 20]. Очевидно, что более реалистичное моделирование Ca2 -осцилляторов в клетках САУ должно включать в себя биофизически обоснованную модель изолированных RyR-каналов и соответствующих кластеров, а также стохастический механизм локальных
Ca2 -высвобождений, учитывающий как cis- (со стороны диадного пространства), так и trans- (со стороны люмена) механизм активации RyR-
каналов. Эти задачи решаются в данной работе.
38
ГЛАВА 2. Построение модели.
2.1 Электронно-конформационная модель RyR-канала
В данном разделе описано построение математической модели
одиночного RyR-канала.
1.Модифицирована разработанная ранее электронно-
конформационная модель стохастической динамики
молекулярных нанокластеров приментительно к описанию
конформационной динамики RyR-каналов.
2.В рамках электронно-конформационной теории рассмотрены процессы открытия/закрытия RyR-канала в зависимости от характера стимуляций и квантовых эффектов.
3.Проведено обобщение электронно-конформационной модели RyR-канала применительно к кластеру взаимодействующих каналов в ВЕ.
4.Представлена модель внутренней динамики ионов Са2+ в клетках водителя сердечного ритма.
RyR-каналы представляют собой гигантские нанокластеры; они обладают сложнейшей молекулярной структурой и огромным количеством внутренних степеней свободы.
С точки зрения моделирования Са2+-динамики в клетке основными характеристиками RyR-канала являются его проницаемость, то есть способность пропускать через себя ионы Са2+, и активируемость –
способность связывания активных центров канала с ионами Са2+ с
последующим конформационным (структурным) изменением, то есть переходом в проводящее или, наоборот, в непроводящее состояние [91, 92]. Эти особенности как основополагающие были учтены при разработке электронно-
конформационной (ЭК) модели RyR-канала [93-95].
39
Основные положения электронно-конформационной модели базируются на представлениях теории фотоиндуцированных структурных фазовых переходов
[96, 97], которая нашла широкое применение в алгоритмах метода молекулярной динамики для компьютерного моделирования состава,
структуры и свойств различных сложных сред [98, 99].
В рамках ЭК модели огромное количество степеней свободы канала как молекулярного нанокластера сводится всего к двум – быстро изменяющейся условно называемой «электронной» и медленной конформационной, которые управляются токами через L-каналы и концентрацией кальция в люмене высвобождающей единицы кардиомиоцитов.
При разработке модели динамики RyR-канала выдвинуты следующие предположения:
Конформационная степень свободы связана со структурными свойствами RyR-канала и описывается некоторой обобщенной координатой Q. При этом взаимодействие между четырьмя структурными группами, формирующими канал, является упругим,
иих взаимное расположение определяет степень открытости, то есть проницаемость канала (рис. 2.1).
Электронная степень свободы является дискретной величиной
иможет принимать только два значения, соответствующие открытому и закрытому состояниям канала (рис. 2.1). Эта степень свободы меняется вследствие взаимодействия
(связывания/отсоединения) ионов Ca2 с активными центрами
RyR-канала. Изменение электронной координаты имеет триггерный характер для стимуляции изменения конформационной координаты и, соответственно, изменения проводимости RyR-канала.
40
