
Диссертация на соискание учёной степени
.pdf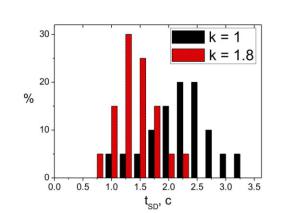
Было замечено, что при увеличении параметра k сокращается время пребывания системы в состоянии устойчивых колебаний. Тот факт, что появление устойчивого кластера открытых RyR-каналов осуществляется быстрее при повышенном значении k доказывают и формы гистограмм распределений по временам переходов в стационарный режим ( tSD , от англ. stationary dynamics – стационарная динамика).
Рис. 4.22. Гистограммы распределений времен переходов Са2+-«часов» в стационарный режим при двух различных значениях параметра взаимодействия между каналами.
Данные гистограммы, построенные по результатам двадцати экспериментов,
проведенных при каждом значении k, позволяют сделать вывод, что при увеличении k максимум распределения сдвигается влево, то есть среднее время функционирования осцилляционной системы перед переходом в стационарное состояние уменьшается. Другими словами, чем сильнее взаимодействие, тем быстрее система переходит в стационарный режим.
4.2.3.3 Влияние стимула на Са2+-«часы», находящихся в стационарном режиме
При исследовании эффекта случайной остановки также рассмотрено влияние внешнего стимула со стороны L-каналов на поведение системы.
Данный стимул моделировался кратковременным повышением уровня CaSS в
определенные моменты времени.
В численных экспериментах на данном этапе стимул включался только в тот момент, когда система уже перешла в стационарный режим. На рисунке 4.22
представлены зависимости Nopen(t) в случае стимуляции в момент t=2 с после перехода Са2+-«часов» в стационарное состояние (моменты переходов
151
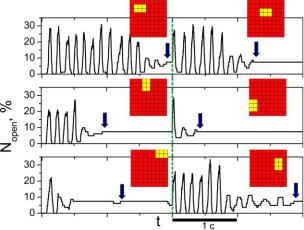
отмечены стрелками), а также показаны формы устойчивых кластеров открытых каналов.
Рис. 4.23. Зависимость относительного числа открытых каналов в кластере в случае случайной остановки осцилляций и влияния внешнего стимула со стороны каналов L-типа.
На основе вышеприведенных результатов сделан важный вывод:
кратковременная стимуляция выводит Са2+-«часы» из стационарного режима в авторитмический, однако, через некоторое время (0.6÷1.7 c) система вновь спонтанно возвращается в стационарный режим. Из данных наблюдений следует, что именно самосогласованное взаимодействие внутренних и мембранных Са2+-«часов» способствует проявлению стабильной автоволновой динамики всей клетки в целом.
Впервые вышеописанные спонтанные переходы автоколебательной кальциевой системы в стационарный режим были выявлены только в рамках математической модели, представленной в данной диссертационной работе.
Обнаруженный эффект показывает способность перехода высвобождающей единицы в отсутствие внешнего стимула в гибернированное (спящее)
состояние, позволяющее системе адаптироваться к внешним условиям.
Стоит отметить, что в реальных сердечных клетках существует несколько сотен высвобождающих единиц. Случайный переход некоторых из них в гибернированное состояние не может нарушить автоколебательной активности клетки в целом. Однако при большом количестве «остановившихся» высвобождающих единиц есть вероятность перехода всего кардиомиоцита в гибернированное состояние, что влечет за собой нарушения в ритмической активности сердца.
152
4.3 Заключение
Проведен анализ предложенной объединенной математической модели,
включающей в себя электронно-конформационную теорию кластера RyR-
каналов и модель Са2+-высвобождающей системы в пейсмейкерных клетках.
Предложена простая схема, иллюстрирующая специфическую динамику функционирования высвобождающей единицы в клетках водителя сердечного ритма.
Численные эксперименты в рамках объединенной модели показали, что внутриклеточная Са2+-высвобождающая система при отсутствии внешнего стимула может вести себя как самоподдерживающийся кальциевый осциллятор
(Са2+-«часы»). Выявлены и исследованы различные моды поведения изолированных Са2+-«часов» при различных значениях параметров модели.
Отмечено, что в физиологическом режиме при повышении частоты увеличивается амплитуда осцилляций Са2+-«часов», что на молекулярном уровне объясняет принцип Боудича «чаще-сильнее» работы сердечных клеток.
Исследовано влияние кооперативности динамики взаимодействующих RyR-
каналов на характер осцилляций Са2+-«часов». Показано, что взаимодействие между каналами влияет на стабильность осцилляций.
Обнаружен и исследован принципиально новый эффект внезапной остановки Са2+-«часов», связанный с недостаточно быстрым заполнением люмена СР и сильным взаимодействием между каналами в кластере ВЕ.
153
ЗАКЛЮЧЕНИЕ
ОСНОВНЫЕ РЕЗУЛЬТАТЫ И ВЫВОДЫ
1. Дано дальнейшее развитие электронно-конформационной модели RyR-
канала и кластера RyR-каналов на мембране саркоплазматического ретикулюма в высвобождающей единице. Впервые в ЭК-модели предложено введение дополнительного, инактивационного состояния. Предложена новая модель взаимодействия ионов Са2+ с активационным центром RyR-канала,
учитывающая вероятности заполнения мест присоединения активационного центра ионами Са2+. Дана детализация модели туннельных переходов,
включающая введение «зоны разрешенного туннельного перехода» вблизи минимума конформационного потенциала RyR-канала.
2. Разработан многоцелевой компьютерный комплекс, реализующий алгоритмы численного решения уравнений электронно-конформационной модели и единой модели Са2+ высвобождающей единицы, на базе которого проводились серии экспериментов по изучению динамики одиночного RyR-
канала, кластера RyR-каналов и Са2+ высвобождающей единицы.
3.Впервые в рамках электронно-конформационной модели воспроизведены
иобъяснены основные экспериментально наблюдаемые особенности функционирования одиночного RyR-канала:
-экстремальная зависимость вероятности пребывания RyR-канала в открытом состоянии от концентрации Са2+;
-влияние ионов Mg2+ на процесс активации RyR-канала;
-эффект адаптации RyR-канала к продолжительной стимуляции.
4.Разработана единая модель Са2+ высвобождающей единицы,
объединяющая электронно-конформационную модель функционирования кластера RyR-каналов с моделью динамики ионов Са2+ между отделами высвобождающей единицы.
5. Впервые в рамках ЭК-модели исследована изолированная Са2+
высвобождающая единица в клетках водителя сердечного ритма (Ca2+-«часы»).
154
Численные эксперименты показали, что изолированная ВЕ в широком диапазоне параметров может вести себя как самоподдерживающийся кальциевый осциллятор. Выявлена различные режимы функционирования изолированной ВЕ. Отмечено, что в физиологическом режиме при повышении частоты увеличивается амплитуда осцилляций Са2+-«часов», что на молекулярном уровне объясняет принцип Боудича «чаще-сильнее» работы сердечных клеток.
7.Впервые исследовано влияние взаимодействия между RyR-каналами на стабильность работы Са2+-«часов». Показано, что включение конформационного взаимодействия между каналами приводит к стабилизации осцилляций по частоте и амплитуде.
8.Впервые обнаружен и исследован эффект случайной остановки осцилляций Са2+-«часов» при достаточно сильном взаимодействии между RyR-
каналами в ВЕ.
155
Список литературы
1.Bers, D., Excitation-contraction coupling and cardiac contractile force. Vol.
237.2001: Kluwer Academic Pub.
2.Wehrens, X.H. and A.R. Marks, Ryanodine Receptors: Structure, function and dysfunction in clinical disease. Vol. 254. 2004: Springer.
3.Moskvin, A.S., et al., Electron-conformational model of ryanodine receptor lattice dynamics. Progress in biophysics and molecular biology, 2006. 90(1): p. 88-
4.Moskvin, A.S., et al. Electron-conformational model of nonlinear dynamics of the ryanodine channel lattice in cardiomyocytes. Doklady Biochemistry and Biophysics. 2005. Springer.
5.Moskvin, A.S., et al. Biophysical adaptation of the theory of photo-induced phase transition: model of cooperative gating of cardiac ryanodine receptors. in Journal of Physics: Conference Series. 2005. IOP Publishing.
6.Коньков Л. Е. и др. Нелинейная динамика клеточного рианодинового канала //Нелинейная динамика. – 2008. – Т. 4. – №. 2. – С. 181-192.
7.Беркинблит, М.Б. and Е.Г. Глаголева, Электричество в живых организмах. 1988: Наука.
8. Гоффман, Б., и др., Электрофизиология сердца: Пер. с англ. 1962: Изд-во иностр. лит.
9. Морман, Д., Хеллер Л., Физиология сердечно-сосудистой системы. СПб.:
Питер, 2000. 250: стр. 15.
10.Katz, A.M., Physiology of the Heart. 2010: Lippincott Williams & Wilkins.
11.Bers, D.M., Cardiac action potential and ion channels, in ExcitationContraction Coupling and Cardiac Contractile Force. 2001, Springer. p. 63-100.
12.Williams, A.J., D.J. West, and R. Sitsapesan, Light at the end of the Ca2+- release channel tunnel: structures and mechanisms involved in ion translocation in ryanodine receptor channels. Quarterly reviews of biophysics, 2001. 34(1): p. 61.
156
13. Yin, C.-C., L.M. Blayney, and F. Anthony Lai, Physical coupling between ryanodine receptor–calcium release channels. Journal of molecular biology, 2005.
349(3): p. 538-546.
14.Marx, S.O., et al., Coupled gating between cardiac calcium release channels (ryanodine receptors). Circulation research, 2001. 88(11): p. 1151-1158.
15.Wehrens, X.H.T., et al., FKBP12. 6 deficiency and defective calcium release channel (ryanodine receptor) function linked to exercise-induced sudden cardiac death. Cell, 2003. 113(7): p. 829-840.
16.Copello, J., et al., Differential activation by Ca2+, ATP and caffeine of cardiac and skeletal muscle ryanodine receptors after block by Mg2+. Journal of Membrane Biology, 2002. 187(1): p. 51-64.
17.Laver, D., et al., Cytoplasmic Ca2+ inhibits the ryanodine receptor from cardiac muscle. The Journal of membrane biology, 1995. 147(1): p. 7-22.
18.Fabiato, A., Time and calcium dependence of activation and inactivation of calcium-induced release of calcium from the sarcoplasmic reticulum of a skinned canine cardiac Purkinje cell. The Journal of general physiology, 1985. 85(2): p. 247289.
19.Zahradnikova, A., J. Bak, and L.G. Meszaros, Heterogeneity of the cardiac calcium release channel as assessed by its response to ADP-ribose. Biochemical and biophysical research communications, 1995. 210(2): p. 457-463.
20.Malev, V., et al., Kinetics of opening and closure of syringomycin E channels formed in lipid bilayers. Membrane & cell biology, 2001. 14(6): p. 813.
21.Zahradnikova, A., J. Bak, and L.G. Meszaros, Heterogeneity of the cardiac calcium release channel as assessed by its response to ADP-ribose. Biochemical and biophysical research communications, 1995. 210(2): p. 457-463.
22.Fill, M., et al., Ryanodine receptor adaptation. The Journal of general physiology, 2000. 116(6): p. 873-882.
23.Armisen R., Sierralta J., Vélez P., Naranjo D., Suarez-Isla B.A. Modal gating in neuronal and skeletal muscle ryanodine-sensitive Ca2+ release channels. Am J Physiol Cell Physiol, 1996. 271: р. 144–153.
157
24.Gyorke, I. and S. Gyorke, Regulation of the Cardiac Ryanodine Receptor Channel by Luminal Ca2+ Involves Luminal Ca2+ Sensing Sites. Biophysical journal, 1998. 75(6): p. 2801-2810.
25.Gyorke, S. and D. Terentyev, Modulation of ryanodine receptor by luminal calcium and accessory proteins in health and cardiac disease. Cardiovascular research, 2008. 77(2): p. 245-255.
26.Bordner, A.J., Predicting small ligand binding sites in proteins using backbone structure. Bioinformatics, 2008. 24(24): p. 2865-2871.
27.Bertram, R., et al., Tutorials in Mathematical Biosciences II: Mathematical Modeling of Calcium Dynamics and Signal Transduction. Vol. 2. 2005: Springer.
28.Fill M., C.J., Ryanodine Receptor Calcium Release Channels. Physiol Rev, 2002. 82: p. 893-922.
29.Gyorke, S. and M. Fill, Ryanodine receptor adaptation: control mechanism of Ca (2+)-induced Ca2+ release in heart. Science, 1993. 260(5109): p. 807-809.
30.Fill, M. and J.A. Copello, Ryanodine receptor calcium release channels. Physiological reviews, 2002. 82(4): p. 893-922.
31.Keizer, J. and L. Levine, Ryanodine receptor adaptation and Ca2+ (-) induced Ca2+ release-dependent Ca2+ oscillations. Biophysical journal, 1996. 71(6): p. 34773487.
32.M. Fill, A.Z.e.a., Ryanodine Receptor Adaptation. J. Gen. Physiol., 2000. 116: p. 873-882.
33.Valdivia, H.H., et al., Rapid adaptation of cardiac ryanodine receptors: modulation by Mg2+ and phosphorylation. Science, 1995. 267(5206): p. 1997-2000.
34.Laver, D.R., Ca2+ stores regulate ryanodine receptor Ca2+ release channels via luminal and cytosolic Ca2+ sites. Clinical and experimental pharmacology and physiology, 2007. 34(9): p. 889-896.
35.Laver, D.R. and B.A. Curtis, Response of ryanodine receptor channels to Ca2+ steps produced by rapid solution exchange. Biophysical journal, 1996. 71(2): p. 732-741.
158
36. Sobie E. A. et al. Termination of Cardiac Ca2+ Sparks: An Investigative Mathematical Model of Calcium-Induced Calcium Release //Biophysical journal. – 2002. – Т. 83. – №. 1. – С. 59-78.
37.Rosales, R.A., M. Fill, and A.L. Escobar, Calcium regulation of single ryanodine receptor channel gating analyzed using HMM/MCMC statistical methods. The Journal of general physiology, 2004. 123(5): p. 533-553.
38.Zahradnikova, A. and I. Zahradnik, A minimal gating model for the cardiac calcium release channel. Biophysical journal, 1996. 71(6): p. 2996-3012.
39.Zahradnikova, A. and I. Zahradnik, Analysis of calcium-induced calcium release in cardiac sarcoplasmic reticulum vesicles using models derived from singlechannel data. Biochimica et Biophysica Acta (BBA)-Biomembranes, 1999. 1418(2): p. 268-284.
40.Bassingthwaighte, J.B., L.S. Liebovitch, and B.J. West, Fractal physiology. Vol. 2. 1994: Amer Physiological Society.
41.Гриневич, А., М. Асташев, and В. Казаченко, Мультифрактальная кинетика воротного механизма ионных каналов в биологических мембранах.
Биологические мембраны: Журнал мембранной и клеточной биологии, 2007.
24(4): p. 316-332.
42.Liebovitch, L.S., J. Fischbarg, and J.P. Koniarek, Ion channel kinetics: a model based on fractal scaling rather than multistate Markov processes. Mathematical Biosciences, 1987. 84(1): p. 37-68.
43.Oswald R.E., Millhause G.L., Carter A.A. Diffusion model in ion channel gating. Extension to agonist-acti-vated ion channels // Biophys. J. 1991. V. 59. P. 1136–1142.
44.Liebovitch L.S. Analysis of fractal ion channel gating kinetics: Kinetics rates energy levels and activation energies // Math. Biosci. 1989. V. 93. P. 97–115
45.Шайтан, К., К. Терешкина, Молекулярная динамика белков и пептидов. 2004: Ойкос М.
46.Шайтан, К., Конформационная подвижность белка с точки зрения физики. Соросовский образовательный журнал, 1999. 5: p. 8-13.
159
47.Liebovitch L.S., Lullivan J.M. Fractal analysis of a voltage-dependent potassium channel from cultured mouse hippocampal neurons // Biophys. J. 1987. V.
52.P. 979–988.
48.Liebovitch L.S., Krekora P. The physical basis of ion channel kinetics: the impotance of dynamics // Proc. Inst. Math. and its Appl. Univer. Minnessota. 2002. V. 129. P. 27–52.
49.Varanda W.A., Liebovitch L.S., Figueiroa J.N., Nogueira R.A. Hurst analysis applied the study of single calcium-activated potassium channel kinetics // J. íheor. Biol. 2000. V. 206. P. 343–353.
50.Bers, D.M., Cardiac excitation-contraction coupling. Nature, 2002. 415(6868): p. 198-205.
51.Bers, D.M., Calcium cycling and signaling in cardiac myocytes. Annu. Rev. Physiol., 2008. 70: p. 23-49.
52.Tsugorka A., Rios E., Blatter L. A. Imaging elementary events of calcium release in skeletal muscle cells //Science. – 1995. – Т. 269. – №. 5231. – С. 1723-1726.
52.Cheng H., Lederer W. J., Cannell M. B. Calcium sparks: elementary events underlying excitation-contraction coupling in heart muscle //Science. – 1993. – Т.
262.– №. 5134. – С. 740-744.
53.Wier, W.G. and C.W. Balke, Ca2+ release mechanisms, Ca2+ sparks, and local control of excitation-contraction coupling in normal heart muscle. Circulation research, 1999. 85(9): p. 770-776.
54.Shirokova, N., et al., Calcium sparks: release packets of uncertain origin and fundamental role. The Journal of general physiology, 1999. 113(3): p. 377-384.
55.Stern, M., Theory of excitation-contraction coupling in cardiac muscle. Biophys J, 1992. 63: p. 497–517.
56.Winslow, R.L., Rice, J.J., Jafri, M.S., Marban, E. and O’Rourke, B.,
Mechanisms of Altered Excitation-Contraction Coupling in Canine TachycardiaInduced Heart Failure. II. Model Studies. Circ. Res., 1999. 84: p. 571–586. 104, 105, 106, 108, 122, 123
160
