
- •Саратовский государственный технический университет
- •Введение
- •1. Тепловые эффекты химических реакций и калориметрия
- •1.1. Теоретическая часть
- •Основные понятия
- •Первый закон термодинамики
- •Второй закон термодинамики
- •Третий закон термодинамики
- •Энергетика химических реакций Тепловые эффекты химических реакций Количество теплоты. Уравнение теплового баланса
- •Термохимические законы Закон Гесса
- •Закон Кирхгофа
- •Закон Лавуазье-Ломоносова-Лапласа
- •Тепловые эффекты фазовых превращений
- •Направленность химических процессов
- •1.2. Экспериментальная часть Основы калориметрии
- •Типы калориметров
- •Работа №1. Определение содержания кислоты (концентрации) по тепловому эффекту нейтрализации
- •Работа №2. Исследование тепловых эффектов химических реакций.
- •Графическая обработка результатов эксперимента
- •1. Определение изменение температуры в ходе химической реакции.
- •2. Расчет систематической погрешности
- •3. Расчет погрешности в определении теплового эффекта реакции
- •Содержание и оформление отчета
- •Вопросы для самоконтроля
- •Задачи для самостоятельного решения
- •2. Идеальные растворы и их свойства
- •2.1. Теоретическая часть Растворы
- •Идеальные растворы
- •Свойства идеальных растворов Понижение давления насыщенного пара растворителя
- •Температура кристаллизации разбавленных растворов
- •Температура кипения разбавленных растворов
- •Изотонический коэффициент
- •Явление осмоса
- •Применение законов идеальных растворов
- •2.2. Экспериментальная часть Работа №1. Определение изотонического коэффициента и степени диссоциации электролита эбулиоскопическим методом
- •Работа №2 Определение молекулярной массы вещества криоскопическим методом
- •Обработка результатов эксперимента
- •Работа №3 Определение осмотического давления раствора неэлектролита
- •Вопросы для самоконтроля
- •Задачи для самостоятельного решения
- •3. Фазовые равновесия
- •3.1. Теоретическая часть
- •Фазовые диаграммы состояния систем
- •Однокомпонентные системы
- •Двухкомпонентные системы
- •Двухкомпонентные конденсированных системы
- •Диаграмма состояния системы с эвтектикой
- •Системы с образованием химических соединений, плавящихся конгруэнтно
- •Системы с образованием химических соединений, плавящихся инкогруэнтно
- •Системы с неограниченной растворимостью компонентов в жидком и ограниченной взаимной растворимостью в твердом состояниях
- •Системы с ограниченной взаимной растворимостью компонентов в жидком состоянии
- •Трехкомпонентные системы
- •3.2. Экспериментальная часть Работа № 1. Построение диаграммы состояния бинарной системы фенол-нафталин
- •Вопросы для самоконтроля
- •Пример решения задач
- •Задачи для самостоятельного решения
- •Литература
- •Приложение 1
- •Приложение 2
- •Оглавление
- •Лабораторный практикум по химической термодинамике
Приложение 2
Диаграммы состояния двухкомпонентных систем
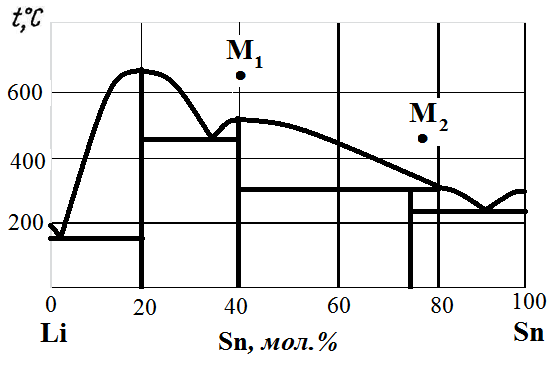
Рис. 1. Диаграмма состояния Li – Sn.
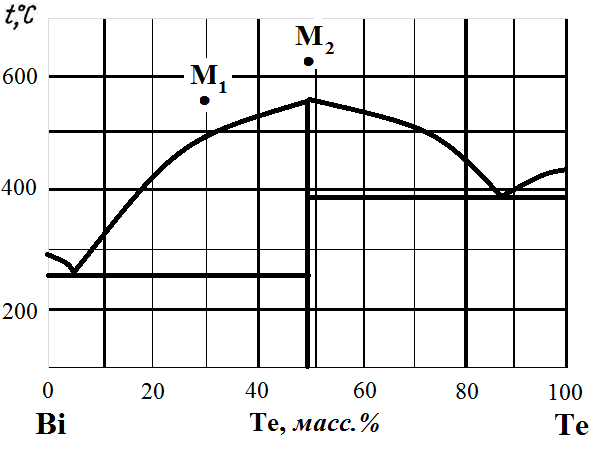
Рис. 2. Диаграмма состояния Bi – Te.
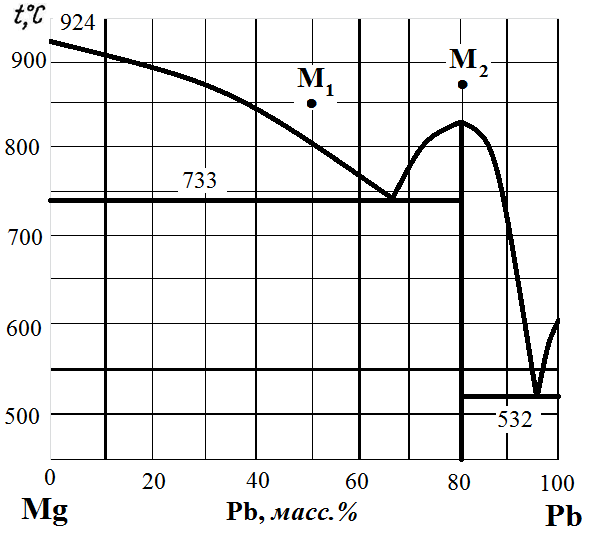
Рис. 3. Диаграмма состояния Mg – Pb

Рис.4. Диаграмма состояния Mg – Ca
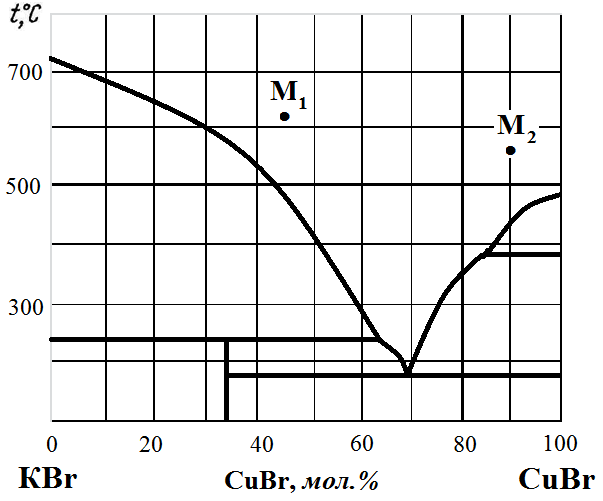
Рис. 5. Диаграмма состояния KBr – CuBr.
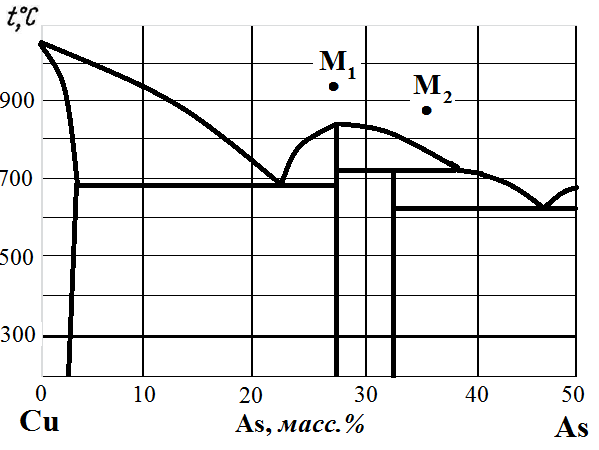
Рис. 6. Диаграмма состояния Cu – As.
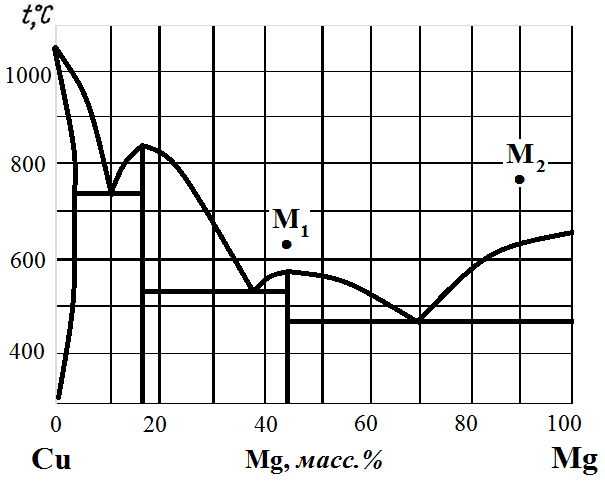
Рис. 7. Диаграмма состояния Cu – Mg.

Рис. 8. Диаграмма состояния K – Sb.
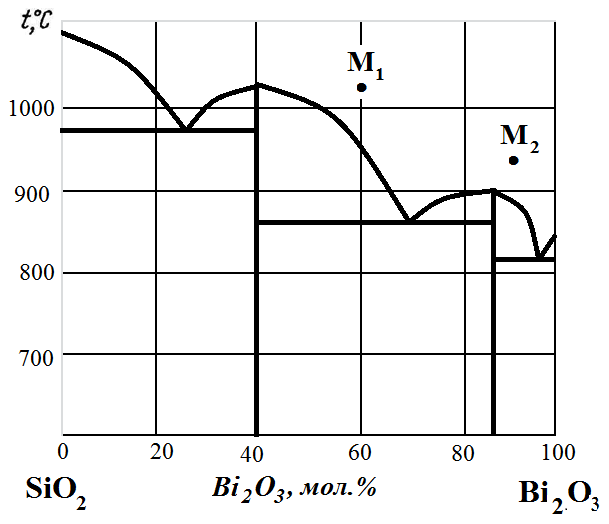
Рис. 9. Диаграмма состояния SiO2 – Bi2O3.
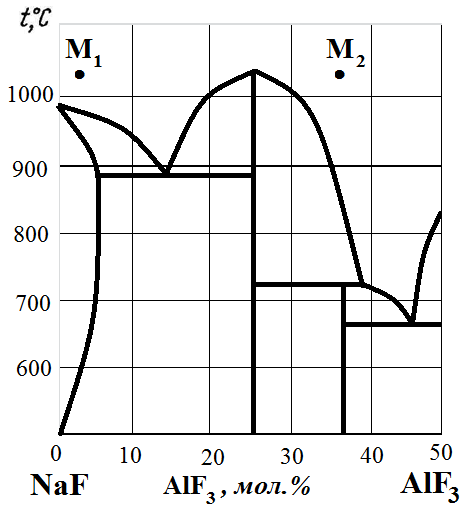
Рис. 10. Диаграмма состояния NaF – AlF3

Рис. 11. Диаграмма состояния Fe – Zr.
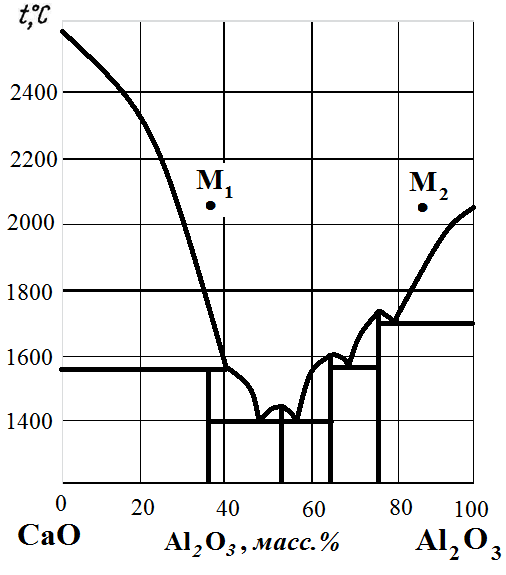
Рис. 12. Диаграмма состояния CaO – Al2O3.
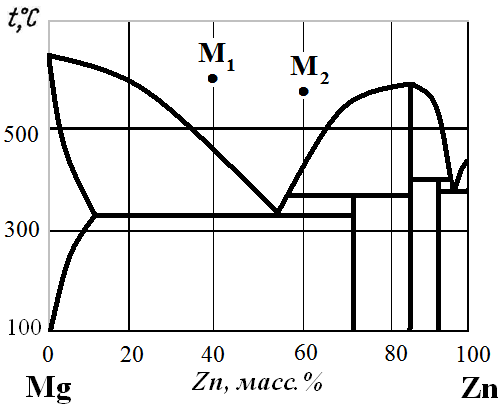
Рис. 13. Диаграмма состояния Mg – Zn.
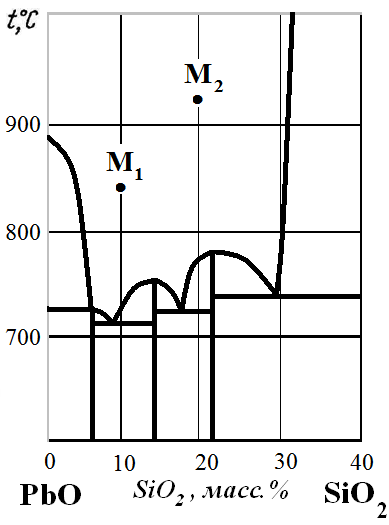
Рис. 14. Диаграмма состояния PbO – SiO2.
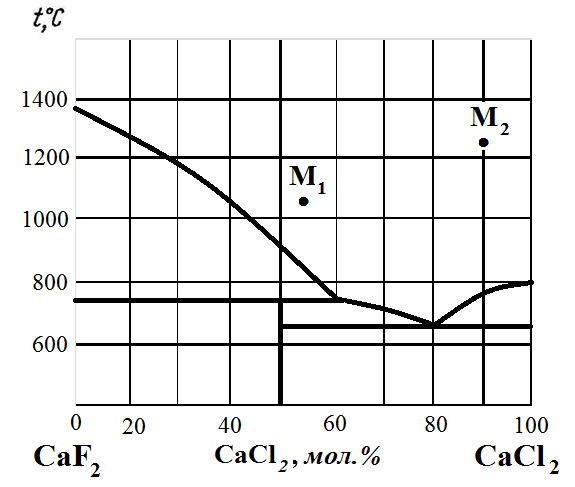
Рис. 15. Диаграмма состояния CaF2 – CaCl2.
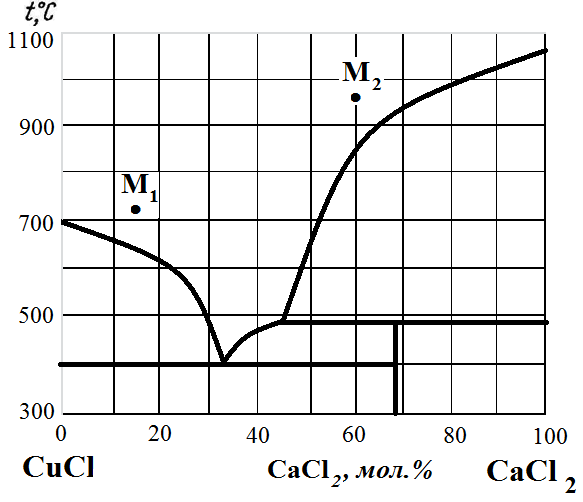
Рис. 16. Диаграмма состояния CuCl – CaCl2
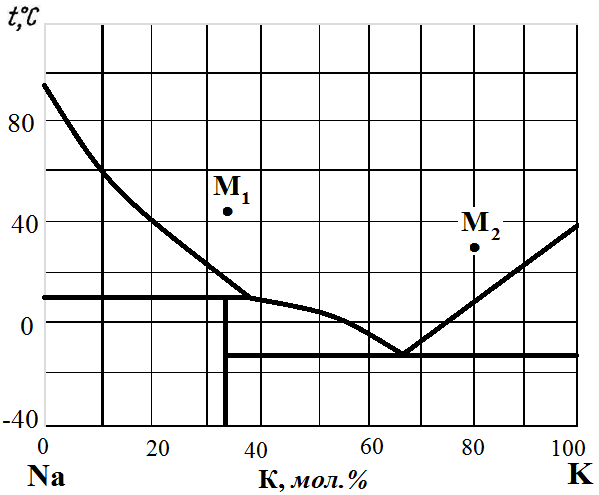
Рис. 17. Диаграмма состояния Na – K.
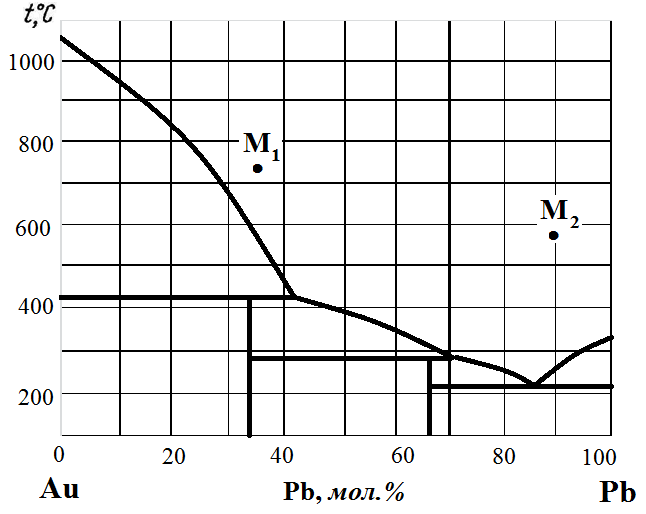
Рис. 18. Диаграмма состояния Au – Pb.
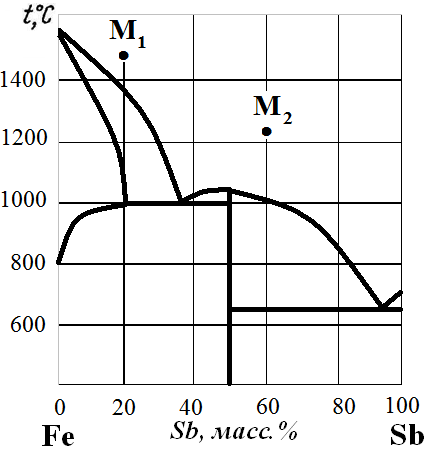
Рис. 19. Диаграмма состояния Fe – Sb.
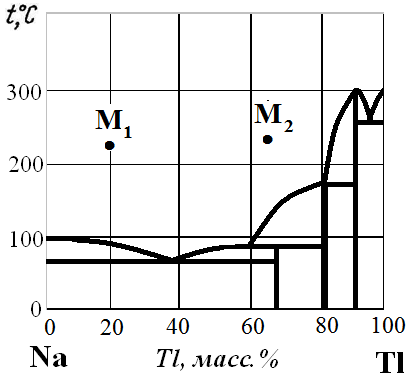
Рис. 20. Диаграмма состояния Na – Tl.
Оглавление
ВВЕДЕНИЕ 3
1. ТЕПЛОВЫЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ 5
И КАЛОРИМЕТРИЯ 5
1.1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ 5
1.2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 21
Работа №1. 23
Определение содержания кислоты (концентрации) по тепловому эффекту нейтрализации 23
Работа №2. 25
Исследование тепловых эффектов химических реакций. 25
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 28
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ 28
2. ИДЕАЛЬНЫЕ РАСТВОРЫ И ИХ СВОЙСТВА 34
2.1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ 34
2.2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 46
Работа №1. 46
Определение изотонического коэффициента и степени диссоциации электролита эбулиоскопическим методом 46
Работа №2 48
Определение молекулярной массы вещества криоскопическим методом 48
Работа №3 51
Определение осмотического давления раствора неэлектролита 51
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 52
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ 52
3. ФАЗОВЫЕ РАВНОВЕСИЯ 55
3.1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ 55
3.2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 85
Работа № 1. 85
Построение диаграммы состояния бинарной системы фенол-нафталин 85
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 87
ПРИМЕР РЕШЕНИЯ ЗАДАЧ 88
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ 94
ЛИТЕРАТУРА 96
Приложение 1 97
Приложение 2 106
ОГЛАВЛЕНИЕ 116
Учебное издание
АРХИПОВА Наталия Викторовна
КОСОБУДСКИЙ Игорь Донатович
НИКИТИНА Людмила Владимировна
КОВЫНЕВА Наталья Николаевна
Лабораторный практикум по химической термодинамике
Учебное пособие
для студентов всех специальностей
|
|
|
Корректор Е.В. Григоренко
|
Подписано в печать |
Формат 60х84 | ||
|
Бум. тип. |
Усл.-печ. л. |
Уч.-изд.л. | |
|
Тираж 100 экз. |
Заказ |
Бесплатно | |
|
Саратовский государственный технический университет 410054 г. Саратов, ул. Политехническая, 77 | |||
|
Копипринтер СГТУ, 410054, г. Саратов, ул. Политехническая, 77 | |||
1Все тепловые эффекты, приводимые в таблицах термодинамических величин, относятся к 250С.
