
- •Саратовский государственный технический университет
- •Введение
- •1. Тепловые эффекты химических реакций и калориметрия
- •1.1. Теоретическая часть
- •Основные понятия
- •Первый закон термодинамики
- •Второй закон термодинамики
- •Третий закон термодинамики
- •Энергетика химических реакций Тепловые эффекты химических реакций Количество теплоты. Уравнение теплового баланса
- •Термохимические законы Закон Гесса
- •Закон Кирхгофа
- •Закон Лавуазье-Ломоносова-Лапласа
- •Тепловые эффекты фазовых превращений
- •Направленность химических процессов
- •1.2. Экспериментальная часть Основы калориметрии
- •Типы калориметров
- •Работа №1. Определение содержания кислоты (концентрации) по тепловому эффекту нейтрализации
- •Работа №2. Исследование тепловых эффектов химических реакций.
- •Графическая обработка результатов эксперимента
- •1. Определение изменение температуры в ходе химической реакции.
- •2. Расчет систематической погрешности
- •3. Расчет погрешности в определении теплового эффекта реакции
- •Содержание и оформление отчета
- •Вопросы для самоконтроля
- •Задачи для самостоятельного решения
- •2. Идеальные растворы и их свойства
- •2.1. Теоретическая часть Растворы
- •Идеальные растворы
- •Свойства идеальных растворов Понижение давления насыщенного пара растворителя
- •Температура кристаллизации разбавленных растворов
- •Температура кипения разбавленных растворов
- •Изотонический коэффициент
- •Явление осмоса
- •Применение законов идеальных растворов
- •2.2. Экспериментальная часть Работа №1. Определение изотонического коэффициента и степени диссоциации электролита эбулиоскопическим методом
- •Работа №2 Определение молекулярной массы вещества криоскопическим методом
- •Обработка результатов эксперимента
- •Работа №3 Определение осмотического давления раствора неэлектролита
- •Вопросы для самоконтроля
- •Задачи для самостоятельного решения
- •3. Фазовые равновесия
- •3.1. Теоретическая часть
- •Фазовые диаграммы состояния систем
- •Однокомпонентные системы
- •Двухкомпонентные системы
- •Двухкомпонентные конденсированных системы
- •Диаграмма состояния системы с эвтектикой
- •Системы с образованием химических соединений, плавящихся конгруэнтно
- •Системы с образованием химических соединений, плавящихся инкогруэнтно
- •Системы с неограниченной растворимостью компонентов в жидком и ограниченной взаимной растворимостью в твердом состояниях
- •Системы с ограниченной взаимной растворимостью компонентов в жидком состоянии
- •Трехкомпонентные системы
- •3.2. Экспериментальная часть Работа № 1. Построение диаграммы состояния бинарной системы фенол-нафталин
- •Вопросы для самоконтроля
- •Пример решения задач
- •Задачи для самостоятельного решения
- •Литература
- •Приложение 1
- •Приложение 2
- •Оглавление
- •Лабораторный практикум по химической термодинамике
Применение законов идеальных растворов
Из приведенных в предыдущем разделе соотношений, в зависимости от того, какие характеристики раствора известны, а какие нет, можно получить следующую информацию:
Определить молекулярную массу растворенного вещества:
М= Kк·g·1000/G∙ΔTзамерз. или М= Kэ·g·1000/G∙ΔTкип.
Определить значение криоскопической или эбуллиоскопической постоянной для растворителя:
К=Т/С
Определить значение изотонического коэффициента, характеризующего поведение данного растворенного вещества в данном конкретном растворителе:
i=ΔT/К·С
Определить степень диссоциации растворенного вещества:
α =(i - 1) /n –1
Определить моляльную концентрацию растворенного вещества в растворе:
С= ΔTзамерз./К
6) определить осмотическое давление растворов неэлектролитов:
![]()
2.2. Экспериментальная часть Работа №1. Определение изотонического коэффициента и степени диссоциации электролита эбулиоскопическим методом
Цель: определение изотонического коэффициента и степени диссоциации электролита эбулиоскопическим методом.
Оборудование и химические реактивы: глицериновая баня, штатив, термометр, колба коническая, измерительный цилиндр, стеклянная палочка; навеска электролита, вода дистиллированная.
Порядок выполнения работы
Определение изотонического коэффициента и степени диссоциации электролита эбулиоскопическим методом производится с применением установки, схема которой представлена на рис. 2.4.
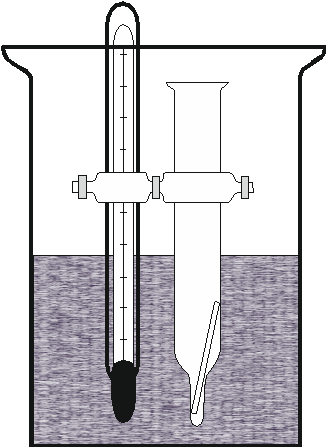
Рис. 2.4. Схема установки для проведения эксперимента
В коническую пробирку, соединенную с термометром, налить 0,5 мл растворителя (вода), так, чтобы жидкость находилась на уровне ртутного шарика.
Поместите в пробирку с жидкостью гранулу цеолита.
Термометр с пробиркой поместить в глицериновую баню и равномерно нагреть до тех пор, пока с поверхности цеолита не начнут непрерывно выделяться пузырьки воздуха (начало процесса кипения). Схема данной установки представлена на рисунке 2.4.
Повторите опыт с целью определения погрешности.
Зафиксируйте температуру кипения растворителя, запишите температуру закипания воды в таблицу.
Приготовьте в отдельной пробирке исследуемый раствор из навески исследуемого вещества (выдается преподавателем) и растворителя.
Доведите раствор электролита до кипения. Температурой кипения раствора считать момент закипания. Записать Т0 кипения раствора в таблицу.
Рассчитать Т0 кипения раствора по сравнению с чистым растворителем и записать полученный результат в таблицу.
Рассчитать Т0 кипения раствора по закону Рауля.
Рассчитать изотонический коэффициент i раствора электролита.
Рассчитать степень диссоциации электролита.
Заполнить таблицу 2.1.
Таблица 2.1
|
Ткип воды |
Ткип р-ра |
Ткип опыт. р-ра |
Ткип расч. р-ра |
i |
|
|
|
|
|
|
|
|
По величине степени диссоциации сделать вывод, сильным или слабым является данный электролит.
ТРЕБОВАНИЯ БЕЗОПАСТНОСТИ ТРУДА
При выполнении работы следует неукоснительно соблюдать правила работы в химической лаборатории.
