
- •Саратовский государственный технический университет
- •Введение
- •1. Тепловые эффекты химических реакций и калориметрия
- •1.1. Теоретическая часть
- •Основные понятия
- •Первый закон термодинамики
- •Второй закон термодинамики
- •Третий закон термодинамики
- •Энергетика химических реакций Тепловые эффекты химических реакций Количество теплоты. Уравнение теплового баланса
- •Термохимические законы Закон Гесса
- •Закон Кирхгофа
- •Закон Лавуазье-Ломоносова-Лапласа
- •Тепловые эффекты фазовых превращений
- •Направленность химических процессов
- •1.2. Экспериментальная часть Основы калориметрии
- •Типы калориметров
- •Работа №1. Определение содержания кислоты (концентрации) по тепловому эффекту нейтрализации
- •Работа №2. Исследование тепловых эффектов химических реакций.
- •Графическая обработка результатов эксперимента
- •1. Определение изменение температуры в ходе химической реакции.
- •2. Расчет систематической погрешности
- •3. Расчет погрешности в определении теплового эффекта реакции
- •Содержание и оформление отчета
- •Вопросы для самоконтроля
- •Задачи для самостоятельного решения
- •2. Идеальные растворы и их свойства
- •2.1. Теоретическая часть Растворы
- •Идеальные растворы
- •Свойства идеальных растворов Понижение давления насыщенного пара растворителя
- •Температура кристаллизации разбавленных растворов
- •Температура кипения разбавленных растворов
- •Изотонический коэффициент
- •Явление осмоса
- •Применение законов идеальных растворов
- •2.2. Экспериментальная часть Работа №1. Определение изотонического коэффициента и степени диссоциации электролита эбулиоскопическим методом
- •Работа №2 Определение молекулярной массы вещества криоскопическим методом
- •Обработка результатов эксперимента
- •Работа №3 Определение осмотического давления раствора неэлектролита
- •Вопросы для самоконтроля
- •Задачи для самостоятельного решения
- •3. Фазовые равновесия
- •3.1. Теоретическая часть
- •Фазовые диаграммы состояния систем
- •Однокомпонентные системы
- •Двухкомпонентные системы
- •Двухкомпонентные конденсированных системы
- •Диаграмма состояния системы с эвтектикой
- •Системы с образованием химических соединений, плавящихся конгруэнтно
- •Системы с образованием химических соединений, плавящихся инкогруэнтно
- •Системы с неограниченной растворимостью компонентов в жидком и ограниченной взаимной растворимостью в твердом состояниях
- •Системы с ограниченной взаимной растворимостью компонентов в жидком состоянии
- •Трехкомпонентные системы
- •3.2. Экспериментальная часть Работа № 1. Построение диаграммы состояния бинарной системы фенол-нафталин
- •Вопросы для самоконтроля
- •Пример решения задач
- •Задачи для самостоятельного решения
- •Литература
- •Приложение 1
- •Приложение 2
- •Оглавление
- •Лабораторный практикум по химической термодинамике
Двухкомпонентные конденсированных системы
К основным типам диаграмм состояния двухкомпонентных конденсированных систем относятся:
диаграмма с простой эвтектикой;
диаграмма с образованием устойчивого химического соединения (конгруэнтно плавящегося);
диаграмма с образованием неустойчивого химического соединения (инконгруэнтно плавящегося);
диаграмма с неограниченной взаимной растворимостью компонентов в твердом состоянии;
диаграмма с ограниченной растворимостью компонентов в твердом состоянии (I и II вида);
диаграмма с ограниченной взаимной растворимостью компонентов в жидком состоянии.
Для изучения равновесия кристаллы – жидкий раствор широко применяются диаграммы плавкости, выражающие зависимость температур плавления смесей от их состава. Частным случаем диаграмм плавкости являются диаграммы растворимости, характеризующие зависимость растворимости твердых веществ в жидкостях от температуры.
Вид диаграмм плавкости определяется взаимной растворимостью компонентов в жидком и твердом состояниях.
Диаграмма состояния системы с эвтектикой
Наиболее проста диаграмма состояния системы, в которой компоненты неограниченного смешиваются в жидком состоянии, совершенно не смешиваются в твердом, химически не взаимодействуют друг с другом и не образуют твердых растворов.
Образование таких диаграмм наблюдается, как правило, в том случае, когда компоненты А и В имеют разные типы кристаллических решеток и различные размеры радиусов частиц решетки, или при наличии одинакового типа решетки резко различные радиусы частиц.
В системах, не образующих химических соединений, при охлаждении расплава любого состава всегда кристаллизуются чистые компоненты. Диаграмма плавкости для одной из таких систем приведена на рис. 3.6.
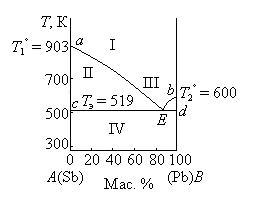
Рис. 3.6. Диаграмма плавкости системы Sb – Pb при Р = const
На данной диаграмме фигуративные точки а и b изображают температуры плавления (кристаллизации) чистых компонентов А и В (T1o и T2o). При этих температурах системы условно инварианты (Сусл = 1 – 2 + 1 = 0). При температурах выше T1o или T2o соответствующие чистые компоненты находятся в расплаве (Сусл = 1 – 1 + 1 = 1), при температурах ниже T1o или T2o – в твердом состоянии (Сусл =1 – 1 + 1 = 1). Фигуративные точки, лежащие на кривых аЕ и bЕ, характеризуют температуры, при которых из жидких расплавов начинается кристаллизация компонента А или В. Эти температуры ниже соответственно T1o или T2o. Одновременно фигуративные точки, лежащие на кривых аЕ и bЕ, изображают составы жидких расплавов, при охлаждении которых начинается кристаллизация из расплава чистого компонента А или В. Линии аЕ и bЕ называются линиями ликвидуса (от латинского слова liguor – жидкость).
В отличие от чистых компонентов кристаллизация (плавление) большинства двухкомпонентных систем происходит не при постоянной температуре, а в температурном интервале, который определяется составом системы. Минимальная температура, при которой заканчивается кристаллизация расплава любого состава (или начинается плавление твердой двухкомпонентной системы), называется эвтектической температурой (Tэ). Линия cd, отвечающая эвтектической температуре (ниже которой не может существовать жидкая фаза), называется линией солидуса (от латинского слова solid – твердый). Фигуративная точка Е – точка пересечения линий ликвидуса с линией солидуса – характеризует состав расплава, который находится в равновесии одновременно с кристаллами компонентов А и В. Точка Е называется эвтектической точкой, а соответствующий расплав – эвтектическим расплавом. Смесь кристаллов компонентов А и В, выпадающая из этого расплава при температуре Tэ, называется эвтектической смесью или просто эвтектикой (от греческого слова eutektik – хорошо плавящийся). Эвтектика кристаллизуется при постоянной температуре, система условно инвариантна (Сусл = 2 – 3 + 1 = 0). В этом состоит сходство эвтектики с чистыми компонентами. Однако между эвтектикой и чистыми компонентами есть и различия. Главное различие состоит в том, что при изменении давления, как следует из правила фаз, меняется и температура плавления, и состав эвтектики, тогда как у чистых компонентов изменяется только температура плавления. Кроме того, при кристаллизации чистого компонента из его расплава состав твердой фазы одинаков с составом жидкого расплава. При кристаллизации эвтектики состав жидкого расплава отличается от состава каждой из равновесных с ним твердых фаз.
Линии ликвидуса и солидуса делят диаграмму плавкости на ряд областей:
I – жидкий расплав (Сусл = 2 – 1 + 1 = 2),
II – жидкий расплав и кристаллы компонента А (Сусл = 2 – 2 + 1 = 1),
III – жидкий расплав и кристаллы компонента В (Сусл = 2 – 2 + 1 = 1),
IV – кристаллы компонентов А и В (Сусл = 2 – 2 + 1 = 1).
При температурах ниже эвтектической система условно моновариантна. При сохранении постоянства состава равновесных твердых фаз произвольно можно изменять только температуру.
Диаграммы плавкости с простой эвтектикой, состоящей из чистых компонентов, встречаются довольно часто среди металлических, солевых, органических систем, например, системы Ag – Pb, Zn – Sn, Bi – Cd, KCl – LiCl, AgBr – KBr, хлорид бензоила – дифенил. Диаграммы состояния аналогичного вида характерны и для многих водных солевых систем (диаграммы растворимости), при охлаждении которых кристаллизуются эвтектические смеси, состоящие из воды и солей, называемые криогидратами. Например, системы NH4C1 – H2O, NaNO3 – Н2О. Явления, связанные с образованием и свойствами эвтектик, известны очень давно. Эвтектики широко применяются для практических целей. Так, для пайки свинцовых водопроводных труб издавна используется легкоплавкий припой – третник, состоящий из двух частей олова и одной части свинца, очень близкий по составу к эвтектическому сплаву этих металлов. Эвтектические смеси, действие которых основано на поглощении теплоты при образовании жидких эвтектик из некоторых солей и снега, применяются и для получения искусственного холода. Например, смесь шестиводного хлорида кальция со снегом дает понижение температуры до – 50°С.
