
- •Саратовский государственный технический университет
- •Введение
- •1. Тепловые эффекты химических реакций и калориметрия
- •1.1. Теоретическая часть
- •Основные понятия
- •Первый закон термодинамики
- •Второй закон термодинамики
- •Третий закон термодинамики
- •Энергетика химических реакций Тепловые эффекты химических реакций Количество теплоты. Уравнение теплового баланса
- •Термохимические законы Закон Гесса
- •Закон Кирхгофа
- •Закон Лавуазье-Ломоносова-Лапласа
- •Тепловые эффекты фазовых превращений
- •Направленность химических процессов
- •1.2. Экспериментальная часть Основы калориметрии
- •Типы калориметров
- •Работа №1. Определение содержания кислоты (концентрации) по тепловому эффекту нейтрализации
- •Работа №2. Исследование тепловых эффектов химических реакций.
- •Графическая обработка результатов эксперимента
- •1. Определение изменение температуры в ходе химической реакции.
- •2. Расчет систематической погрешности
- •3. Расчет погрешности в определении теплового эффекта реакции
- •Содержание и оформление отчета
- •Вопросы для самоконтроля
- •Задачи для самостоятельного решения
- •2. Идеальные растворы и их свойства
- •2.1. Теоретическая часть Растворы
- •Идеальные растворы
- •Свойства идеальных растворов Понижение давления насыщенного пара растворителя
- •Температура кристаллизации разбавленных растворов
- •Температура кипения разбавленных растворов
- •Изотонический коэффициент
- •Явление осмоса
- •Применение законов идеальных растворов
- •2.2. Экспериментальная часть Работа №1. Определение изотонического коэффициента и степени диссоциации электролита эбулиоскопическим методом
- •Работа №2 Определение молекулярной массы вещества криоскопическим методом
- •Обработка результатов эксперимента
- •Работа №3 Определение осмотического давления раствора неэлектролита
- •Вопросы для самоконтроля
- •Задачи для самостоятельного решения
- •3. Фазовые равновесия
- •3.1. Теоретическая часть
- •Фазовые диаграммы состояния систем
- •Однокомпонентные системы
- •Двухкомпонентные системы
- •Двухкомпонентные конденсированных системы
- •Диаграмма состояния системы с эвтектикой
- •Системы с образованием химических соединений, плавящихся конгруэнтно
- •Системы с образованием химических соединений, плавящихся инкогруэнтно
- •Системы с неограниченной растворимостью компонентов в жидком и ограниченной взаимной растворимостью в твердом состояниях
- •Системы с ограниченной взаимной растворимостью компонентов в жидком состоянии
- •Трехкомпонентные системы
- •3.2. Экспериментальная часть Работа № 1. Построение диаграммы состояния бинарной системы фенол-нафталин
- •Вопросы для самоконтроля
- •Пример решения задач
- •Задачи для самостоятельного решения
- •Литература
- •Приложение 1
- •Приложение 2
- •Оглавление
- •Лабораторный практикум по химической термодинамике
Свойства идеальных растворов Понижение давления насыщенного пара растворителя
Изучение свойств идеальных растворов начинают с установления зависимости между давлением компонента и его концентрацией в растворе.
С поверхности жидкого или твердого тела при любой температуре происходит испарение частиц. С другой стороны, происходит и уменьшаем этим число теле понента, умноженному на его мольную долю, в растворе.льно его и обратный процесс захвата поверхностью частиц из газопаровой фазы (адсорбция). Между этими процессами устанавливается динамическое равновесие и давление паров над жидкостью или твердым телом при фиксированной температуре является вполне определенной величиной. Пар, находящийся в равновесии с жидкостью или твердым телом называется насыщенным.
Переход одного из компонентов раствора (например, растворителя) в газообразную фазу тем значительнее, чем больше относительное содержание молекул данного вещества, давление компонента над раствором должно быть пропорционально его мольной доле в растворе, т. е. РА = const NА. Коэффициент пропорциональности определяется из начального условия: если NА = 1, то РА0 = const, т. е. постоянная равна давлению чистого компонента.
Парциальное давление компонента идеального раствора равно давлению чистого компонента, умноженному на его мольную долю, в растворе:
|
РА = NА ∙ РА0. |
(2.1) |
Растворяя небольшое количество какого-нибудь вещества в данном растворителе, мы, естественно понижаем концентрацию молекул последнего в единице объема (т. е. уменьшается N1) и уменьшаем этим число молекул, вылетающих в единицу времени из жидкой фазы в парообразную (т. е. уменьшается значение Р1). В результате равновесие между жидкостью и паром установится при меньшей концентрации пара, т. е. при меньшем его давлении. Следовательно, давление насыщенного пара растворителя над раствором всегда меньше, чем над чистым растворителем. При этом понижение давления пара будет тем больше, чем больше концентрация растворенного вещества в растворе.
Обозначим буквой А растворитель, а буквой В – растворенное вещество. Концентрация растворенного вещества в растворе при выражении ее в мольных долях этого вещества NB связана с NA простым соотношением NA + NB =1. Определяя отсюда NА и подставляя в (2.1), получаем
|
PА = (1 - NB) ∙ РА0. |
(2.2) |
В графической форме это соотношение представлено на рисунке 2.1.
Точка Р0А отвечает давлению пара над чистым компонентом А, а точка РА – давлению насыщенного пара компонента А над раствором.
Из этого соотношения следует, что
|
(Р0А - РА)/ Р0А = NB. |
(2.3) |
Разность (Р0А - РА) называется понижением давления насыщенного пара, а отношение (Р0А - РА)/Р0А относительным понижением давления насыщенного пара.
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества в растворе. Это соотношение называется законом Рауля (1887).

Рис. 2.1. Понижение давления пара растворителя над раствором
По мере повышения концентрации в большинстве растворов возникают отклонения от этой зависимости, различные как по величине, так и по направлению. Систематические отклонения другого характера обнаруживают водные растворы солей, кислот и оснований как концентрированные, так и разбавленные. Вследствие электролитической диссоциации в этих растворах находится в действительности большее число частиц, чем было бы недиссоциированных молекул, что вызывает всегда большее понижение давления пара.
Отклонения от закона Рауля могут быть положительными и отрицательными. Положительные отклонения объясняются тем, что сила взаимодействия между частицами растворенного вещества и растворителя (А-В) мала по сравнению с силами взаимодействия между частицами одного и того же вещества (А-А и В-В). В этом случае связывание компонентов в растворе уменьшается, а летучесть – возрастает. Образование такого раствора обычно сопровождается увеличением объема и выделением тепла (например, раствор этилового спирта и диэтилового эфира).
Для растворов с отрицательным отклонением от закона Рауля характерно уменьшение давления паров над раствором, по сравнению с идеальными растворами. Эти отклонения связаны с более сильным взаимодействием между частицами компонентов раствора по сравнению с чистыми компонентами. Отрицательные отклонения наблюдаются для растворов, склонных к образованию сольватов, ассоциатов и т. п. Образование таких растворов сопровождается обычно уменьшением объема и выделением тепла. Парообразование с поверхности такого раствора затруднено, что и вызывает отрицательные отклонения.
Если растворенное вещество нелетучее или малолетучее, то при относительно невысоких концентрациях в растворе можно пренебречь давлением его паров над раствором. Следовательно,
Р0 = Р1 + Р2 = Р0∙N1, N1 + N2 = 1.
То есть давление паров растворителя над раствором всегда ниже, чем над чистым растворителем, так как его доля в растворе всегда меньше единицы.
Данная закономерность известна как другая формулировка закона Рауля, согласно которой относительное понижение давления паров растворителя над раствором (∆Р) по сравнению с чистым растворителем равно мольной доле растворенного вещества (N2):
|
|
(2.4) |
На рис. 2.2 приведены кривые, иллюстрирующие влияние концентрации растворенного вещества на давление насыщенного пара над поверхностью раствора. Известно, что жидкость закипает при той температуре, когда давление насыщающих паров над ней достигает внешнего (например, атмосферного) давления.
Следовательно, чем ниже давление насыщающих паров над раствором, тем при более высокой температуре он будет закипать (дополнительное повышение температуры необходимо для того, чтобы достичь внешнего давления).
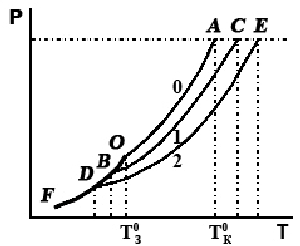
Рис. 2.2. Зависимость температуры кипения и отвердевания растворов от их концентрации.
Кривая 0 соответствует зависимости давления насыщающих паров растворителя от температуры для чистого растворителя, а кривые 1 и 2 - для различных растворов. При этом концентрация 2-го раствора (кривая 2) выше концентрации 1-го раствора (кривая 1).
