
- •Саратовский государственный технический университет
- •Введение
- •1. Тепловые эффекты химических реакций и калориметрия
- •1.1. Теоретическая часть
- •Основные понятия
- •Первый закон термодинамики
- •Второй закон термодинамики
- •Третий закон термодинамики
- •Энергетика химических реакций Тепловые эффекты химических реакций Количество теплоты. Уравнение теплового баланса
- •Термохимические законы Закон Гесса
- •Закон Кирхгофа
- •Закон Лавуазье-Ломоносова-Лапласа
- •Тепловые эффекты фазовых превращений
- •Направленность химических процессов
- •1.2. Экспериментальная часть Основы калориметрии
- •Типы калориметров
- •Работа №1. Определение содержания кислоты (концентрации) по тепловому эффекту нейтрализации
- •Работа №2. Исследование тепловых эффектов химических реакций.
- •Графическая обработка результатов эксперимента
- •1. Определение изменение температуры в ходе химической реакции.
- •2. Расчет систематической погрешности
- •3. Расчет погрешности в определении теплового эффекта реакции
- •Содержание и оформление отчета
- •Вопросы для самоконтроля
- •Задачи для самостоятельного решения
- •2. Идеальные растворы и их свойства
- •2.1. Теоретическая часть Растворы
- •Идеальные растворы
- •Свойства идеальных растворов Понижение давления насыщенного пара растворителя
- •Температура кристаллизации разбавленных растворов
- •Температура кипения разбавленных растворов
- •Изотонический коэффициент
- •Явление осмоса
- •Применение законов идеальных растворов
- •2.2. Экспериментальная часть Работа №1. Определение изотонического коэффициента и степени диссоциации электролита эбулиоскопическим методом
- •Работа №2 Определение молекулярной массы вещества криоскопическим методом
- •Обработка результатов эксперимента
- •Работа №3 Определение осмотического давления раствора неэлектролита
- •Вопросы для самоконтроля
- •Задачи для самостоятельного решения
- •3. Фазовые равновесия
- •3.1. Теоретическая часть
- •Фазовые диаграммы состояния систем
- •Однокомпонентные системы
- •Двухкомпонентные системы
- •Двухкомпонентные конденсированных системы
- •Диаграмма состояния системы с эвтектикой
- •Системы с образованием химических соединений, плавящихся конгруэнтно
- •Системы с образованием химических соединений, плавящихся инкогруэнтно
- •Системы с неограниченной растворимостью компонентов в жидком и ограниченной взаимной растворимостью в твердом состояниях
- •Системы с ограниченной взаимной растворимостью компонентов в жидком состоянии
- •Трехкомпонентные системы
- •3.2. Экспериментальная часть Работа № 1. Построение диаграммы состояния бинарной системы фенол-нафталин
- •Вопросы для самоконтроля
- •Пример решения задач
- •Задачи для самостоятельного решения
- •Литература
- •Приложение 1
- •Приложение 2
- •Оглавление
- •Лабораторный практикум по химической термодинамике
Системы с ограниченной взаимной растворимостью компонентов в жидком состоянии
Растворы жидкостей в жидкостях очень разнообразны по своей природе и свойствам. Растворимость жидкостей в жидкостях зависит от природы растворителя и растворенного вещества, температуры, присутствия в растворе посторонних веществ. Существуют растворы с неограниченной взаимной растворимостью, ограниченной взаимной растворимостью и с практически полной взаимной нерастворимостью жидкостей.
Рассмотрим системы с ограниченной взаимной растворимостью жидкостей. Ограниченная взаимная растворимость двух жидкостей наблюдается в системах со значительным отклонением от идеальной. Растворимость таких жидкостей зависит от температуры. В одних системах взаимная растворимость жидкостей с ростом температуры увеличивается (системы с верхней критической температурой растворения), в других уменьшается (системы с нижней критической температурой растворения).
Под критической температурой растворения понимают ту температуру, при которой составы двух равновесных жидких фаз одинаковы.
Для изображения зависимости взаимной растворимости жидкостей от температуры при постоянном давлении строят диаграммы состояния в координатах температура – состав (диаграммы растворимости). Такая диаграмма состояния для системы с верхней критической температурой растворения приведена на рис. 3.10. На этой диаграмме кривая akb, называемая кривой расслоения, делит диаграмму на две области: гомогенную, лежащую над кривой расслоения, и гетерогенную, находящуюся под кривой расслоения. Фигуративные точки внутри гомогенной области, например точка d, изображают состояние однофазной условно бивариантной системы (Сусл = 2 – 1 + 1= 2). Фигуративные точки, лежащие внутри гетерогенной области, например точка О, изображают состояние двухфазной условно моновариантной системы (Сусл = 2 – 2 + 1 = 1).
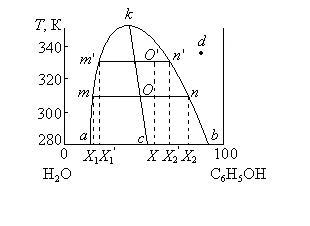
Рис. 3.11. Диаграмма растворимости системы вода-фенол с верхней критической температурой растворения при P = const
Составы равновесных жидких фаз определяются по правилу соединительной прямой, согласно которому фигуративные точки, изображающие состав всей системы в целом и составы отдельных равновесных фаз, лежат на одной прямой, называемой нодой (или коннодой), которая для двухкомпонентных систем параллельна оси состава. Так система состава X, изображенная на диаграмме точкой О (рис. 3.11), при температуре 310 К распадается на две равновесные жидкие фазы m и n состава X1 и X2. Характерной особенностью расслаивающихся систем является то, что с изменением состава всей системы при данной температуре составы отдельных равновесных фаз остаются неизменными, а изменяется только их количественное соотношение. С изменением температуры составы равновесных жидких фаз изменяются. Так, при повышении температуры от 310 до 330 К (рис. 3.10) состав слоя m изменяется от X1 до X1′, а слоя n – от X2 до X2′. При критической температуре растворения оба жидких раствора по составу тождественны, и система, изображенная на диаграмме точкой k, при Р = const является условно инвариантной (Сусл = 2 – 2 = 0).
Положение критической точки k на диаграмме определяется по правилу Алексеева: середины нод, расположенных между точками, изображающими составы равновесных жидких фаз при разных температурах, лежат на одной прямой, идущей от критической точки (прямая kc на рис. 3.10). Для большинства систем линия kc не перпендикулярна оси состава.
Системы с неограниченной взаимной растворимостью компонентов в жидком и твердом состояниях (изоморфные смеси)
Изоморфные смеси – это кристаллические фазы переменного состава, образованные двумя или более изоморфными компонентами. Под изоморфными компонентами понимают кристаллические вещества, аналогичные по химическому составу и по структуре, способные образовывать кристаллы смешанного состава. Основным признаком изоморфных веществ является способность их атомов или ионов к взаимному замещению с образованием твердых растворов.
Твердые растворы – гомогенные системы переменного состава, состоящие из двух или более компонентов.
В отличие от механической смеси твердый раствор является однофазным, состоит из одного вида кристаллов и имеет одну кристаллическую решетку. В отличие от химического соединения твердый раствор существует не при строго определенном соотношении компонентов, а в интервале концентраций.
Строение твердых растворов на основе одного из компонентов системы таково, что в кристаллическую решетку одного компонента входят атомы другого компонента системы. Различают твердые растворы трех типов: внедрения, замещения и вычитания.
Твердые растворы внедрения – растворы, при кристаллизации которых частицы (атомы, молекулы или ионы) одного компонента размещаются между узлами кристаллической решетки другого компонента. Они могут образовываться лишь при условии, что размеры частиц компонента, растворяющегося путем внедрения, невелики. Так, в металлических сплавах диаметр атома растворяемого вещества обычно не превышает 0,6 диаметра атома основного металла – растворителя (растворение в металлах неметаллов – бора, углерода, водорода, азота).
По мере накопления внедряемого вещества устойчивость кристаллической решетки растворителя уменьшается. Поэтому концентрация растворяемого вещества не может быть выше некоторого предела – ограниченная растворимость.
Твердые растворы замещения – растворы, при кристаллизации которых частицы (атомы или ионы) растворяемого вещества замещают в узлах кристаллической решетки частицы растворителя. Для образования твердых растворов замещения необходимо, чтобы кристаллические структуры замещающего и замещаемого компонентов были достаточно близки, и чтобы радиусы атомов или ионов компонентов различались не очень сильно. При этих условиях замещение не вызывает чрезмерных напряжений в кристаллической решетке и устойчивыми могут быть твердые растворы любого состава. Таким образом, компоненты бинарной смеси, образующие твердые растворы замещения, могут быть неограниченно растворимы один в другом, и образовывать непрерывный ряд твердых растворов от 0 до 100% каждого из компонентов. Примером таких растворов может служить система AgCl-NaCl. Кристаллическая решетка обоих компонентов – кубическая гранецентрированная, длина ребра куба элементарной ячейки AgCl составляет 5,56 Ǻ, у NaCl 5,63 Ǻ; радиусы ионов серебра и натрия соответственно равны 1,13 Ǻ и 0,98 Ǻ.
Твердые растворы вычитания – растворы, образование которых связано с дефектами структуры, в которой имеются вакантные (не занятые) места.
Необходимо подчеркнуть, что в твердом растворе внедренные или замещенные атомы располагаются в хаотическом беспорядке. Об их равномерном распределении во всем кристалле можно говорить только в статистическом смысле, т.е. сопоставляя объемы, содержащие достаточно большое число кристаллических ячеек.
Для систем с неограниченной взаимной растворимостью компонентов как в жидком, так и в твердом состоянии известны три типа диаграмм плавкости, примеры которых приведены на рис. 3.12–3.14. Области существования и равновесные фазы указаны на диаграммах. Твердыми фазами в таких двухкомпонентных системах являются твердые растворы с неограниченной растворимостью компонентов в твердом состоянии. Характерной особенностью диаграмм плавкости таких систем является отсутствие эвтектик. На этих диаграммах верхние кривые – линии ликвидуса, нижние кривые – линии солидуса. В системах первого типа (рис.3.12) при увеличении концентрации компонента В в расплаве температура начала кристаллизации из него твердого раствора непрерывно повышается. Линия ликвидуса имеет вид непрерывной кривой, все точки которой лежат между температурами кристаллизации чистых компонентов А и В.

Рис. 3.12. Диаграмма плавкости системы Cu – Ni при Р = const:
1 – расплав + кристаллы твердого раствора

Рис. 3.13. Диаграмма плавкости системы Co – Cr при Р = const:
1 – расплав + кристаллы твердого раствора
В системах второго типа (рис. 3.13) температура начала кристаллизации твердого раствора из расплава понижается при добавлении одного компонента к другому до точки О на линии ликвидуса, имеющей вид непрерывной кривой, проходящей через максимум, а затем повышается.
В системах третьего типа (рис. 3.14) температура начала кристаллизации твердого раствора из расплава повышается при добавлении одного компонента к другому до точки О на линии ликвидуса, имеющей вид непрерывной кривой, проходящей через максимум, а затем понижается.

Рис. 3.14. Диаграмма плавкости системы Mn – C при Р = const:
1, 2 – расплав + кристаллы твердого раствора
При кристаллизации из расплава твердого раствора в большинстве случаев изменяется состав как расплава, так и твердого раствора. Согласно первому правилу Гиббса – Розебома, твердый раствор по сравнению с жидким расплавом, находящимся с ним в равновесии, богаче тем компонентом, прибавление которого к расплаву приводит к повышению температуры начала кристаллизации твердого раствора. В соответствии со вторым правилом Гиббса – Розебома в точках минимума и максимума на кривых температур плавления (кристаллизации) твердый раствор и находящийся с ним в равновесии жидкий расплав имеют одинаковый состав. Система, изображенная на диаграмме плавкости фигуративной точкой O (рис. 12, 13), при Р = const условно инвариантна (Сусл = 2 – 2 = 0).
Системы с неограниченной взаимной растворимостью компонентов в жидком и твердом состояниях встречаются довольно часто. Наиболее распространенными являются системы первого и второго типа. Примерами систем первого типа могут служить системы Ag – Аu, Со – Ni, Fe – Co, Mo – W, РbСl2 – SnCl2. Примерами систем второго типа являются системы Аu – Сu, Со – Сr, Мn – Ni, KCl – КВr, СаСl2 – SnCl2.
