
- •Саратовский государственный технический университет
- •Введение
- •1. Тепловые эффекты химических реакций и калориметрия
- •1.1. Теоретическая часть
- •Основные понятия
- •Первый закон термодинамики
- •Второй закон термодинамики
- •Третий закон термодинамики
- •Энергетика химических реакций Тепловые эффекты химических реакций Количество теплоты. Уравнение теплового баланса
- •Термохимические законы Закон Гесса
- •Закон Кирхгофа
- •Закон Лавуазье-Ломоносова-Лапласа
- •Тепловые эффекты фазовых превращений
- •Направленность химических процессов
- •1.2. Экспериментальная часть Основы калориметрии
- •Типы калориметров
- •Работа №1. Определение содержания кислоты (концентрации) по тепловому эффекту нейтрализации
- •Работа №2. Исследование тепловых эффектов химических реакций.
- •Графическая обработка результатов эксперимента
- •1. Определение изменение температуры в ходе химической реакции.
- •2. Расчет систематической погрешности
- •3. Расчет погрешности в определении теплового эффекта реакции
- •Содержание и оформление отчета
- •Вопросы для самоконтроля
- •Задачи для самостоятельного решения
- •2. Идеальные растворы и их свойства
- •2.1. Теоретическая часть Растворы
- •Идеальные растворы
- •Свойства идеальных растворов Понижение давления насыщенного пара растворителя
- •Температура кристаллизации разбавленных растворов
- •Температура кипения разбавленных растворов
- •Изотонический коэффициент
- •Явление осмоса
- •Применение законов идеальных растворов
- •2.2. Экспериментальная часть Работа №1. Определение изотонического коэффициента и степени диссоциации электролита эбулиоскопическим методом
- •Работа №2 Определение молекулярной массы вещества криоскопическим методом
- •Обработка результатов эксперимента
- •Работа №3 Определение осмотического давления раствора неэлектролита
- •Вопросы для самоконтроля
- •Задачи для самостоятельного решения
- •3. Фазовые равновесия
- •3.1. Теоретическая часть
- •Фазовые диаграммы состояния систем
- •Однокомпонентные системы
- •Двухкомпонентные системы
- •Двухкомпонентные конденсированных системы
- •Диаграмма состояния системы с эвтектикой
- •Системы с образованием химических соединений, плавящихся конгруэнтно
- •Системы с образованием химических соединений, плавящихся инкогруэнтно
- •Системы с неограниченной растворимостью компонентов в жидком и ограниченной взаимной растворимостью в твердом состояниях
- •Системы с ограниченной взаимной растворимостью компонентов в жидком состоянии
- •Трехкомпонентные системы
- •3.2. Экспериментальная часть Работа № 1. Построение диаграммы состояния бинарной системы фенол-нафталин
- •Вопросы для самоконтроля
- •Пример решения задач
- •Задачи для самостоятельного решения
- •Литература
- •Приложение 1
- •Приложение 2
- •Оглавление
- •Лабораторный практикум по химической термодинамике
Явление осмоса
Осмос – это переход молекул растворителя из области с более высокой их концентрацией в область с более низкой концентрацией через полупроницаемую мембрану. Осмос – особый вид диффузии. Во всех биологических системах растворителем служит вода. Некоторые мембраны (их называют обычно полупроницаемыми) пропускают только молекулы растворителя, задерживая все молекулы или ионы растворенного вещества. Однако мембраны живых клеток пропускают определенные молекулы или ионы содержащихся в растворителе веществ, проявляя в этом отношении избирательность, которая зависит от природы мембраны. Такие мембраны называют не полупроницаемыми, а дифференциально (избирательно) проницаемыми.
Допустим, что водяной раствор А с высокой концентрацией растворенного вещества отделен избирательно проницаемой мембраной от водного раствора В с низкой концентрацией этого вещества. Раствор А по отношению к раствору В является гипертоническим, а раствор В по отношению к раствору А гипотоническим (растворы с одинаковым осмотическим давлением называются изотоническими). В этих условиях будет наблюдаться реальное перемещение молекул воды (растворителя) через полупроницаемую мембрану. Это будет происходить до тех пор, пока не наступит равновесие, после чего реального перемещения воды наблюдаться уже не будет - растворы станут изотоническими (равными по концентрации).
Если какой-либо раствор отделен избирательно проницаемой мембраной от чистой воды, то гидростатическое давление, которое необходимо приложить, чтобы предотвратить осмотическое поступление воды в раствор, называют осмотическим давлением этого раствора. Чем выше концентрация раствора, тем выше его осмотическое давление. Измерить осмотическое давление какого-либо раствора как реальное давление можно только в приборе, который называется осмометром. В обычных условиях осмотическое давление раствора - это потенциальное давление, поэтому вместо термина «осмотическое давление» часто употребляют термин «осмотический потенциал». Осмотический потенциал, обозначаемый греческой буквой π (пи), принято выражать отрицательной величиной. Для молярного раствора сахарозы, например, при 200C осмотическое давление равно 3510 Па, а осмотический потенциал равен - 3510 Па. Чем выше концентрация раствора, тем выше осмотическое давление и тем ниже его осмотический потенциал.
Осмотическое давление можно измерить на опыте по высоте поднятия раствора в трубке с полупроницаемой пленкой (рис. 2.3). Поместим раствор в маленький сосуд В, затянутый снизу полупроницаемой пленкой - бычьим пузырем и снабженный высокой трубкой С (достаточно широкой, чтобы можно было не учитывать явление капиллярности).
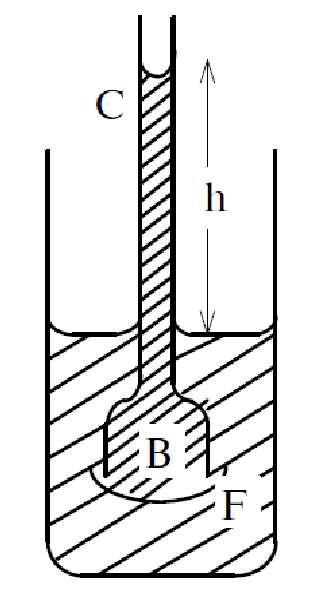
Рис. 2.3. Осмометр.
Сосуд В погрузим в больший сосуд F, заполненный водой. Тогда раствор начнет подниматься по трубке и остановится на некоторой высоте h. Объяснение этому явлению такое: в момент опускания сосуда В в воду число молекул в 1 см3 в сосуде В меньше, чем в сосуде F: молекулы воды начнут диффундировать туда, где концентрация молекул воды меньше, т.е. в сосуд В. В результате возникнет гидростатическое давление жидкости в трубке (р'). Когда давление, оказываемое водой на пленку, в сосуде В возрастет от р' до р (р – давление со стороны молекул воды в сосуде F), преимущественный переход воды в раствор прекратиться. Но р = р' +Росм, следовательно р - р' = ρgh = Росм. Сравнивая эти формулы, находим:
|
Росм = ρgh, |
(2.13) |
где ρ - плотность раствора, h - разность уровней жидкости в сосуде и трубке В.
Таким образом, измерив высоту столба жидкости в трубке, можно рассчитать осмотическое давление раствора.
Теорией растворов занимался голландский химик Вант-Гофф. В частности, он предположил, что в случае слабых растворов молекулы растворенного вещества настолько удалены друг от друга, что силовое взаимодействие между ними практически отсутствует; поэтому их можно уподобить молекулам идеального газа, движущимся не в вакууме, а в растворителе. Поэтому, по Вант-Гоффу, для вычисления осмотического давления можно воспользоваться уравнением Менделеева-Клапейрона:
|
|
(2.14) |
где V - объем, занимаемый раствором; m - масса растворенного вещества; М - его молекулярный вес; Т - абсолютная температура; R – универсальная газовая постоянная (8,314 Дж/моль·К).
