
- •Саратовский государственный технический университет
- •Введение
- •1. Тепловые эффекты химических реакций и калориметрия
- •1.1. Теоретическая часть
- •Основные понятия
- •Первый закон термодинамики
- •Второй закон термодинамики
- •Третий закон термодинамики
- •Энергетика химических реакций Тепловые эффекты химических реакций Количество теплоты. Уравнение теплового баланса
- •Термохимические законы Закон Гесса
- •Закон Кирхгофа
- •Закон Лавуазье-Ломоносова-Лапласа
- •Тепловые эффекты фазовых превращений
- •Направленность химических процессов
- •1.2. Экспериментальная часть Основы калориметрии
- •Типы калориметров
- •Работа №1. Определение содержания кислоты (концентрации) по тепловому эффекту нейтрализации
- •Работа №2. Исследование тепловых эффектов химических реакций.
- •Графическая обработка результатов эксперимента
- •1. Определение изменение температуры в ходе химической реакции.
- •2. Расчет систематической погрешности
- •3. Расчет погрешности в определении теплового эффекта реакции
- •Содержание и оформление отчета
- •Вопросы для самоконтроля
- •Задачи для самостоятельного решения
- •2. Идеальные растворы и их свойства
- •2.1. Теоретическая часть Растворы
- •Идеальные растворы
- •Свойства идеальных растворов Понижение давления насыщенного пара растворителя
- •Температура кристаллизации разбавленных растворов
- •Температура кипения разбавленных растворов
- •Изотонический коэффициент
- •Явление осмоса
- •Применение законов идеальных растворов
- •2.2. Экспериментальная часть Работа №1. Определение изотонического коэффициента и степени диссоциации электролита эбулиоскопическим методом
- •Работа №2 Определение молекулярной массы вещества криоскопическим методом
- •Обработка результатов эксперимента
- •Работа №3 Определение осмотического давления раствора неэлектролита
- •Вопросы для самоконтроля
- •Задачи для самостоятельного решения
- •3. Фазовые равновесия
- •3.1. Теоретическая часть
- •Фазовые диаграммы состояния систем
- •Однокомпонентные системы
- •Двухкомпонентные системы
- •Двухкомпонентные конденсированных системы
- •Диаграмма состояния системы с эвтектикой
- •Системы с образованием химических соединений, плавящихся конгруэнтно
- •Системы с образованием химических соединений, плавящихся инкогруэнтно
- •Системы с неограниченной растворимостью компонентов в жидком и ограниченной взаимной растворимостью в твердом состояниях
- •Системы с ограниченной взаимной растворимостью компонентов в жидком состоянии
- •Трехкомпонентные системы
- •3.2. Экспериментальная часть Работа № 1. Построение диаграммы состояния бинарной системы фенол-нафталин
- •Вопросы для самоконтроля
- •Пример решения задач
- •Задачи для самостоятельного решения
- •Литература
- •Приложение 1
- •Приложение 2
- •Оглавление
- •Лабораторный практикум по химической термодинамике
Фазовые диаграммы состояния систем
Для графического изображения фазовых равновесий в системе пользуются диаграммами состояния, построенными в координатах свойство-состав. В качестве изучаемых свойств могут быть выбраны тепловые, объемные, электрические, магнитные, оптические и другие свойства. Диаграмма – совокупность геометрических элементов (точек, линий, плоскостей и т.д.), которые изображают связь между параметрами, определяющими состояние системы и ее составом. С помощью диаграмм состояния можно установить протекающие в системе качественные изменения, характер взаимодействия между компонентами, области существования и составы равновесных фаз и т. д. В основе анализа диаграмм состояния лежат два положения, сформулированные Н.С. Курнаковым: принцип непрерывности и принцип соответствия.
Согласно первому принципу, при непрерывном изменении параметров, определяющих состояние системы, свойства отдельных фаз изменяются также непрерывно, свойства же всей системы изменяются непрерывно лишь до тех пор, пока не меняется число или природа ее фаз. При исчезновении старых или появлении новых фаз свойства системы изменяются скачкообразно.
Согласно принципу соответствия, на диаграмме состояния при равновесии каждому комплексу фаз и каждой фазе в отдельности соответствует свой геометрический образ: плоскость, линия, точка.
Одной из задач физико-химического анализа является построение диаграмм состояния двойных, тройных и более сложных систем, изображающих зависимость между свойством (температурой) и составом. Интерес и важность исследования подобных диаграмм состояния заключается не только в установлении наличия фаз в системе, но также выяснении природы и характера взаимодействия между компонентами системы, насколько это возможно, на основании изучения вида полученных диаграмм.
Вид диаграммы состояния зависит от числа компонентов в системе.
Для построения фазовых диаграмм используют различные экспериментальные методы, наиболее эффективным из которых является метод физико-химического анализа. В основе физико-химического анализа лежит изучение функциональной зависимости между значениями какого-либо физического свойства системы и факторами, определяющими ее равновесие. Наиболее общим современным способом определения равновесия между твердыми и жидкими фазами при некоторых температурах является метод термического анализа (термография).
Метод термического анализа (термография) – совокупность экспериментальных методов определения температуры, при которой в равновесной системе изменяется число фаз. Сущность метода термического анализа заключается в том, что процессы, протекающие в веществе и сопровождающиеся тепловым эффектом, приводят к появлению изотермических остановок или изменения угла наклона кривой температура – время.
Различают: визуальный термический анализ (простая термография) и термический анализ, основанный на построении кривых охлаждения (дифференциальная термография). Метод построения кривых охлаждения (Н.С.Курнаков) основан на том, что пока в охлаждаемой системе не происходит никаких превращений, температура падает равномерно. Появление или исчезновение фаз сопровождается тепловыми эффектами, на кривой охлаждения появляются перегибы или происходит температурная остановка. Таким образом, по изломам на кривых охлаждения можно судить об изменении фазового состава исследуемой смеси (рис. 3.1).
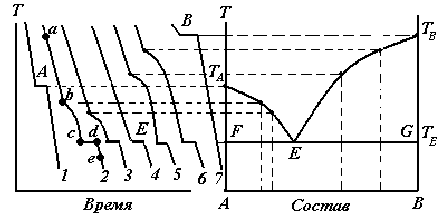
Рис. 3.1. Построение диаграммы плавкости двухкомпонентной системы
по кривым охлаждения
Если медленно охлаждать чистое расплавленное вещество (кривые 1 и 7 на рис. 3.1), то его кристаллизация вызовет температурную остановку, так как выделяющаяся скрытая теплота кристаллизации будет компенсировать отвод теплоты в окружающую среду. Поэтому на кривой охлаждения появляется горизонтальный участок. Размер горизонтального участка, т.е. длительность температурной остановки, зависит от количества вещества и от скорости охлаждения системы. Состав жидкой фазы при кристаллизации чистого вещества не изменяется, поэтому температура кристаллизации постоянна. Подобную кривую охлаждения дает смесь эвтектического состава (кривая 4).
Несколько сложнее кривые охлаждения смесей различного состава (кривые 2, 3, 5, 6). В этом случае до начала кристаллизации температура падает со временем практически линейно (участок ab, кривая 2). Однако, смесь в отличие от чистого вещества, кристаллизуется не при постоянной температуре (хотя процесс также является экзотермическим), а в некотором температурном интервале. Это обусловлено тем, что при выделении кристаллов одного из компонентов смесь обогащается вторым, и температура ее кристаллизации понижается. Поэтому на кривых охлаждения при температуре начала кристаллизации (точка b, кривая 2) происходит лишь излом кривой, так как скорость охлаждения уменьшается в результате выделения теплоты кристаллизации (участок bc, кривая 2).
Температура падает до тех пор, пока состав сплава (смеси) не станет эвтектическим (точка c). С этого момента будет кристаллизоваться эвтектика (мелкозернистая смесь кристаллов двух компонентов) при постоянной температуре (участок cd). В точке d расплав полностью исчезает и начинается охлаждение твердых фаз (участок de, кривая 2).
В результате исследования чистых веществ и нескольких смесей с различными содержаниями компонентов получают серию кривых охлаждения. Затем строят диаграмму плавкости системы, откладывая по оси ординат температуру плавления (кристаллизации) чистых веществ, смесей (сплавов), а по оси абсцисс - состав в массовых, атомных и т.д. процентах, т.е. содержание одного из компонентов.
Точки А, В на диаграмме соответствуют 100%-ному содержанию компонентов А и В соответственно. Отсчет содержания компонента В начинается от точки А, где его содержание составляет 0%.
Построение фазовых диаграмм состояния является тонким и трудоемким исследованием. Однако большая ценность полученных с их помощью результатов вполне оправдывает затраченный труд. В минералогических системах диаграммы состояния позволяют судить о внутренней структуре минерала, об образовании различных соединений между компонентами и их составе, об образовании смешанных кристаллов, полиморфных превращениях и многих других особенностях внутреннего строения минерала.
