
- •Саратовский государственный технический университет
- •Введение
- •1. Тепловые эффекты химических реакций и калориметрия
- •1.1. Теоретическая часть
- •Основные понятия
- •Первый закон термодинамики
- •Второй закон термодинамики
- •Третий закон термодинамики
- •Энергетика химических реакций Тепловые эффекты химических реакций Количество теплоты. Уравнение теплового баланса
- •Термохимические законы Закон Гесса
- •Закон Кирхгофа
- •Закон Лавуазье-Ломоносова-Лапласа
- •Тепловые эффекты фазовых превращений
- •Направленность химических процессов
- •1.2. Экспериментальная часть Основы калориметрии
- •Типы калориметров
- •Работа №1. Определение содержания кислоты (концентрации) по тепловому эффекту нейтрализации
- •Работа №2. Исследование тепловых эффектов химических реакций.
- •Графическая обработка результатов эксперимента
- •1. Определение изменение температуры в ходе химической реакции.
- •2. Расчет систематической погрешности
- •3. Расчет погрешности в определении теплового эффекта реакции
- •Содержание и оформление отчета
- •Вопросы для самоконтроля
- •Задачи для самостоятельного решения
- •2. Идеальные растворы и их свойства
- •2.1. Теоретическая часть Растворы
- •Идеальные растворы
- •Свойства идеальных растворов Понижение давления насыщенного пара растворителя
- •Температура кристаллизации разбавленных растворов
- •Температура кипения разбавленных растворов
- •Изотонический коэффициент
- •Явление осмоса
- •Применение законов идеальных растворов
- •2.2. Экспериментальная часть Работа №1. Определение изотонического коэффициента и степени диссоциации электролита эбулиоскопическим методом
- •Работа №2 Определение молекулярной массы вещества криоскопическим методом
- •Обработка результатов эксперимента
- •Работа №3 Определение осмотического давления раствора неэлектролита
- •Вопросы для самоконтроля
- •Задачи для самостоятельного решения
- •3. Фазовые равновесия
- •3.1. Теоретическая часть
- •Фазовые диаграммы состояния систем
- •Однокомпонентные системы
- •Двухкомпонентные системы
- •Двухкомпонентные конденсированных системы
- •Диаграмма состояния системы с эвтектикой
- •Системы с образованием химических соединений, плавящихся конгруэнтно
- •Системы с образованием химических соединений, плавящихся инкогруэнтно
- •Системы с неограниченной растворимостью компонентов в жидком и ограниченной взаимной растворимостью в твердом состояниях
- •Системы с ограниченной взаимной растворимостью компонентов в жидком состоянии
- •Трехкомпонентные системы
- •3.2. Экспериментальная часть Работа № 1. Построение диаграммы состояния бинарной системы фенол-нафталин
- •Вопросы для самоконтроля
- •Пример решения задач
- •Задачи для самостоятельного решения
- •Литература
- •Приложение 1
- •Приложение 2
- •Оглавление
- •Лабораторный практикум по химической термодинамике
Однокомпонентные системы
Состояние однокомпонентной системы вполне определяется двумя независимыми параметрами, например, давлением и температурой, а объем системы является функцией давления и температуры V = f (P,T). Если по трем координатным осям отложить, соответственно, давление, температуру и объем системы, то полученная пространственная диаграмма, выражающая зависимость состояния системы и фазовых равновесий в ней от внешних условий, называется диаграммой состояния, или фазовой диаграммой. Построение таких диаграмм связано с трудностями, и они мало удобны для практического применения. Поэтому чаще используют плоские фазовые диаграммы, являющиеся проекциями пространственной диаграммы на плоскость Р–Т, V–Т, Т–V. На плоской диаграмме состояния каждой фазе отвечает своя область, представляющая собой совокупность так называемых фигуративных точек, изображающих состояния равновесной системы. Равновесия двух фаз на диаграмме изображаются линиями пересечения областей, а равновесия трех фаз – точкой пересечения этих линий, называемой тройной точкой. По диаграмме состояния можно установить число фаз, их химическую природу и границы существования фаз.
Состояние воды изучено в широком интервале температур и давлений. При высоких давлениях установлено семь кристаллических модификаций льда. На рис. 3.2 приведена плоская диаграмма состояния воды при невысоких давлениях (Р < 2,03.107 Па).
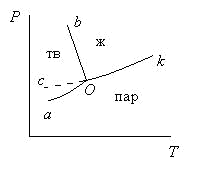
Рис. 3.2. Диаграмма состояния воды при низких давлениях
Наклон линии плавления Оb отличается от линий плавления большинства других систем, что объясняется уменьшением объема при плавлении льда. На рисунке линия сО соответствует равновесию между переохлажденной водой и паром, которое является неустойчивым, метастабильным. Перегреть кристаллическое вещество не удается, так как происходит разрушение решетки, поэтому линия возгонки аО заканчивается в тройной точке О. При отсутствии воздуха тройной точке воды соответствует Т = 273,16 К и Р = 610,48 Па. Температура, равная 273,16 К, принята в качестве единственной реперной точки (точки отсчета) для абсолютной термодинамической температурной шкалы Кельвина. При атмосферном давлении (Р = 1,0133.105 Па) температура льда на 0,01 К ниже тройной точки (Т = 273,15 К = 0о С). Линия аО – линия возгонки, kО – линия испарения.
Двухкомпонентные системы
Состав двойных систем можно изобразить в виде отрезка прямой, длина которого принимается за единицу при выражении состава в атомных, мольных, массовых долях или за 100 – при выражении состава атомных, мольных или массовых процентах.
![]()
Рис. 3.3. Ось состава двойной системы
На рис. 3.3 изображена ось состава в виде отрезка прямой АВ, на котором точке А соответствует чистый компонент А (одна доля или 100 %), а точке В – чистый компонент В. По мере удаления от точки А вправо в смеси уменьшается содержание компонента А и увеличивается содержание компонента В. Например, состав смеси, изображенный фигуративной точкой Q, отвечает AQ процентам (долям) компонента В и QВ – процентам (долям) компонента А. Для оси состава двойной системы при выражении этого состава в процентах (долях) можно применять правило рычага, устанавливающее зависимость между соотношением масс смесей различного состава и отношением отрезков на оси состава. Допустим, что взято q1 массовых единиц смеси состава, изображенного фигуративной точкой Q1, и q2 массовых единиц смеси Q2. При смешении их получим новую смесь Q, масса которой равна q = q1 + q2. В соответствии с правилом рычага q1 / q2 = Q Q2 / Q1 Q.
При помощи правила рычага возможно решение ряда задач, связанных с расчетом составов смесей веществ.
Пример 1. Cмешано 3 г смеси, содержащей 0,8 мас. долей компонента А и 5 г смеси, содержащей 0,2 мас. доли компонента А. Каков состав полученной смеси?
Решение. По правилу рычага 5/3 = Q1 Q / Q Q2 = (0,8 – х) / (х – 0,2). Отсюда х = 0,425. Таким образом, полученная смесь содержит 0,425 мас. долей компонента А.
Пример 2. Предположим, что необходимо получить 9 г смеси, содержащей 0,5 мас. доли А, из смеси, содержащей 0,7 мас. доли А и 0,4 мас. доли А. Сколько по массе нужно взять этих смесей?
Решение. По правилу рычага
q1 / q2 = Q Q2 / Q 1Q = (x2 – x) / (x – x1);
q1 / (9 – q1) = (0,7 – 0,5) / (0,5 – 0,4) = 0,2 / 0,1.
Отсюда q1 = 6 г, q2 = 3 г.
Для двухкомпонентной системы, на которую из внешних условий оказывают влияние давление и температура, правило Гиббса выражается уравнением
|
С= 4 – Ф. |
(3.14) |
Следовательно, в двухкомпонентных системах число фаз, находящихся в равновесии, не может быть больше четырех (С = 0, если Ф = 4), а максимальное число независимых параметров состояния системы, то есть термодинамических степеней свободы, равно трем: давление, температура и концентрация одного из компонентов, выраженная в массовых или молярных долях или процентах (С = 3, если Ф = 1).
Для выяснения характера взаимодействия между компонентами и выявления областей существования и состава равновесных фаз требуется построение трехмерной диаграммы, поскольку состояние двухкомпонентной системы определяется тремя параметрами (температура, давление, концентрация одного из компонентов). Однако чаще используют плоские диаграммы, получаемые при постоянстве одного из трех параметров. Рассмотрим несколько диаграмм состав – свойство для двухкомпонентных систем.
Равновесие пар – жидкий раствор
Рассмотрим диаграммы кипения для некоторых реальных систем при Р = const (рис. 3.4, 3.5). На этих диаграммах фигуративные точки а и b соответствуют температурам кипения чистых компонентов А и В при данном внешнем давлении Р. При температуре кипения чистого компонента система условно инварианта (Сусл = 1 – 2 + 1 = 0). Та из двух жидкостей, которая обладает более низкой температурой кипения при заданном внешнем давлении, будет более летучей при данной температуре, т.е. чем ниже температура кипения жидкости, тем выше давление пара над ней. Каждая из диаграмм кипения имеет две кривые, разделяющие диаграмму на три области:
I – область пара (Сусл = 2 – 1 + 1 = 2),
II – область жидкости (Сусл = 2 – 1 + 1 = 2),
III – область равновесия пара и жидкости (Сусл = 2 – 2 + 1 = 1).
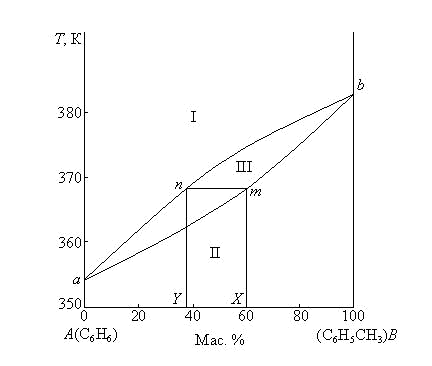
Рис. 3.4. Диаграмма кипения системы бензол – толуол
при P = 1,0133·105Па

Рис. 3.5. Диаграмма кипения системы этиловый спирт – этилацетат
при P = 1,0133·105Па
Фигуративные точки, лежащие на кривой жидкости (нижняя кривая), характеризуют составы кипящих жидкостей и температуры, при которых начинают кипеть жидкости заданного состава. Например, фигуративная точка m (рис. 3.4) показывает, что раствор состава X начинает кипеть при 368 К. Фигуративные точки, лежащие на кривой пара (верхняя кривая), характеризуют составы пара и температуры, при которых исчезают последние капли жидкости при кипении исходных смесей. Например, фигуративная точка n (рис.3.4) отвечает составу (Y) первого пузырька пара, полученного при кипении раствора т состава X. С другой стороны, точка п показывает температуру 368 К, при которой исчезает последняя капля жидкости при кипении раствора состава Y. Количества равновесных фаз для исходных смесей, находящихся между линиями пара и жидкости, определяются по правилу рычага как обычно в двухкомпонентных системах.
Реальные растворы со значительным положительным или отрицательным отклонением от идеального способны образовывать азеотропные смеси (азеотропы). Так на рис. 3.5 азеотропная смесь изображена точкой с. Азеотропные смеси – это растворы, при испарении которых получается пар того же состава, что и исходная жидкая смесь (X(п) = X(ж)). Азеотропные смеси – условно инвариантные системы (Сусл = 2 – 2 = 0). В реальных растворах азеотропная смесь имеет самую низкую или самую высокую температуру кипения (рис. 3.5). При изменении внешнего давления изменяется не только температура кипения, но и состав азеотропного раствора. Это указывает на то, что азеотропная смесь не является химическим соединением.
Как для идеальных, так и для реальных растворов справедлив первый закон Гиббса – Коновалова: пар по сравнению с жидким раствором, из которого он получен, при равновесии богаче тем компонентом, прибавление которого к раствору приводит к понижению температуры кипения раствора при заданном внешнем давлении или к повышению давления пара над раствором. Следует отметить, что в системах с азеотропными смесями добавление к раствору более летучего компонента не всегда приводит к повышению давления пара над раствором, т.е. к понижению температуры кипения раствора. Так, при добавлении к растворам, находящимся левее точки с (рис.3.4), более летучего компонента В температура кипения раствора понижается, а следовательно, повышается давление пара над раствором. При добавлении компонента В к растворам, находящимся правее точки с, температура кипения раствора повышается, а давление пара над раствором понижается, при этом пар богаче компонентом А.
Для реальных растворов с азеотропными смесями справедлив также второй закон Гиббса – Коновалова: в азеотропных смесях, изображенных на диаграммах состояния экстремальными точками (максимум или минимум), составы жидкости и пара совпадают.
Законы Гиббса – Коновалова были выведены теоретически Дж. Гиббсом и независимо открыты экспериментальным путем Д.П. Коноваловым (1881).
Азеотропные
смеси образуются не только в системах
со значительными отклонениями от закона
Рауля, но и в системах с незначительными
отклонениями, когда компоненты раствора
имеют близкие температуры кипения, т.е.
почти одинаковые давления пара над
чистыми компонентами (![]() ).
В этом случае на диаграмме состояния
появляется экстремум, лежащий в средней
части диаграммы. Чем больше различие
между
).
В этом случае на диаграмме состояния
появляется экстремум, лежащий в средней
части диаграммы. Чем больше различие
между![]() и
и![]() ,
тем больше положение экстремума сдвинуто
в сторону одного из компонентов системы:
при максимуме на кривой давления пара
в сторону более летучего компонента,
при минимуме – в сторону менее летучего
компонента.
,
тем больше положение экстремума сдвинуто
в сторону одного из компонентов системы:
при максимуме на кривой давления пара
в сторону более летучего компонента,
при минимуме – в сторону менее летучего
компонента.
