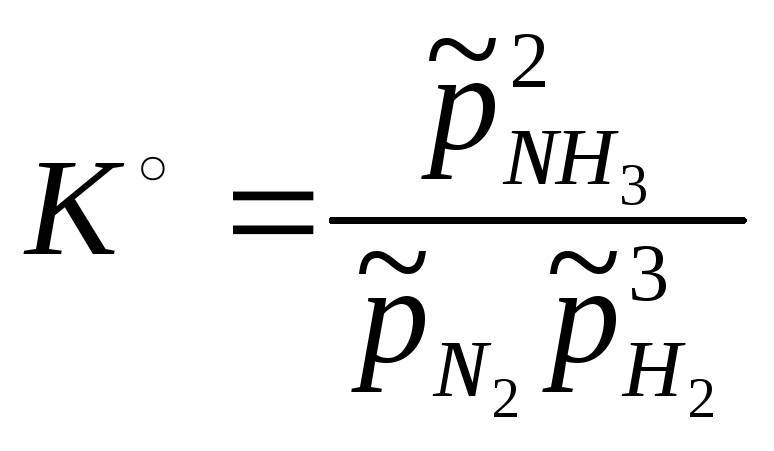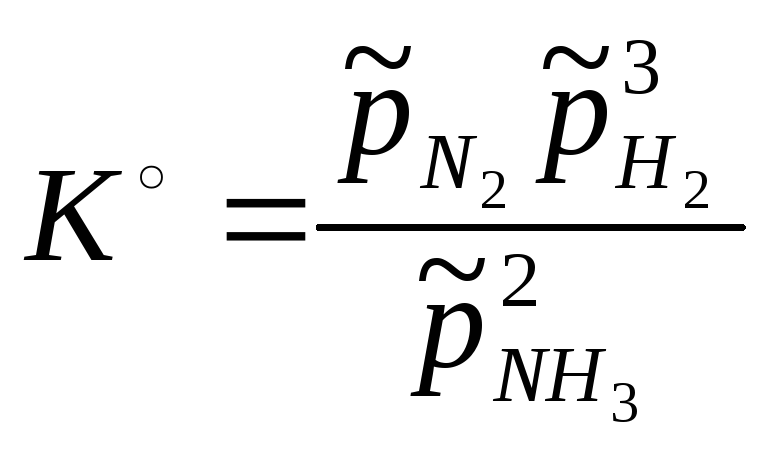- •Саратовский государственный технический университет
- •Введение
- •1. Тепловые эффекты химических реакций и калориметрия
- •1.1. Теоретическая часть
- •Основные понятия
- •Первый закон термодинамики
- •Второй закон термодинамики
- •Третий закон термодинамики
- •Энергетика химических реакций Тепловые эффекты химических реакций Количество теплоты. Уравнение теплового баланса
- •Термохимические законы Закон Гесса
- •Закон Кирхгофа
- •Закон Лавуазье-Ломоносова-Лапласа
- •Тепловые эффекты фазовых превращений
- •Направленность химических процессов
- •1.2. Экспериментальная часть Основы калориметрии
- •Типы калориметров
- •Работа №1. Определение содержания кислоты (концентрации) по тепловому эффекту нейтрализации
- •Работа №2. Исследование тепловых эффектов химических реакций.
- •Графическая обработка результатов эксперимента
- •1. Определение изменение температуры в ходе химической реакции.
- •2. Расчет систематической погрешности
- •3. Расчет погрешности в определении теплового эффекта реакции
- •Содержание и оформление отчета
- •Вопросы для самоконтроля
- •Задачи для самостоятельного решения
- •2. Идеальные растворы и их свойства
- •2.1. Теоретическая часть Растворы
- •Идеальные растворы
- •Свойства идеальных растворов Понижение давления насыщенного пара растворителя
- •Температура кристаллизации разбавленных растворов
- •Температура кипения разбавленных растворов
- •Изотонический коэффициент
- •Явление осмоса
- •Применение законов идеальных растворов
- •2.2. Экспериментальная часть Работа №1. Определение изотонического коэффициента и степени диссоциации электролита эбулиоскопическим методом
- •Работа №2 Определение молекулярной массы вещества криоскопическим методом
- •Обработка результатов эксперимента
- •Работа №3 Определение осмотического давления раствора неэлектролита
- •Вопросы для самоконтроля
- •Задачи для самостоятельного решения
- •3. Фазовые равновесия
- •3.1. Теоретическая часть
- •Фазовые диаграммы состояния систем
- •Однокомпонентные системы
- •Двухкомпонентные системы
- •Двухкомпонентные конденсированных системы
- •Диаграмма состояния системы с эвтектикой
- •Системы с образованием химических соединений, плавящихся конгруэнтно
- •Системы с образованием химических соединений, плавящихся инкогруэнтно
- •Системы с неограниченной растворимостью компонентов в жидком и ограниченной взаимной растворимостью в твердом состояниях
- •Системы с ограниченной взаимной растворимостью компонентов в жидком состоянии
- •Трехкомпонентные системы
- •3.2. Экспериментальная часть Работа № 1. Построение диаграммы состояния бинарной системы фенол-нафталин
- •Вопросы для самоконтроля
- •Пример решения задач
- •Задачи для самостоятельного решения
- •Литература
- •Приложение 1
- •Приложение 2
- •Оглавление
- •Лабораторный практикум по химической термодинамике
3. Фазовые равновесия
3.1. Теоретическая часть
Физико-химические системы подразделяются на гомогенные и гетерогенные.
Гомогенной называется система, внутри которой нет поверхностей раздела, отделяющих различающиеся либо по физическому строению, либо по химическим свойствам, части системы. Примерами таких систем могут служить: смесь газов, ненасыщенный раствор соли в воде, кристаллы чистого вещества.
Гетерогенной называется система, состоящая из различных по своим физическим или химическим свойствам частей, отделенных друг от друга поверхностями раздела. Примерами гетерогенных систем могут служить: смесь кристаллических веществ, смесь нескольких жидкостей, ограниченно растворимых друг в друге, насыщенный раствор соли в воде с избытком твердой соли.
Любая гетерогенная система состоит из нескольких фаз. Фазой называется гомогенная часть системы, ограниченная поверхностью раздела и характеризующаяся одинаковыми химическими и физическими свойствами во всех своих точках. По числу фаз (Ф) различают системы однофазные, двухфазные, трехфазные и т. д.
Каждая система состоит из одного или нескольких веществ. Индивидуальные химические вещества, которые могут быть выделены из системы простыми препаративными методами (кристаллизация, осаждение, испарение и др.) и существовать вне ее самостоятельно, называются составляющими веществами системы. Например, в водном растворе хлорида натрия составляющими веществами являются NaCl и Н2О, а ионы Na+ и С1− ими не являются.
Составляющие вещества, с помощью наименьшего числа которых можно однозначно выразить состав каждой фазы при любых условиях существования системы, называются компонентами.
Если в системе между составляющими веществами нет химического взаимодействия, то число компонентов равно числу составляющих веществ. При наличии химического взаимодействия число компонентов находится как разность между числом составляющих веществ и числом уравнений, связывающих равновесные концентрации этих веществ. В зависимости от способа образования равновесной системы и условий ее существования при одном и том же числе составляющих веществ число компонентов может быть разным.
Например, равновесная газообразная система, содержащая азот, водород и аммиак, может быть получена двумя путями:
|
N2 + 3H2 ↔2NH3 |
(3.1) |
|
2NH3 ↔ N2 + 3H2 |
(3.2) |
В первом случае, если азот и водород взяты в исходной системе в произвольном соотношении, равновесные концентрации или пропорциональные им относительные парциальные давления всех трех составляющих веществ связаны между собой только одним уравнением:
|
|
(3.3) |
где
![]() ;
;![]() – парциальное давлениеi-ого
компонента;
– парциальное давлениеi-ого
компонента;
![]() –
стандартное
давление,
равное
1,01325·105
Па.
В
этом случае число
компонентов
в системе равно двум.
–
стандартное
давление,
равное
1,01325·105
Па.
В
этом случае число
компонентов
в системе равно двум.
Во втором случае равновесные концентрации или относительные парциальные давления трех составляющих веществ связаны между собой двумя уравнениями:
|
|
(3.4) |
|
|
(3.5) |
В этом случае число компонентов в системе равно единице.
При подсчете числа компонентов в системе учитываются уравнения, связывающие равновесные концентрации или пропорциональные им относительные парциальные давления, но не числа молей составляющих веществ. Это особенно следует иметь в виду, если система гетерогенная.
Например, в системе, состоящей из СаСО3(тв), СаО(тв) и CO2(газ), при равновесии, описываемом уравнением:
|
СаСО3(тв) ↔ СаО(тв) + CO2(газ) |
(3.6) |
закон действующих масс имеет вид:
|
|
(3.7) |
В
рассматриваемой равновесной системе
число молей СаО(тв)
равно числу молей
CO2(газ),
но
![]() (
(![]() –
относительное парциальное давление
паровСаО
над твердым СаО).
В такой системе число компонентов не
может быть меньше двух.
–
относительное парциальное давление
паровСаО
над твердым СаО).
В такой системе число компонентов не
может быть меньше двух.
По числу компонентов (К) различают системы однокомпонентные, двухкомпонентные, трехкомпонентные и т. д.
Любая система обладает определенными свойствами. Термодинамические свойства, наименьшее число которых необходимо для описания состояния данной системы, называются параметрами состояния. В качестве параметров состояния выбираются такие термодинамические свойства, которые легко могут быть измерены экспериментальным путем. К таким свойствам относятся температура, давление, объем, концентрация. Концентрация обычно выражается в массовых или молярных процентах или долях.
Число независимых термодинамических параметров состояния фаз равновесной системы, произвольное изменение которых в определенных пределах не вызывает исчезновения одних и образования других фаз, называется числом термодинамических степеней свободы, или вариантностью системы.
По числу степеней свободы (С) системы разделяются на инвариантные, или нонвариантные (С = 0), моновариантные (С = 1), бивариантные, или дивариантные (С = 2) и т. д. В равновесной системе связь между числами фаз, компонентов и термодинамических степеней свободы выражается законом равновесия фаз – правилом фаз Гиббса:
|
С = К – Ф + 2. |
(3.8) |
Цифра 2 в уравнении (3.8) свидетельствует о влиянии на систему двух внешних параметров – давления и температуры. В частных случаях, когда из внешних факторов на систему оказывает влияние только давление (T = const) или температура (р = const), число степеней свободы уменьшается на единицу и правило фаз принимает вид:
|
Сусл = К – Ф + 1. |
(3.9) |
Вариантность системы в этом случае называется условной (Сусл), а система – условно инвариантной, условно моновариантной и т. д. При постоянстве давления и температуры
|
Сусл = К – Ф. |
(3.10) |
Если в рассматриваемой системе составы двух равновесных фаз, выраженные в массовых или молярных процентах или долях, одинаковы, например, состав жидкой фазы одинаков с составом пара, то при подсчете числа степеней свободы вместо уравнения (3.8) следует пользоваться уравнением
|
Сусл = К – Ф +2 – 1 = К – Ф + 1, |
(3.11) |
а вместо уравнения (3.9) уравнением
|
Сусл = К – Ф + 1 – 1 = К – Ф. |
(3.12) |
В некоторых случаях состояние системы определяется и такими внешними факторами как электрический потенциал, магнитное поле, поле тяготения и др., которые также следует учитывать при подсчете числа степеней свободы в равновесной системе. В общем случае, когда на систему действуют n различных внешних факторов, уравнение имеет вид:
|
С = К – Ф + n. |
(3.13) |
Из уравнения (3.13) следует, что число степеней свободы возрастает с увеличением числа независимых компонентов и уменьшается при росте числа фаз.
Правилу фаз Гиббса не подчиняются коллоидные системы, в которых дисперсная фаза микроскопических размеров. Правило фаз не применимо к неравновесным метастабильным состояниям (переохлажденная вода, перегретый пар и т.д.).