
- •Саратовский государственный технический университет
- •Введение
- •1. Тепловые эффекты химических реакций и калориметрия
- •1.1. Теоретическая часть
- •Основные понятия
- •Первый закон термодинамики
- •Второй закон термодинамики
- •Третий закон термодинамики
- •Энергетика химических реакций Тепловые эффекты химических реакций Количество теплоты. Уравнение теплового баланса
- •Термохимические законы Закон Гесса
- •Закон Кирхгофа
- •Закон Лавуазье-Ломоносова-Лапласа
- •Тепловые эффекты фазовых превращений
- •Направленность химических процессов
- •1.2. Экспериментальная часть Основы калориметрии
- •Типы калориметров
- •Работа №1. Определение содержания кислоты (концентрации) по тепловому эффекту нейтрализации
- •Работа №2. Исследование тепловых эффектов химических реакций.
- •Графическая обработка результатов эксперимента
- •1. Определение изменение температуры в ходе химической реакции.
- •2. Расчет систематической погрешности
- •3. Расчет погрешности в определении теплового эффекта реакции
- •Содержание и оформление отчета
- •Вопросы для самоконтроля
- •Задачи для самостоятельного решения
- •2. Идеальные растворы и их свойства
- •2.1. Теоретическая часть Растворы
- •Идеальные растворы
- •Свойства идеальных растворов Понижение давления насыщенного пара растворителя
- •Температура кристаллизации разбавленных растворов
- •Температура кипения разбавленных растворов
- •Изотонический коэффициент
- •Явление осмоса
- •Применение законов идеальных растворов
- •2.2. Экспериментальная часть Работа №1. Определение изотонического коэффициента и степени диссоциации электролита эбулиоскопическим методом
- •Работа №2 Определение молекулярной массы вещества криоскопическим методом
- •Обработка результатов эксперимента
- •Работа №3 Определение осмотического давления раствора неэлектролита
- •Вопросы для самоконтроля
- •Задачи для самостоятельного решения
- •3. Фазовые равновесия
- •3.1. Теоретическая часть
- •Фазовые диаграммы состояния систем
- •Однокомпонентные системы
- •Двухкомпонентные системы
- •Двухкомпонентные конденсированных системы
- •Диаграмма состояния системы с эвтектикой
- •Системы с образованием химических соединений, плавящихся конгруэнтно
- •Системы с образованием химических соединений, плавящихся инкогруэнтно
- •Системы с неограниченной растворимостью компонентов в жидком и ограниченной взаимной растворимостью в твердом состояниях
- •Системы с ограниченной взаимной растворимостью компонентов в жидком состоянии
- •Трехкомпонентные системы
- •3.2. Экспериментальная часть Работа № 1. Построение диаграммы состояния бинарной системы фенол-нафталин
- •Вопросы для самоконтроля
- •Пример решения задач
- •Задачи для самостоятельного решения
- •Литература
- •Приложение 1
- •Приложение 2
- •Оглавление
- •Лабораторный практикум по химической термодинамике
Работа №2 Определение молекулярной массы вещества криоскопическим методом
Цель: Определение молекулярной массы вещества криоскопическим методом.
Оборудование и химические реактивы: криостат, дифференциальный термометр Бекмана, лупа, исследуемые растворы глюкозы, мочевины, глицерина различных концентраций, хлорид натрия технический, вода дистиллированная, лед.
Порядок выполнения работы
Определение температуры замерзания растворов производится в криостате, схема которого представлена на рис. 2.5.
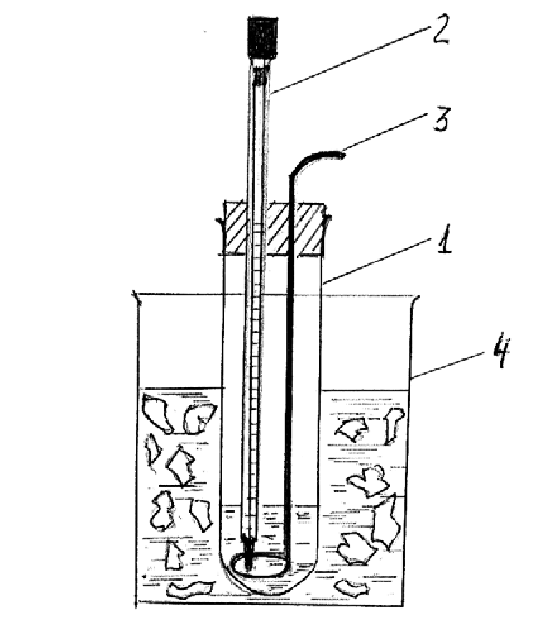
Рис. 2.5. Криостат
– внутренний сосуд; 2 – термометр Бекмана;
3 – проволочная мешалка; 4 – внешний сосуд криостата
Внутренний сосуд криостата (1) ополаскивают водой и наливают примерно 30 мл (чтобы весь резервуар ртути был погружен в воду) дистиллированной воды.
Внешний сосуд криостата (4) заполняют толченым льдом, добавляют 40-50 г технического хлорида натрия, доливают воду до начала всплытия льда и перемешивают. Температура смеси должна быть около –50 С.
Сосуд с дистиллированной водой помещают в криостат и некоторое время охлаждают его (примерно до 2-30С), но не до замерзания. Устанавливают термометр Бекмана.
Термометр Бекмана представляет собой точный измерительный прибор с большим резервуаром ртути, благодаря чему по шкале можно отсчитать сотые доли градуса. При этом на шкале термометра укладывается интервал лишь в 50С. Поэтому предусмотрена настройка термометра на рабочий интервал путем переливания ртути из нижнего резервуара в верхний резервуар. В нашем случае в пределах шкалы должен оказаться интервал от 0 до –30С. Термометр устанавливается преподавателем или лаборантом. Его необходимо переносить без сотрясения и не наклоняя, чтобы из капилляра в верхний резервуар не упала капелька ртути. Это может произойти, когда термометр еще не охлажден. Устанавливая термометр, убеждаются в правильности погружения резервуара в воду: он не должен выступать из воды и касаться стенок сосуда.
Начинают непрерывное перемешивание жидкости проволочной мешалкой (3) и наблюдают за показаниями термометра. Сначала в капилляр уходит вся капелька ртути. Потом столбик ртути быстро опускается, верх его доходит до шкалы и движется вдоль нее. Вода в сосуде неизбежно переохлаждается ниже 00С. В момент начала образования льда происходит резкий скачок температуры, а потом она стабилизируется, т.к. процесс замерзания воды (агрегатный переход) протекает при постоянной температуре. Вид кривых охлаждения показан на рис.2.6.
Записывают полученную температуру замерзания воды в табл. 2.2.
Осторожно вынимают термометр. Затем вынимают сосуд (1) и слегка нагревают рукой до исчезновения льда. Повторяют определение температуры замерзания еще два раза.
После этого вынимают термометр, выливают воду, ополаскивают сосуд заданным раствором и наливают раствора столько же, сколько было воды (желательно, чтобы раствор был охлажден заранее). Записывают концентрацию заданного раствора (дается массовая доля). Производят определение температуры замерзания раствора так же, как описано выше.
Записать показания скачка в табл. 2.2. Опыт повторяют еще два раза.
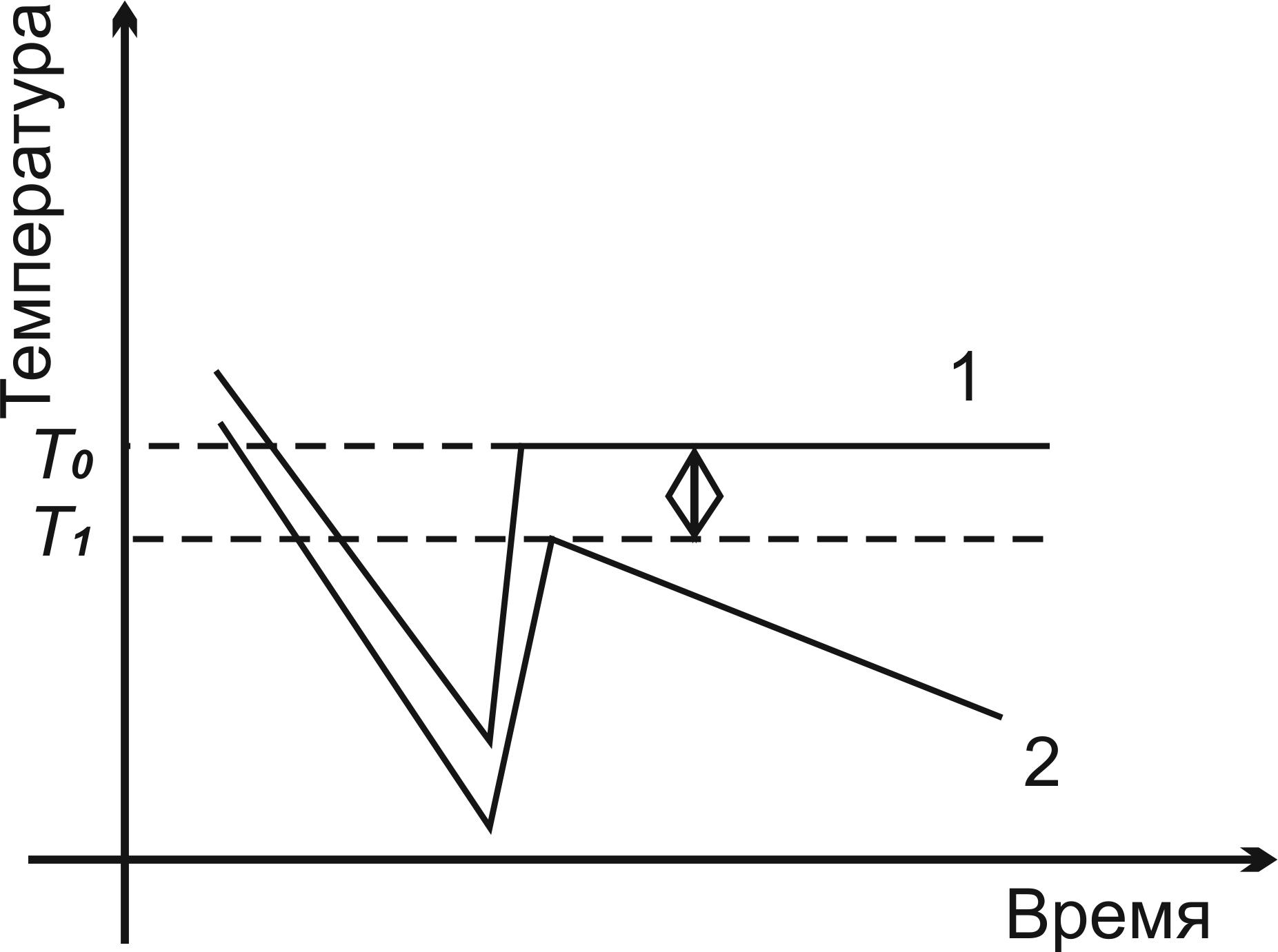
Рис. 2.6. Кривые охлаждения воды (1) и раствора (2).
Т0 – температура замерзания воды,
Т1 – температура замерзания раствора
При работе с раствором особенно важно непрерывное перемешивание, препятствующее сильному переохлаждению жидкости. Дело в том, что по мере вымерзания воды из раствора концентрация последнего увеличивается, и температура замерзания дополнительно понижается. Поэтому после резкого скачка температуры вверх вновь начинается медленное понижение температуры (рис. 2.6).
