
- •5720100 – Лечебное дело
- •Isbn 978-9943-05-412-7
- •Предисловие
- •Глава I. Учение о растворах
- •§ 1. Роль растворов в жизнедеятельности организмов. Вода как растворитель
- •§ 2. Растворимость газов в жидкостях
- •§ 3. Кессонная болезнь
- •§ 4. Закон и.М. Сеченова
- •§ 5. Осмос и осмотическое давление
- •§ 6. Закон вант-гоффа
- •§ 7. Роль осмоса и осмотического давления в биологических системах. Плазмолиз и гемолиз
- •§ 8. Коллигативные свойства растворов
- •1. Коллигативные свойства ионных растворов
- •2. Понижение давления насыщенного пара растворителя над раствором
- •3. Понижение температуры замерзания растворов
- •4. Повышение температуры кипения растворов
- •5. Взаимосвязь между коллигативными свойствами растворов и осмотическим давлением. Определение осмотического давления криоскопическим методом
- •6. Применение криоскопии и эбуллиоскопии
- •§ 9. Экспериментальная часть
- •§ 10. Обучающе-контролирующие тесты
- •1. Укажите 4 характерных признака явления осмоса:
- •2. Укажите 3 фактора, от которых зависит величина осмотического давления:
- •3. Укажите 3 зависимости, выражающие закон Вант-Гоффа:
- •4. Выберите 3 ответа, формулирующие закон Вант-Гоффа:
- •5. Укажите 4 характеристики явления гемолиза в организме:
- •6. Укажите 4 характеристики явления плазмолиза в организме:
- •7. Выберите 3 формулировки изотонического, гипотонического и гипертонического растворов:
- •8. Укажите 4 фактора, объясняющие суть закона Рауля:
- •9. Выберите 5 правильных ответов, характеризующих законы криоскопии и эбуллиоскопии:
- •10. Выберите 3 ответа, характеризующие изотонический коэффициент:
- •11. Выберите 3 физических свойства разбавленных растворов, зависящие от концентрации растворенных веществ в растворе:
- •12. Назовите 3 условия, при которых происходит явление осмоса:
- •Глава II. Электрохимия
- •§ 1. Электропроводимость растворов электролитов. Кондуктометрическое титрование
- •Удельное сопротивление ряда биологических Жидкостей
- •Предельная молярная электропроводимость ионов в воде (18 °c)
- •§ 2. Потенциалы и электродвижущие силы
- •Некоторые стандартные потенциалы восстановления
- •Стандартные окислительно-восстановительные потенциалы
- •§ 3. Гальванические элементы
- •§ 4. Типы электродов
- •§ 5. Электрохимия в медицине
- •§ 6. Экспериментальная часть
- •Вопрос 1. Почему при бесконечном разведении раствора скорости движения различных ионов не будут зависеть друг от друга?
- •§ 7. Потенциометрия. Потенциометрическое титрование
- •Потенциалы электродов сравнения при различных температурах
- •§ 8. Экспериментальная часть
- •Метод «круглого стола»
- •§ 8. Обучающе-контролирующие тесты
- •1. Укажите 5 ответов, дающих характеристику электропроводимости:
- •16. Выберите 4 ответа, отражающие изменения кривой кондуктометрического титрования сильной кислоты сильным основанием:
- •17. Выберите 4 ответа, отражающие изменения кривой кондуктометрического титрования слабой кислоты сильным основанием:
- •18. Выберите 4 ответа, отражающие изменения кривой при титровании смеси сильной и слабой кислот:
- •19. Укажите 4 ответа с данными об электропроводимости биологических жидкостей при различных заболеваниях:
- •20. Укажите 3 ответа со значениями электропроводности при различном состоянии кислотности в желудке:
- •21. Укажите 5 видов и характеристику потенциалов, возникающих на границах раздела фаз:
- •36. Укажите 4 типа электродов и их правильные характеристики:
- •Коллоидная химия
- •Глава III. Физико-химия поверхностных явлений
- •§ I. Поверхностные явления и их значение в биологии и медицине
- •§ 2. Поверхностная энергия и поверхностное натяжение
- •Поверхностное натяжение некоторых веществ в жидком состоянии на границе с воздухом или паром
- •§ 3. Адсорбция и поверхностное натяжение
- •§ 4. Поверхностно-активные и поверхностно- инактивные вещества
- •§ 5. Изотермы поверхностного натяжения
- •§ 6. Адсорбция на границе раздела жидкость – газ и жидкость – жидкость
- •§ 7. Адсорбция на границе раздела твердое тело – газ и твердое тело – жидкость (раствор)
- •§ 8. Ориентация молекул в поверхностном слое и структура биологических мембран
- •§ 9. Адсорбция из растворов электролитов
- •§ 10. Хроматография, ее сущность и применение в биологии и медицине
- •§ 11. Экспериментальная часть
- •Задания для самостоятельной работы
- •Конкурс «кот в мешке»
- •§ 12. Обучающе-контролирующие тесты
- •7. Укажите 3 ответа, поясняющие уравнение Фрейндлиха:
- •8. Укажите 4 ответа, поясняющие уравнение Ленгмюра:
- •9. Укажите 3 ответа с правильной характеристикой трех частей изотермы адсорбции Ленгмюра:
- •10. Укажите 3 операции, проводимые при определении величины адсорбции на твердой поверхности:
- •11. Выберите 5 характеристик гидрофильности или гидрофобности некоторых видов поверхности:
- •12. Выберите 3 правила, которым подчиняется адсорбция растворенного вещества на твердой поверхности:
- •13. Укажите 5 примеров молекулярной и ионной адсорбции на угле:
- •24. Укажите 3 фактора, от которых зависит адсорбция газов твердым адсорбентом:
- •25. Укажите 3 фактора, от которых зависит адсорбция на границе твердое тело – раствор.
- •Глава IV. Физико-химия дисперсных систем
- •§ 1. Дисперсные системы и их классификация
- •Изменение удельной поверхности при дроблении
- •1 См3 вещества
- •Классификация систем по степени дисперсности
- •Классификация дисперсных систем по агрегатном состоянию дисперсной фазы и дисперсионной среды
- •§ 2. Коллоидное состояние. Методы получения и очистки коллоидных растворов
- •Диспергирование Конденсация
- •§ 3. Молекулярно-кинетические свойства коллоидных систем
- •§ 4. Оптические свойства коллоидных систем
- •§ 5. Классификация коллоидных систем
- •§ 6. Возникновение двойного электрического слоя и его строение
- •§ 7. Строение коллоидных частиц
- •§ 8. Электрокинетическне явления. Электрофорез и использование его в медицине
- •§ 9. Устойчивость коллоидных систем
- •Коагуляция золей As2s3 и Fe(oh)3 электролитами
- •§ 10. Пептизация. Коллоидная защита
- •§ 11. Аэрозоли и их Практическое Значение
- •§ 12. Суспензии, методы их получения и свойства
- •§ 13. Эмульсии, методы их получения и свойства
- •§ 14. Коллоидные поверхностно-активные вещества (пав)
- •§ 15. Экспериментальная часть
- •§ 16. Обучающе-контролирующие тесты
- •1. Укажите 4 характеристики состава и свойств дисперсных систем:
- •2. Укажите 3 типа дисперсных систем согласно классификации по размеру частиц:
- •19. Укажите 4 характеристики поверхностно-активных и поверхностно-инактивных веществ.
- •20. Физическая и коллоидная химия. Под ред. А.П. Беляева. Изд. Группа «гэотар-Медиа», – м.:, 2010. Оглавление
- •Коллоидная химия
- •Сталина Салиховна касымова физическая и коллоидная химия
5. Взаимосвязь между коллигативными свойствами растворов и осмотическим давлением. Определение осмотического давления криоскопическим методом
Непосредственное определение осмотического давления связано с целым рядом трудностей. Обычно осмотическое давление измеряется и определяется косвенным путем, например методом криоскопии. В основе этого определения лежат законы Вант-Гоффа и Рауля, то есть Росм = 1000 CRT и Тзам = К · СВ, где СМ – молярная концентрация раствора (в моль/л раствора); СВ – моляльная концентрация раствора (в моль на 1 кг растворителя). Для разбавленных растворов можно без большой погрешности принять, что СМ = СВ; подставив в уравнение закона Вант-Гоффа вместо С равное значение Тзам/К из закона Рауля, найдем
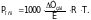 (8)
(8)
После замены буквенных выражений R, T и K их численными значениями (для разбавленных растворов) получим окончательное уравнение для вычисления осмотического давления криоскопическим методом:
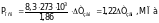 (9)
(9)
Все
коллигативные свойства растворов
находятся в тесной взаимосвязи. Зная
повышение температуры кипения раствора
определенной моляльности, можно заранее
сказать, какими будут понижение
температуры замерзания, относительное
понижение давления, относительное
понижение давления насыщенного пара и
осмотическое давление для полученного
раствора. Если, например, водный раствор
какого-либо электролита имеет температуру
кипения 100,129 °С и его моляльность равна
0,129/0,516 = 0,25 моль/кг, то можно утверждать,
что он будет замерзать при 0 – 1,84 ·
0,25
– 0,463 °С, и относительное понижение
давления насыщенного пара для него
составит
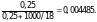 Давление
насыщенного пара над этим раствором
при 100 °С Р = 1013 – 0,004485 · 1013 = 1009 гПа, а
осмотическое давление при 25 °С (полагая,
что 0,25 моль/кг
250 моль/м3)
Росм.
= 250 ·8,314 · 298 · 10-6
0,62 МПа.
Давление
насыщенного пара над этим раствором
при 100 °С Р = 1013 – 0,004485 · 1013 = 1009 гПа, а
осмотическое давление при 25 °С (полагая,
что 0,25 моль/кг
250 моль/м3)
Росм.
= 250 ·8,314 · 298 · 10-6
0,62 МПа.
Экспериментально определяемое понижение температуры замерзания плазмы крови человека обычно составляет 0,56 °С, т. е. отвечает моляльности растворенных в ней веществ 0,56 : 1,84 = 0,304 моль/кг = 304 моль/м3 и осмотическому давлению при 37 °С, равному 0,304 · 8,314 ·310 · 10-3 = 0,78 МПа. У большинства млекопитающих животных понижение температуры замерзания обычно находится на уровне 0,58 °С и отвечает несколько большему осмотическому давлению 0,58: 1,84 · 8,314 · 310 · 10-3 0,81 МПа.
6. Применение криоскопии и эбуллиоскопии
Методы криоскопии и эбуллиоскопии широко используются при физико-химическом изучении биологических объектов. Если, например, мы занимаемся синтезом какого-то нового и не описанного еще вещества. В результате продолжительных экспериментов новое вещество получено, выделено и очищено. Путем сравнительно несложных реакций химик устанавливает, что в состав соединения входят С, Н и О, т. е. это органическое соединение. С помощью количественного анализа устанавливаем, что в состав соединения входит 40 % С, 6,7 % Н2 и 53,3 % О2, а отсюда вытекает, что в полученном соединении соотношение элементов таково С : Н : О = 1 : 2 : 1. Следовательно, это может быть формальдегид СН2О. Но под это же соотношение подходит и уксусная кислота С2Н4О2, а также глюкоза С6Н12О6, т. е. имеется много химических соединений, которые удовлетворяют найденному соотношению элементов.
Следовательно, необходимо определить другое свойство, например, молекулярную массу, т. к. эти соединения сильно различаются по молекулярной массе: у формальдегида 30, у уксусной кислоты 60, а у глюкозы 180. В этом случае нам помогает криоскопия – универсальный метод определения молекулярных масс:
Тзам = К ·СВ,
где CВ – количество молей вещества в 1000 г растворителя, а количество молей – это частное от деления массы вещества на его молекулярную массу, т.е. СВ/M. Поэтому понижение температуры замерзания или молекулярную массу можно определять по следующим формулам:
 или
или
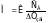 .
.
По этой формуле и определяют молекулярную массу. Отвешивают определенное количество вещества, например 50 г, растворяют в 1000 г воды и затем определяют Тзам полученного раствора. Эксперимент показал, что раствор замерзает при температуре – 1,02 °С. Температура замерзания чистого растворителя – воды 0 °С, следовательно, Тзам =1,02. Криоскопическая константа воды равна 1,84. Тогда
М
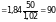 .
.
Итак, точная формула соединения, которое мы получили С3Н6О3 – триоксан
О – СН2

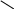
Н2С О
О – СН2
Криоскопия как метод определения молекулярных масс открыта примерно 150 лет назад. С тех пор криоскопический метод определения молекулярных масс остался неприкосновенным. Этим методом так увлекались, что Аррениус, благодаря которому криоскопия вошла в арсенал физико-химических методов исследования, с гордостью писал: «В Европе снова наступил ледниковый период...».
Этот метод оказался особенно удобным для определения очень высоких молекулярных масс. Именно при помощи этого метода Адером была впервые в 1925 г. достоверно определена молекулярная масса гемоглобина (68000), затем подтверждена данными измерений, произведенных с использованием ультрацентрифуги.
В состав крови, лимфы и тканевых жидкостей, омывающих все клетки и ткани тела, кроме белка входят (около 1 %) неорганические катионы и анионы, которые в основном определяют осмотическую концентрацию (концентрацию частиц) и связанное с ней осмотическое давление. От последнего зависит форма и деятельность клеток. Величина осмотического давления крови или раствора может быть определена криоскопическим методом.
Криоскопический метод дает возможность определять молекулярные массы таких веществ, которые разлагаются при нагревании (например, взрывчатых) или существенно изменяют свое состояние (например, белков, свертывающихся при нагревании). Благодаря этому криоскопический метод стал одним из универсальных методов исследования. Все, что касалось криоскопического метода, может быть перенесено и на эбуллиоскопическое уравнение.
Кроме того, криоскопия и эбуллиоскопия позволяет изучать молекулярное состояние веществ в растворе. Благодаря криоскопии найдено, что многие вещества в растворах могут находиться в ассоциированном состоянии, образуя димеры (парные молекулы), триммеры (объединение трех молекул), тетрамеры (союз четырех молекул), а ассоциация
СН3 – О – Н
: : водородные связи
: :
Н – О – СН3
это первая ступенька в цепочке превращений, которая привела к возникновению живого вещества.
