
- •5720100 – Лечебное дело
- •Isbn 978-9943-05-412-7
- •Предисловие
- •Глава I. Учение о растворах
- •§ 1. Роль растворов в жизнедеятельности организмов. Вода как растворитель
- •§ 2. Растворимость газов в жидкостях
- •§ 3. Кессонная болезнь
- •§ 4. Закон и.М. Сеченова
- •§ 5. Осмос и осмотическое давление
- •§ 6. Закон вант-гоффа
- •§ 7. Роль осмоса и осмотического давления в биологических системах. Плазмолиз и гемолиз
- •§ 8. Коллигативные свойства растворов
- •1. Коллигативные свойства ионных растворов
- •2. Понижение давления насыщенного пара растворителя над раствором
- •3. Понижение температуры замерзания растворов
- •4. Повышение температуры кипения растворов
- •5. Взаимосвязь между коллигативными свойствами растворов и осмотическим давлением. Определение осмотического давления криоскопическим методом
- •6. Применение криоскопии и эбуллиоскопии
- •§ 9. Экспериментальная часть
- •§ 10. Обучающе-контролирующие тесты
- •1. Укажите 4 характерных признака явления осмоса:
- •2. Укажите 3 фактора, от которых зависит величина осмотического давления:
- •3. Укажите 3 зависимости, выражающие закон Вант-Гоффа:
- •4. Выберите 3 ответа, формулирующие закон Вант-Гоффа:
- •5. Укажите 4 характеристики явления гемолиза в организме:
- •6. Укажите 4 характеристики явления плазмолиза в организме:
- •7. Выберите 3 формулировки изотонического, гипотонического и гипертонического растворов:
- •8. Укажите 4 фактора, объясняющие суть закона Рауля:
- •9. Выберите 5 правильных ответов, характеризующих законы криоскопии и эбуллиоскопии:
- •10. Выберите 3 ответа, характеризующие изотонический коэффициент:
- •11. Выберите 3 физических свойства разбавленных растворов, зависящие от концентрации растворенных веществ в растворе:
- •12. Назовите 3 условия, при которых происходит явление осмоса:
- •Глава II. Электрохимия
- •§ 1. Электропроводимость растворов электролитов. Кондуктометрическое титрование
- •Удельное сопротивление ряда биологических Жидкостей
- •Предельная молярная электропроводимость ионов в воде (18 °c)
- •§ 2. Потенциалы и электродвижущие силы
- •Некоторые стандартные потенциалы восстановления
- •Стандартные окислительно-восстановительные потенциалы
- •§ 3. Гальванические элементы
- •§ 4. Типы электродов
- •§ 5. Электрохимия в медицине
- •§ 6. Экспериментальная часть
- •Вопрос 1. Почему при бесконечном разведении раствора скорости движения различных ионов не будут зависеть друг от друга?
- •§ 7. Потенциометрия. Потенциометрическое титрование
- •Потенциалы электродов сравнения при различных температурах
- •§ 8. Экспериментальная часть
- •Метод «круглого стола»
- •§ 8. Обучающе-контролирующие тесты
- •1. Укажите 5 ответов, дающих характеристику электропроводимости:
- •16. Выберите 4 ответа, отражающие изменения кривой кондуктометрического титрования сильной кислоты сильным основанием:
- •17. Выберите 4 ответа, отражающие изменения кривой кондуктометрического титрования слабой кислоты сильным основанием:
- •18. Выберите 4 ответа, отражающие изменения кривой при титровании смеси сильной и слабой кислот:
- •19. Укажите 4 ответа с данными об электропроводимости биологических жидкостей при различных заболеваниях:
- •20. Укажите 3 ответа со значениями электропроводности при различном состоянии кислотности в желудке:
- •21. Укажите 5 видов и характеристику потенциалов, возникающих на границах раздела фаз:
- •36. Укажите 4 типа электродов и их правильные характеристики:
- •Коллоидная химия
- •Глава III. Физико-химия поверхностных явлений
- •§ I. Поверхностные явления и их значение в биологии и медицине
- •§ 2. Поверхностная энергия и поверхностное натяжение
- •Поверхностное натяжение некоторых веществ в жидком состоянии на границе с воздухом или паром
- •§ 3. Адсорбция и поверхностное натяжение
- •§ 4. Поверхностно-активные и поверхностно- инактивные вещества
- •§ 5. Изотермы поверхностного натяжения
- •§ 6. Адсорбция на границе раздела жидкость – газ и жидкость – жидкость
- •§ 7. Адсорбция на границе раздела твердое тело – газ и твердое тело – жидкость (раствор)
- •§ 8. Ориентация молекул в поверхностном слое и структура биологических мембран
- •§ 9. Адсорбция из растворов электролитов
- •§ 10. Хроматография, ее сущность и применение в биологии и медицине
- •§ 11. Экспериментальная часть
- •Задания для самостоятельной работы
- •Конкурс «кот в мешке»
- •§ 12. Обучающе-контролирующие тесты
- •7. Укажите 3 ответа, поясняющие уравнение Фрейндлиха:
- •8. Укажите 4 ответа, поясняющие уравнение Ленгмюра:
- •9. Укажите 3 ответа с правильной характеристикой трех частей изотермы адсорбции Ленгмюра:
- •10. Укажите 3 операции, проводимые при определении величины адсорбции на твердой поверхности:
- •11. Выберите 5 характеристик гидрофильности или гидрофобности некоторых видов поверхности:
- •12. Выберите 3 правила, которым подчиняется адсорбция растворенного вещества на твердой поверхности:
- •13. Укажите 5 примеров молекулярной и ионной адсорбции на угле:
- •24. Укажите 3 фактора, от которых зависит адсорбция газов твердым адсорбентом:
- •25. Укажите 3 фактора, от которых зависит адсорбция на границе твердое тело – раствор.
- •Глава IV. Физико-химия дисперсных систем
- •§ 1. Дисперсные системы и их классификация
- •Изменение удельной поверхности при дроблении
- •1 См3 вещества
- •Классификация систем по степени дисперсности
- •Классификация дисперсных систем по агрегатном состоянию дисперсной фазы и дисперсионной среды
- •§ 2. Коллоидное состояние. Методы получения и очистки коллоидных растворов
- •Диспергирование Конденсация
- •§ 3. Молекулярно-кинетические свойства коллоидных систем
- •§ 4. Оптические свойства коллоидных систем
- •§ 5. Классификация коллоидных систем
- •§ 6. Возникновение двойного электрического слоя и его строение
- •§ 7. Строение коллоидных частиц
- •§ 8. Электрокинетическне явления. Электрофорез и использование его в медицине
- •§ 9. Устойчивость коллоидных систем
- •Коагуляция золей As2s3 и Fe(oh)3 электролитами
- •§ 10. Пептизация. Коллоидная защита
- •§ 11. Аэрозоли и их Практическое Значение
- •§ 12. Суспензии, методы их получения и свойства
- •§ 13. Эмульсии, методы их получения и свойства
- •§ 14. Коллоидные поверхностно-активные вещества (пав)
- •§ 15. Экспериментальная часть
- •§ 16. Обучающе-контролирующие тесты
- •1. Укажите 4 характеристики состава и свойств дисперсных систем:
- •2. Укажите 3 типа дисперсных систем согласно классификации по размеру частиц:
- •19. Укажите 4 характеристики поверхностно-активных и поверхностно-инактивных веществ.
- •20. Физическая и коллоидная химия. Под ред. А.П. Беляева. Изд. Группа «гэотар-Медиа», – м.:, 2010. Оглавление
- •Коллоидная химия
- •Сталина Салиховна касымова физическая и коллоидная химия
§ 8. Экспериментальная часть
ЗАНЯТИЕ № 5
Тема: Потенциометрическое титрование.
Цель: Ознакомиться с методами потенциометрического титрования. Этот метод применяется в биохимических, клинических и санитарно-гигиенических лабораториях для определения рН крови, спинномозговой жидкости, суспензии бактериальных клеток, систем, содержащих агрессивные по отношению к индикаторам вещества и др. Он также используется для определения концентрации биологически активных и лекарственных веществ в биологических объектах.
Работа 1. Определение концентрации раствора кислоты методом потенциометрического титрования.
В стакан для титрования внести 30 мл раствора HCl неизвестной концентрации. Промытые дистиллированной водой стеклянный и хлорсеребрянный электроды погрузить в стакан с раствором кислоты и измерить исходные значения ЭДС (Е) или рН раствора на рН-метре или иономере ЭВ-74. Затем раствор кислоты титровать 0,1 н. раствором щелочи, приливая непосредственно в стакан титрант из бюретки порциями по 0,5 мл и раствор перемешивать магнитной мешалкой. Изменение ЭДС или рН раствора после добавления каждой порции титранта фиксируется после того, как показания прибора примут установившиеся значения. Наибольшее значение ЭДС или рН соответствует точке эквивалентности (скачок титрования). После скачка титрования добавить еще 4–5 порций титранта. Результаты внести в табл 1.
Для определения точки эквивалентности построить обычную (интегральную) кривую титрования в координатах Е (рН) – VNaOH и дифференциальную в координатах Е/V (рН/V) – VNaOH. Точка эквивалентности на первой кривой определяется как середина вертикального участка (скачка титрования), на второй кривой – как максимум. Из кривых определить точку эквивалентности и объем титранта (VNaOH), соответствующий точке эквивалентности. Затем рассчитать нормальную концентрацию кислоты по формуле:
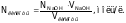
Для определения точки эквивалентности построить обычную (интегральную) кривую титрования в координатах Е (рН) – VNaOH и дифференциальную в координатах Е/V (рН/V) – VNaOH. Точка эквивалентности на первой кривой определяется как середина вертикального участка (скачка титрования), на второй кривой – как максимум. Из кривых определить точку эквивалентности и объем титранта (VNaOH), соответствующий точке эквивалентности. Затем рассчитать нормальную концентрацию кислоты по формуле:
После окончания работы выключить прибор, ополоснуть электроды и опустить их в дистиллированную воду. Оформленную работу сдать на подпись преподавателю.
Контрольные вопросы и задания
1. На чем основано потенциометрическое титрование? Перечислите типы химических реакций, лежащие в основе потенциометрического титрования.
2. Назовите методы потенциометрического титрования.
3. Для чего применяют индикаторные электроды и электроды сравнения, применяемые в потенциометрическом титровании? В чем заключается принцип выбора электродов?
4. Простые и дифференциальные кривые титрования. Как определяют эквивалентный объем при потенциометрическом титровании?

5. По какому уравнению рассчитывают концентрацию исследуемого раствора?
6. Как в потенциометрическом титровании измеряется эквивалентный объем?
7. Когда следует заканчивать потенциометрическое титрование?
8. В каких координатах строится дифференциальная кривая титрования?
9. Почему при потенциометрическом титровании пользуются грубым диапазоном измерений ЭДС иономера ЭВ-74?
10. Нарисуйте и объясните ход простой (интегральной) кривой потенциометрического титрования.
11. Почему вблизи точки эквивалентности происходит резкое изменение потенциала индикаторного электрода, погруженного в титруемый раствор?
12. От каких факторов зависит величина скачка при потенциометрическом титровании?
13. Каковы преимущества дифференциальной кривой потенциометрического титрования перед интегральной кривой?
14. Приведите пример использования ионоселективного электрода для потенциометрического титрования.
15. Опишите устройство хлорсеребряного электрода.
16. В чем заключается разница между прямыми и косвенными потенциометрическими методами?
Задача № 1. Найти рН раствора, в котором потенциал хингидронного электрода при 298 К равен 0,400 В.
Задача № 2. ЭДС хингидронного-каломельного (насыщенного) элемента при 298 К равна 0,121 В.Написать схему данного элемента и рассчитать значение рН раствора.
Работа 2. Измерение рН растворов различной концентрации с помощью стеклянного электрода.
Приготовить прибор – иономер ЭВ-74 к работе, аналогично тому, как это было описано ранее. После установки нужной температуры нажимают клавишу предполагаемого рода работ: анионы/катионы и рХ. Настроить прибор по стандартному буферному раствору с известным значением рН.
Составить гальванический элемент из стеклянного электрода, опущенного в исследуемый раствор HCl, и электрода сравнения, входящего в комплект ЭВ-74 (например, хлорсеребряный электрод). Подключить гальванический элемент к ЭВ-74 и измерять рН исследуемого раствора при различной концентрации, как указанно в табл. 2. Перед измерением произвести корректировку шкалы прибора по буферному раствору.
Для этого необходимо налить в стаканчик буферный раствор, опустить хлорсеребряный и стеклянный электроды в этот раствор и подключить электроды к прибору. Далее нажимают клавишу интервала «11/419» и ручкой «калибровка» подвести стрелку к известному значению рН стандартного раствора на нижней шкале (№ 4). Если значение рН стандартного раствора меньше 4, нажать клавишу –11/44 и стрелку вновь подвести к точному значению рН стандартного раствора по средней из трех верхних шкал (№ 2). Если же значение рН стандартного буферного раствора больше 4, определить узкий диапазон, в который попадет это значение, нажать нужную клавишу (41/49 или 91/414) и стрелку подвести к точному значению, равному рН-4 или рН-9) соответственно по нижней шкале из трех верхних шкал (№ 3).
Заполнить стакан исследуемым раствором (предварительно ополоснув им электроды и стакан), опустить в него электроды и измерить приблизительное значение рН, для этого нажать клавишу «-11/419» и снять показания стрелки по шкале № 4. После этого определить точное значение рН исследуемого раствора, нажав клавишу того узкого диапазона измерений, в который входит приблизительное значение рН, и по шкале № 2 или № 3 определить точное значение рН. При этом необходимо учесть, что для диапазона «-11/44» (шкала № 2) показание стрелки уже соответствует самому значению рН. Шкала № 3 используется для двух остальных узких диапазонов «41/49» и «91/414».
Для отсчета рН по этой шкале к начальному значению диапазона прибавляют показание стрелки. Студенты должны определить рН двух-трех растворов по указанию преподавателя. Полученные данные внести в табл. 2.
Сделать выводы, записать в журнал.
Таблица 2

После окончания работы прибор выключить, сполоснуть электроды и опустить их в дистиллированную воду. Полученные данные сдаются преподавателю на подпись.
