
- •5720100 – Лечебное дело
- •Isbn 978-9943-05-412-7
- •Предисловие
- •Глава I. Учение о растворах
- •§ 1. Роль растворов в жизнедеятельности организмов. Вода как растворитель
- •§ 2. Растворимость газов в жидкостях
- •§ 3. Кессонная болезнь
- •§ 4. Закон и.М. Сеченова
- •§ 5. Осмос и осмотическое давление
- •§ 6. Закон вант-гоффа
- •§ 7. Роль осмоса и осмотического давления в биологических системах. Плазмолиз и гемолиз
- •§ 8. Коллигативные свойства растворов
- •1. Коллигативные свойства ионных растворов
- •2. Понижение давления насыщенного пара растворителя над раствором
- •3. Понижение температуры замерзания растворов
- •4. Повышение температуры кипения растворов
- •5. Взаимосвязь между коллигативными свойствами растворов и осмотическим давлением. Определение осмотического давления криоскопическим методом
- •6. Применение криоскопии и эбуллиоскопии
- •§ 9. Экспериментальная часть
- •§ 10. Обучающе-контролирующие тесты
- •1. Укажите 4 характерных признака явления осмоса:
- •2. Укажите 3 фактора, от которых зависит величина осмотического давления:
- •3. Укажите 3 зависимости, выражающие закон Вант-Гоффа:
- •4. Выберите 3 ответа, формулирующие закон Вант-Гоффа:
- •5. Укажите 4 характеристики явления гемолиза в организме:
- •6. Укажите 4 характеристики явления плазмолиза в организме:
- •7. Выберите 3 формулировки изотонического, гипотонического и гипертонического растворов:
- •8. Укажите 4 фактора, объясняющие суть закона Рауля:
- •9. Выберите 5 правильных ответов, характеризующих законы криоскопии и эбуллиоскопии:
- •10. Выберите 3 ответа, характеризующие изотонический коэффициент:
- •11. Выберите 3 физических свойства разбавленных растворов, зависящие от концентрации растворенных веществ в растворе:
- •12. Назовите 3 условия, при которых происходит явление осмоса:
- •Глава II. Электрохимия
- •§ 1. Электропроводимость растворов электролитов. Кондуктометрическое титрование
- •Удельное сопротивление ряда биологических Жидкостей
- •Предельная молярная электропроводимость ионов в воде (18 °c)
- •§ 2. Потенциалы и электродвижущие силы
- •Некоторые стандартные потенциалы восстановления
- •Стандартные окислительно-восстановительные потенциалы
- •§ 3. Гальванические элементы
- •§ 4. Типы электродов
- •§ 5. Электрохимия в медицине
- •§ 6. Экспериментальная часть
- •Вопрос 1. Почему при бесконечном разведении раствора скорости движения различных ионов не будут зависеть друг от друга?
- •§ 7. Потенциометрия. Потенциометрическое титрование
- •Потенциалы электродов сравнения при различных температурах
- •§ 8. Экспериментальная часть
- •Метод «круглого стола»
- •§ 8. Обучающе-контролирующие тесты
- •1. Укажите 5 ответов, дающих характеристику электропроводимости:
- •16. Выберите 4 ответа, отражающие изменения кривой кондуктометрического титрования сильной кислоты сильным основанием:
- •17. Выберите 4 ответа, отражающие изменения кривой кондуктометрического титрования слабой кислоты сильным основанием:
- •18. Выберите 4 ответа, отражающие изменения кривой при титровании смеси сильной и слабой кислот:
- •19. Укажите 4 ответа с данными об электропроводимости биологических жидкостей при различных заболеваниях:
- •20. Укажите 3 ответа со значениями электропроводности при различном состоянии кислотности в желудке:
- •21. Укажите 5 видов и характеристику потенциалов, возникающих на границах раздела фаз:
- •36. Укажите 4 типа электродов и их правильные характеристики:
- •Коллоидная химия
- •Глава III. Физико-химия поверхностных явлений
- •§ I. Поверхностные явления и их значение в биологии и медицине
- •§ 2. Поверхностная энергия и поверхностное натяжение
- •Поверхностное натяжение некоторых веществ в жидком состоянии на границе с воздухом или паром
- •§ 3. Адсорбция и поверхностное натяжение
- •§ 4. Поверхностно-активные и поверхностно- инактивные вещества
- •§ 5. Изотермы поверхностного натяжения
- •§ 6. Адсорбция на границе раздела жидкость – газ и жидкость – жидкость
- •§ 7. Адсорбция на границе раздела твердое тело – газ и твердое тело – жидкость (раствор)
- •§ 8. Ориентация молекул в поверхностном слое и структура биологических мембран
- •§ 9. Адсорбция из растворов электролитов
- •§ 10. Хроматография, ее сущность и применение в биологии и медицине
- •§ 11. Экспериментальная часть
- •Задания для самостоятельной работы
- •Конкурс «кот в мешке»
- •§ 12. Обучающе-контролирующие тесты
- •7. Укажите 3 ответа, поясняющие уравнение Фрейндлиха:
- •8. Укажите 4 ответа, поясняющие уравнение Ленгмюра:
- •9. Укажите 3 ответа с правильной характеристикой трех частей изотермы адсорбции Ленгмюра:
- •10. Укажите 3 операции, проводимые при определении величины адсорбции на твердой поверхности:
- •11. Выберите 5 характеристик гидрофильности или гидрофобности некоторых видов поверхности:
- •12. Выберите 3 правила, которым подчиняется адсорбция растворенного вещества на твердой поверхности:
- •13. Укажите 5 примеров молекулярной и ионной адсорбции на угле:
- •24. Укажите 3 фактора, от которых зависит адсорбция газов твердым адсорбентом:
- •25. Укажите 3 фактора, от которых зависит адсорбция на границе твердое тело – раствор.
- •Глава IV. Физико-химия дисперсных систем
- •§ 1. Дисперсные системы и их классификация
- •Изменение удельной поверхности при дроблении
- •1 См3 вещества
- •Классификация систем по степени дисперсности
- •Классификация дисперсных систем по агрегатном состоянию дисперсной фазы и дисперсионной среды
- •§ 2. Коллоидное состояние. Методы получения и очистки коллоидных растворов
- •Диспергирование Конденсация
- •§ 3. Молекулярно-кинетические свойства коллоидных систем
- •§ 4. Оптические свойства коллоидных систем
- •§ 5. Классификация коллоидных систем
- •§ 6. Возникновение двойного электрического слоя и его строение
- •§ 7. Строение коллоидных частиц
- •§ 8. Электрокинетическне явления. Электрофорез и использование его в медицине
- •§ 9. Устойчивость коллоидных систем
- •Коагуляция золей As2s3 и Fe(oh)3 электролитами
- •§ 10. Пептизация. Коллоидная защита
- •§ 11. Аэрозоли и их Практическое Значение
- •§ 12. Суспензии, методы их получения и свойства
- •§ 13. Эмульсии, методы их получения и свойства
- •§ 14. Коллоидные поверхностно-активные вещества (пав)
- •§ 15. Экспериментальная часть
- •§ 16. Обучающе-контролирующие тесты
- •1. Укажите 4 характеристики состава и свойств дисперсных систем:
- •2. Укажите 3 типа дисперсных систем согласно классификации по размеру частиц:
- •19. Укажите 4 характеристики поверхностно-активных и поверхностно-инактивных веществ.
- •20. Физическая и коллоидная химия. Под ред. А.П. Беляева. Изд. Группа «гэотар-Медиа», – м.:, 2010. Оглавление
- •Коллоидная химия
- •Сталина Салиховна касымова физическая и коллоидная химия
§ 3. Молекулярно-кинетические свойства коллоидных систем
Коллоидные системы по своим молекулярно-кинетическим свойствам (броуновскому движению, диффузии, осмотическому давлению, седиментации) отличаются от растворов низкомолекулярных веществ, главным образом, лишь благодаря более значительным размерам своих частиц. Как и молекулы истинного раствора, коллоидные частицы золей находятся в непрерывном беспорядочном движении. Непрерывное самопроизвольное движение коллоидных частиц, взвешенных в жидкости или газе, называется броуновским движением по имени английского ботаника Роберта Броуна, который в 1827 г. впервые наблюдал такое движение, исследуя водную суспензию цветочной пыльцы.
Непрерывное движение препятствует оседанию частиц и способствует устойчивости коллоидных систем. Интенсивность движения значительно уменьшается с увеличением размера частиц. Броуновское движение можно наблюдать при работе с ультрамикроскопом. Если сосредоточить внимание на одной какой-либо частице и проследить ее путь в определенный промежуток времени, фиксируя положение частицы, например через каждые 30 с, то получится картина, показанная на рис. 5, 6 для гуммигутовой суспензии по наблюдениям Ж. Перрена (1909 г.).
Теорию броуновского движения разработали А. Эйнштейн и М. Смолуховский в 1906 г., основываясь на молекулярно-кинетических закономерностях. Экспериментально было показано, что броуновское движение не зависит от природы вещества, а определяется размером частиц, температурой и вязкостью среды. Чем меньше частицы и вязкость и выше температура, тем энергичнее движутся частицы. Причем это движение не затухает со временем. Экспериментальные данные подтвердили, что броуновское движение коллоидных частиц вызывается беспорядочными ударами молекул окружающей среды, находящихся в состоянии оживленного теплового движения и отражает характер и законы теплового движения невидимых молекул. Изучение броуновского движения подтвердило реальность существования молекул.
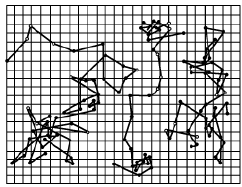
Рис. 7. Броуновское движение коллодных частиц.
Точками показано движение частиц через определенные промежутки времени. Линии, соединяющие точки, показывают приблизительный характер зигзагообразного поступательного движения коллоидных частиц в растворе
У большинства грубых дисперсий размеры частицы слишком велики и действие всех ударов взаимно уравновешивается и никаких перемещений частицы наблюдать нельзя.
Броуновское движение является причиной диффузии частиц в коллоидных системах. Диффузия – самопроизвольно протекающий процесс выравнивания концентраций в любых дисперсных системах, частицы которых находятся в беспорядочном тепловом движении. Скорость диффузии обратно пропорциональна размеру диффундирующих частиц и вязкости дисперсионной среды.
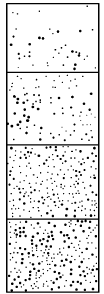 Рис.
8.
Схематическое изображение данных
Перрена по
Рис.
8.
Схематическое изображение данных
Перрена по
распределению частиц гуммигута на
различной глубине
Она также зависит от температуры и увеличивается с повышением температуры. Эта зависимость была предложена А. Эйнштейном в 1906 году:
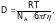
где D – скорость диффузии; R – газовая постоянная; Т – абсолютная температура; NA – постоянная Авогадро; r – радиус диффундирующих молекул или частиц, представленных в виде шариков; – вязкость растворителя, дисперсионной среды или газа.
В коллоидных системах частицы обладают значительно большими размерами и большей массой, чем молекулы растворенного вещества в истинном растворе, поэтому скорость теплового движения коллоидных частиц будет во много раз меньше скорости движения молекул. Следовательно, чем крупнее частицы и чем соответственно меньше скорость их движения, тем меньше и скорость их диффузии. С помощью формулы А. Эйнштейна, зная скорость диффузии, можно определить размеры диффундирующих частиц и молекулярную массу вещества дисперсной фазы.
Для коллоидных растворов, как и для истинных, характерно осмотическое давление. Если коллоидный раствор и чистая жидкость разделены мембраной, непроницаемой для коллоидных частиц и проницаемой для молекул жидкости, то наличие мембраны ограничивает свободное передвижение коллоидных частиц по направлению чистой жидкости. Появляющееся различие в концентрации раствора по обе стороны мембраны путем свободной диффузии не выравнивается. Неспособность к прохождению через полупроницаемые мембраны, являющаяся одним из характерных отличий коллоидных систем от растворов низкомолекулярных веществ, используется в методах диализа и ультрафильтрации для очистки и концентрирования растворов. Для выравнивания содержания растворителя в обеих фазах и получения равновесной системы, необходимо приложить к раствору избыточное давление, которое и называется осмотическим давлением раствора. Осмотическое давление зависит от числа частиц в единице объема коллоидного раствора и не зависит от их природы. Так как коллоидные частицы обладают большими размерами и большей массой, чем молекулы истинных растворов, то при одной и той же массовой доле (в %) коллоидного и истинного растворов в единице объема коллоида частиц содержится намного меньше, чем в единице объема истинного раствора (молярная концентрация), поэтому и осмотическое давление коллоидных растворов должно быть очень небольшим (осмотическое давление 1% раствора сахара – 6,8·104 Па, а 1% раствора золя As2S3 – 3,5 Па).
В связи с тем, что коллоидные растворы нельзя получить в больших концентрациях, их осмотическое давление очень незначительно, что затрудняет наблюдения в обычных условиях. Малые значения осмотического давления коллоидных растворов, обусловленные относительно малой их концентрацией, приводят к ничтожно малым изменениям всех других свойств: понижение давления пара, понижение температуры замерзания, повышение температуры кипения по сравнению с чистым растворителем.
Ограничение диффузионной способности коллоидных частиц возникает не только при наличии мембраны, но и при соединении коллоидных частиц между собой, например, в виде геля, поэтому осмотические явления имеют место также в гелях, ионообменных адсорбентах и в других системах.
Понятие об агрегативной и молекулярно-кинетической устойчивости коллоидных систем ввел Н.П. Песков.
Агрегативная устойчивость объясняется, с одной стороны, наличием у коллоидных частиц одноименных зарядов, что мешает им соединяться в более крупные агрегаты. С другой стороны агрегативную устойчивость коллоидных систем можно объяснить тем, что вокруг коллоидных частиц могут образовываться тесно связанные с ними сольватные оболочки из молекул растворителя.
Переход коллоидов в истинный раствор вызывается увеличением дисперсности, в то время как противоположный процесс идет за счет слипания коллоидных частиц, ведущего к увеличению их размера. Это явление называется коагуляцией (от лат. coagulatio – створаживание). Внешне коагуляция часто сопровождается появлением мути, изменением окраски коллоидных растворов и, наконец, образованием осадка. Явление выпадения дисперсной фазы в осадок называется седиментацией (оседанием).
На коллоидные частицы, распределенные в дисперсионной среде, действуют в противоположных направлениях две силы. Под действием силы тяжести все коллоидные частицы, независимо от их природы стремятся осесть на дно – седиментировать (от лат. sedimentum – осадок).
Скорость оседания частиц определяется по уравнению:

где V – скорость оседания частиц, см/с;
r – радиус частиц;
 –
плотность
диспергированного вещества;
–
плотность
диспергированного вещества;
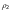 –
плотность
растворителя;
–
плотность
растворителя;
 –
вязкость
среды; 218
–
вязкость
среды; 218
 2/9
g (g – ускорение силы тяжести).
2/9
g (g – ускорение силы тяжести).
Силы диффузии, наоборот, стремятся распределить частицы равномерно по всему объему системы. Чем меньше частицы, тем сильнее оказывает влияние диффузия или броуновское движение. В результате в системе устанавливается определенное равновесие – распределение частиц по высоте – седиментационное равновесие.
Способность дисперсных систем сохранять определенное распределение частиц в объеме раствора называется седиментационной, или кинетической устойчивостью. Грубодисперсные системы кинетически неустойчивы, статистическое равновесие между действием сил тяготения и броуновского движения таково, что основная масса частиц оседает. Молекулярные системы (газы, растворы) обладают очень высокой кинетической устойчивостью, так как частицы их довольно легки и диффузия преобладает над силами тяжести и происходит выравнивание концентраций во всем объеме системы. Кинетическая устойчивость коллоидных систем зависит от размеров их частиц: чем меньше размер частиц, тем более кинетически устойчив коллоидный раствор.
Впервые идея замены силы земного тяготения более значительной центробежной силой для того, чтобы вызвать заметное оседание частиц в системах с высокой кинетической устойчивостью, была предложена А.В. Думанским в 1913 г. Для принудительного оседаниия коллоидных частиц он применил центрифугу. Затем Т. Сведберг в 1923 г. разработал специальные высокоскоростные центрифуги с большим числом оборотов – ультрацентрифуги. Если седиментационный анализ проводится с помощью ультрацентрифуги, то обычно применяют термин «ультрацентрифугирование».
С помощью ультрацентрифуги, также, как и избирательной гельфильтрации, осуществляется разделение ВМС, содержащих макромолекулы данного вещества разной длины, на отдельные фракции, доказана однородность молекул большинства природных белков. Кроме того, этот метод позволил изучить свойства ферментов, гормонов, вирусов, установить молекулярную степень дисперсности частиц в растворах ВМС, а также исследовать растворы низкомолекулярных веществ.
