
- •5720100 – Лечебное дело
- •Isbn 978-9943-05-412-7
- •Предисловие
- •Глава I. Учение о растворах
- •§ 1. Роль растворов в жизнедеятельности организмов. Вода как растворитель
- •§ 2. Растворимость газов в жидкостях
- •§ 3. Кессонная болезнь
- •§ 4. Закон и.М. Сеченова
- •§ 5. Осмос и осмотическое давление
- •§ 6. Закон вант-гоффа
- •§ 7. Роль осмоса и осмотического давления в биологических системах. Плазмолиз и гемолиз
- •§ 8. Коллигативные свойства растворов
- •1. Коллигативные свойства ионных растворов
- •2. Понижение давления насыщенного пара растворителя над раствором
- •3. Понижение температуры замерзания растворов
- •4. Повышение температуры кипения растворов
- •5. Взаимосвязь между коллигативными свойствами растворов и осмотическим давлением. Определение осмотического давления криоскопическим методом
- •6. Применение криоскопии и эбуллиоскопии
- •§ 9. Экспериментальная часть
- •§ 10. Обучающе-контролирующие тесты
- •1. Укажите 4 характерных признака явления осмоса:
- •2. Укажите 3 фактора, от которых зависит величина осмотического давления:
- •3. Укажите 3 зависимости, выражающие закон Вант-Гоффа:
- •4. Выберите 3 ответа, формулирующие закон Вант-Гоффа:
- •5. Укажите 4 характеристики явления гемолиза в организме:
- •6. Укажите 4 характеристики явления плазмолиза в организме:
- •7. Выберите 3 формулировки изотонического, гипотонического и гипертонического растворов:
- •8. Укажите 4 фактора, объясняющие суть закона Рауля:
- •9. Выберите 5 правильных ответов, характеризующих законы криоскопии и эбуллиоскопии:
- •10. Выберите 3 ответа, характеризующие изотонический коэффициент:
- •11. Выберите 3 физических свойства разбавленных растворов, зависящие от концентрации растворенных веществ в растворе:
- •12. Назовите 3 условия, при которых происходит явление осмоса:
- •Глава II. Электрохимия
- •§ 1. Электропроводимость растворов электролитов. Кондуктометрическое титрование
- •Удельное сопротивление ряда биологических Жидкостей
- •Предельная молярная электропроводимость ионов в воде (18 °c)
- •§ 2. Потенциалы и электродвижущие силы
- •Некоторые стандартные потенциалы восстановления
- •Стандартные окислительно-восстановительные потенциалы
- •§ 3. Гальванические элементы
- •§ 4. Типы электродов
- •§ 5. Электрохимия в медицине
- •§ 6. Экспериментальная часть
- •Вопрос 1. Почему при бесконечном разведении раствора скорости движения различных ионов не будут зависеть друг от друга?
- •§ 7. Потенциометрия. Потенциометрическое титрование
- •Потенциалы электродов сравнения при различных температурах
- •§ 8. Экспериментальная часть
- •Метод «круглого стола»
- •§ 8. Обучающе-контролирующие тесты
- •1. Укажите 5 ответов, дающих характеристику электропроводимости:
- •16. Выберите 4 ответа, отражающие изменения кривой кондуктометрического титрования сильной кислоты сильным основанием:
- •17. Выберите 4 ответа, отражающие изменения кривой кондуктометрического титрования слабой кислоты сильным основанием:
- •18. Выберите 4 ответа, отражающие изменения кривой при титровании смеси сильной и слабой кислот:
- •19. Укажите 4 ответа с данными об электропроводимости биологических жидкостей при различных заболеваниях:
- •20. Укажите 3 ответа со значениями электропроводности при различном состоянии кислотности в желудке:
- •21. Укажите 5 видов и характеристику потенциалов, возникающих на границах раздела фаз:
- •36. Укажите 4 типа электродов и их правильные характеристики:
- •Коллоидная химия
- •Глава III. Физико-химия поверхностных явлений
- •§ I. Поверхностные явления и их значение в биологии и медицине
- •§ 2. Поверхностная энергия и поверхностное натяжение
- •Поверхностное натяжение некоторых веществ в жидком состоянии на границе с воздухом или паром
- •§ 3. Адсорбция и поверхностное натяжение
- •§ 4. Поверхностно-активные и поверхностно- инактивные вещества
- •§ 5. Изотермы поверхностного натяжения
- •§ 6. Адсорбция на границе раздела жидкость – газ и жидкость – жидкость
- •§ 7. Адсорбция на границе раздела твердое тело – газ и твердое тело – жидкость (раствор)
- •§ 8. Ориентация молекул в поверхностном слое и структура биологических мембран
- •§ 9. Адсорбция из растворов электролитов
- •§ 10. Хроматография, ее сущность и применение в биологии и медицине
- •§ 11. Экспериментальная часть
- •Задания для самостоятельной работы
- •Конкурс «кот в мешке»
- •§ 12. Обучающе-контролирующие тесты
- •7. Укажите 3 ответа, поясняющие уравнение Фрейндлиха:
- •8. Укажите 4 ответа, поясняющие уравнение Ленгмюра:
- •9. Укажите 3 ответа с правильной характеристикой трех частей изотермы адсорбции Ленгмюра:
- •10. Укажите 3 операции, проводимые при определении величины адсорбции на твердой поверхности:
- •11. Выберите 5 характеристик гидрофильности или гидрофобности некоторых видов поверхности:
- •12. Выберите 3 правила, которым подчиняется адсорбция растворенного вещества на твердой поверхности:
- •13. Укажите 5 примеров молекулярной и ионной адсорбции на угле:
- •24. Укажите 3 фактора, от которых зависит адсорбция газов твердым адсорбентом:
- •25. Укажите 3 фактора, от которых зависит адсорбция на границе твердое тело – раствор.
- •Глава IV. Физико-химия дисперсных систем
- •§ 1. Дисперсные системы и их классификация
- •Изменение удельной поверхности при дроблении
- •1 См3 вещества
- •Классификация систем по степени дисперсности
- •Классификация дисперсных систем по агрегатном состоянию дисперсной фазы и дисперсионной среды
- •§ 2. Коллоидное состояние. Методы получения и очистки коллоидных растворов
- •Диспергирование Конденсация
- •§ 3. Молекулярно-кинетические свойства коллоидных систем
- •§ 4. Оптические свойства коллоидных систем
- •§ 5. Классификация коллоидных систем
- •§ 6. Возникновение двойного электрического слоя и его строение
- •§ 7. Строение коллоидных частиц
- •§ 8. Электрокинетическне явления. Электрофорез и использование его в медицине
- •§ 9. Устойчивость коллоидных систем
- •Коагуляция золей As2s3 и Fe(oh)3 электролитами
- •§ 10. Пептизация. Коллоидная защита
- •§ 11. Аэрозоли и их Практическое Значение
- •§ 12. Суспензии, методы их получения и свойства
- •§ 13. Эмульсии, методы их получения и свойства
- •§ 14. Коллоидные поверхностно-активные вещества (пав)
- •§ 15. Экспериментальная часть
- •§ 16. Обучающе-контролирующие тесты
- •1. Укажите 4 характеристики состава и свойств дисперсных систем:
- •2. Укажите 3 типа дисперсных систем согласно классификации по размеру частиц:
- •19. Укажите 4 характеристики поверхностно-активных и поверхностно-инактивных веществ.
- •20. Физическая и коллоидная химия. Под ред. А.П. Беляева. Изд. Группа «гэотар-Медиа», – м.:, 2010. Оглавление
- •Коллоидная химия
- •Сталина Салиховна касымова физическая и коллоидная химия
§ 9. Адсорбция из растворов электролитов
Сильные электролиты в водных растворах практически полностью диссоциированы на ионы. Поэтому наряду с нейтральными молекулами из растворов могут адсорбироваться ионы, которые несут на поверхность адсорбента электрические заряды. Так как поверхность адсорбента посылает в раствор ионы этого же знака, то при ионообменном процессе эти заряды исчезают:
АNa+, H+ → AH + Na+,
где А – адсорбент, содержащий ионы Na+.
Заряды на данной поверхности могут сохраняться или нейтрализоваться в результате притягивания из раствора ионов противоположного знака. Это приводит к образованию сложных слоев на поверхности адсорбента. Явление ионного обмена впервые обнаружено в 1850 году и оно широко распространено в живой и неживой природе.
Адсорбция ионов из растворов электролитов называется ионной. Ионная адсорбция – более сложное явление, чем молекулярная. Она обусловлена химическими и электростатическими силами. Адсорбция ионов в значительной степени зависит от природы адсорбента. Ионы, способные поляризоваться, адсорбируются обычно поверхностью веществ, состоящих из полярных молекул или ионов. Микроучастки поверхности, имеющие тот или иной заряд, адсорбируют только противоположно заряженные ионы. Противоионы накапливаются вблизи поверхности адсорбента, но не адсорбируются ею, а образуют двойной электрический слой.
Особенность ионной адсорбции – неравенство адсорбции катиона и аниона. Почти всегда один из ионов адсорбируется избирательно. Поэтому ионная адсорбция относится к избирательной адсорбции, при которой адсорбция одного из веществ значительно превосходит адсорбцию другого.
Избирательная адсорбция ионов подчиняется правилу Панета-Фаянса:
«На поверхности твердых веществ преимущественно адсорбируются ионы, входящие в состав его кристаллической решетки, или имеющие общую с поверхностью твердого тела атомную группировку».
Таким образом, ионную адсорбцию можно рассматривать как кристаллизацию, т.е. достройку кристаллической решетки твердого вещества.
Согласно правилу Панета – Фаянса, на поверхности хлорида серебра AgCl, полученного при реакции между AgNO3 и NaCl, избирательно адсорбируются только ионы Ag+ или Cl–, так как они содержатся в кристаллической решетке, но не ионы Na+, NO3– (рис. 14).
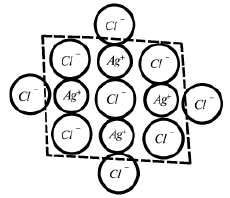
Рис. 14. Достройка кристалла AgCl в растворе NaCl
Ионы одинаковой валентности адсорбируются тем лучше, чем больше их радиус в кристаллической решетке, так как степень гидратации с увеличением радиуса уменьшается. Наличие гидратной оболочки уменьшает электростатические взаимодействия ионов и препятствует адсорбции.
Ионы, расположенные в порядке возрастания (или уменьшения) адсорбционной способности, образуют ряды, называемые лиотропными рядами или рядами Гофмейстера. Так, гидратированные катионы металлов I и II групп главных подгрупп могут быть расположены в следующие лиотропные ряды:
Li+ < Na+ < К+ < Rb+ < Cs+
Mg2+ < Ca2+ < Sr2+ < Ва2+
Увеличение степени гидратации
¬¾¾¾¾¾¾¾
Увеличение адсорбционной способности
¬¾¾¾¾¾¾¾
Для некоторых одновалентных анионов лиотропный ряд имеет вид:
Сl– < Br- < NO3– < I– < CNS– < OH–
Увеличение адсорбционной способности
¾¾¾¾¾®
Многовалентные ионы адсорбируются значительно лучше одновалентных, почти независимо от природы адсорбента:
K+ < Ca2+ < Al3+ < Th4+
Увеличение адсорбционной способности
¾¾¾¾¾®
Это имеет большое значение для коагуляции коллоидных растворов электролитами.
Наиболее распространенный вид ионной адсорбции – ионнообменная адсорбция. Она заключается в том, что твердый адсорбент (ионит) обменивается ионами с раствором (рис. 15), причем обмен происходит в эквивалентных количествах и подчиняется закону действия масс. В последнее время синтезированы разнообразные ионнообменные смолы – иониты, содержащие определенные активные группы, способные к обмену ионов с раствором электролита. По характеру действия ионнообменные смолы подразделяются на катиониты и аниониты. Катиониты обменивают катионы, аниониты – анионы. Если с высокомолекулярным каркасом ионита ковалентно связаны анионы, заряды которых уравновешены подвижными катионами, то такой ионит называют катионитом, так как при контакте с раствором электролита происходит обмен катионов между раствором и ионитом:
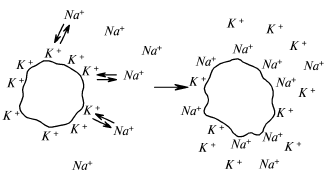
Рис. 15. Схема ионообменной адсорбции
R– (SO3–H+)n + nNa+D R – (SO3–Na+)n + nH+. (a)
Здесь R означает каркас молекулы ионита, не участвующего в обмене. В анионитах ковалентно связанные катионы уравновешиваются подвижными анионами, которые при соприкосновении с раствором электролитов способны к обмену:
R – (NH3+OH–)n + nCl–D R – (NH3+Cl–)n + nOH–. (б)
Количественная зависимость между обменивающимися ионами с зарядами n1 и n2 определяется по уравнению Б.П. Никольского:
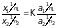 , (3)
, (3)
где х1 и х2 – масса адсорбированных ионов при равновесии; а1 и а2 – активности (или концентрации) этих ионов при равновесии; К – константа ионного обмена (константа равновесия процессов (а) или (б).
Основная характеристика ионита – количество поглощаемых им ионов – называется обменной емкостью. Обменная емкость ионитов выражается в молях извлекаемых из раствора ионов в расчете на 1 г сухого ионита.
Обменная емкость зависит от температуры, валентности ионов, их размеров, рН среды, природы ионита, концентрации обменивающихся ионов. Иониты обладают кислотными или основными свойствами, поэтому при обмене ионов играет роль рН среды. У катионов, обладающих свойствами сильных кислот, ионы Н+ легко обмениваются на другие катионы, а у проявляющих свойства слабых кислот – имеют малую обменную емкость, особенно при низких рН. Тo же самое можно сказать об анионитах, проявляющих свойства сильных и слабых оснований. С увеличением рН обменная емкость катионитов увеличивается, а анионитов падает.
Ионообменная адсорбция на ионитах широко применяется, например, для умягчения и опреснения воды. Жесткая вода фильтруется через катионит (искусственные алюмосиликаты щелочных металлов), при этом катионы Са2+ и Мg2+ из воды обмениваются на катионы щелочных металлов катионита. Если последовательно применять катиониты и аниониты, то можно очистить воду от всех примесей. Такая адсорбционная дистилляция воды более экономична, чем обычная перегонка, и с ее помощью можно опреснять морскую воду, воду соленых озер и колодцев. Особенно это важно в теплосиловых установках для предотвращения накипи на стенках котлов, для получения высококачественной воды для медицинских и фармацевтических целей. Ионный обмен имеет большое значение для очистки сточных вод от органических и неорганических веществ, для разработки безотходных производств и борьбы с загрязнением окружающей среды. В промышленности широко применяют твердые адсорбенты для избирательного поглощения из воздуха веществ, вредных для здоровья людей (например, сероуглерода в резиновой промышленности; летучих растворителей в производстве лаков, целлулоида, кинопленки и др.).
В пищевой промышленности ионообменная адсорбция применяется для очищения воды в пивоваренном производстве, для удаления из вина излишнего количества ионов Fe3+, Са2+, Сu2+, вызывающих помутнение вин, для получения ионитного молока с уменьшенным количеством солей кальция для детского питания, для удаления солей из сахарных сиропов, растворов фруктозы, дубильных веществ.
Иониты используются для очистки различных лекарственных препаратов, пепсина, трипсина, антител, гормонов, антибиотиков, витаминов, алкалоидов. С помощью ионитов производится удаление ионов кальция из плазмы крови перед консервацией, разделение пуриновых и пиримидиновых оснований, фракционирование белков и нуклеиновых кислот, беззондовое определение кислотности желудочного сока, регулирование состава ионной среды в желудочно-кишечном тракте. Амфотерные иониты пригодны для разделения смесей аминокислот. В организме человека наблюдается избирательная адсорбция токсинов и других ядовитых веществ различными тканями и клетками. Так, токсины возбудителей столбняка, ботулизма и др. поражают, прежде всего, клетки центральной нервной системы. Токсины возбудителей дизентерии действуют, прежде всего, на вегетативную нервную систему.
Иммунные белки (антитела), соединяющиеся только со строго определенными для каждого антитела чужеродными белками (антигенами), имеют высокую избирательность: антитела адсорбируются на поверхности брюшнотифозных бактерий только на отдельных участках. Именно избирательной адсорбцией объясняется хорошее окрашивание щелочных белков клеточных ядер, имеющих в нейтральной среде положительный заряд, кислыми красителями, заряженными отрицательно, а кислых белков протоплазмы (отрицательно заряженных) – основными (положительно заряженными) красителями.
С ионообменной адсорбцией связано функционирование биологических структур и мембран, эритроцитов крови и т. д.
При эквивалентной адсорбции происходит эквивалентное поглощение катионов и анионов. Механизм эквивалентной адсорбции можно представить следующим образом. Лучше адсорбируемый ион электролита притягивает свой парный, менее адсорбируемый, ион на поверхность адсорбента. При этом адсорбируемость второго иона возрастает, а первого уменьшается. В результате оба иона поглощаются (адсорбируются) эквивалентно.
