
- •5720100 – Лечебное дело
- •Isbn 978-9943-05-412-7
- •Предисловие
- •Глава I. Учение о растворах
- •§ 1. Роль растворов в жизнедеятельности организмов. Вода как растворитель
- •§ 2. Растворимость газов в жидкостях
- •§ 3. Кессонная болезнь
- •§ 4. Закон и.М. Сеченова
- •§ 5. Осмос и осмотическое давление
- •§ 6. Закон вант-гоффа
- •§ 7. Роль осмоса и осмотического давления в биологических системах. Плазмолиз и гемолиз
- •§ 8. Коллигативные свойства растворов
- •1. Коллигативные свойства ионных растворов
- •2. Понижение давления насыщенного пара растворителя над раствором
- •3. Понижение температуры замерзания растворов
- •4. Повышение температуры кипения растворов
- •5. Взаимосвязь между коллигативными свойствами растворов и осмотическим давлением. Определение осмотического давления криоскопическим методом
- •6. Применение криоскопии и эбуллиоскопии
- •§ 9. Экспериментальная часть
- •§ 10. Обучающе-контролирующие тесты
- •1. Укажите 4 характерных признака явления осмоса:
- •2. Укажите 3 фактора, от которых зависит величина осмотического давления:
- •3. Укажите 3 зависимости, выражающие закон Вант-Гоффа:
- •4. Выберите 3 ответа, формулирующие закон Вант-Гоффа:
- •5. Укажите 4 характеристики явления гемолиза в организме:
- •6. Укажите 4 характеристики явления плазмолиза в организме:
- •7. Выберите 3 формулировки изотонического, гипотонического и гипертонического растворов:
- •8. Укажите 4 фактора, объясняющие суть закона Рауля:
- •9. Выберите 5 правильных ответов, характеризующих законы криоскопии и эбуллиоскопии:
- •10. Выберите 3 ответа, характеризующие изотонический коэффициент:
- •11. Выберите 3 физических свойства разбавленных растворов, зависящие от концентрации растворенных веществ в растворе:
- •12. Назовите 3 условия, при которых происходит явление осмоса:
- •Глава II. Электрохимия
- •§ 1. Электропроводимость растворов электролитов. Кондуктометрическое титрование
- •Удельное сопротивление ряда биологических Жидкостей
- •Предельная молярная электропроводимость ионов в воде (18 °c)
- •§ 2. Потенциалы и электродвижущие силы
- •Некоторые стандартные потенциалы восстановления
- •Стандартные окислительно-восстановительные потенциалы
- •§ 3. Гальванические элементы
- •§ 4. Типы электродов
- •§ 5. Электрохимия в медицине
- •§ 6. Экспериментальная часть
- •Вопрос 1. Почему при бесконечном разведении раствора скорости движения различных ионов не будут зависеть друг от друга?
- •§ 7. Потенциометрия. Потенциометрическое титрование
- •Потенциалы электродов сравнения при различных температурах
- •§ 8. Экспериментальная часть
- •Метод «круглого стола»
- •§ 8. Обучающе-контролирующие тесты
- •1. Укажите 5 ответов, дающих характеристику электропроводимости:
- •16. Выберите 4 ответа, отражающие изменения кривой кондуктометрического титрования сильной кислоты сильным основанием:
- •17. Выберите 4 ответа, отражающие изменения кривой кондуктометрического титрования слабой кислоты сильным основанием:
- •18. Выберите 4 ответа, отражающие изменения кривой при титровании смеси сильной и слабой кислот:
- •19. Укажите 4 ответа с данными об электропроводимости биологических жидкостей при различных заболеваниях:
- •20. Укажите 3 ответа со значениями электропроводности при различном состоянии кислотности в желудке:
- •21. Укажите 5 видов и характеристику потенциалов, возникающих на границах раздела фаз:
- •36. Укажите 4 типа электродов и их правильные характеристики:
- •Коллоидная химия
- •Глава III. Физико-химия поверхностных явлений
- •§ I. Поверхностные явления и их значение в биологии и медицине
- •§ 2. Поверхностная энергия и поверхностное натяжение
- •Поверхностное натяжение некоторых веществ в жидком состоянии на границе с воздухом или паром
- •§ 3. Адсорбция и поверхностное натяжение
- •§ 4. Поверхностно-активные и поверхностно- инактивные вещества
- •§ 5. Изотермы поверхностного натяжения
- •§ 6. Адсорбция на границе раздела жидкость – газ и жидкость – жидкость
- •§ 7. Адсорбция на границе раздела твердое тело – газ и твердое тело – жидкость (раствор)
- •§ 8. Ориентация молекул в поверхностном слое и структура биологических мембран
- •§ 9. Адсорбция из растворов электролитов
- •§ 10. Хроматография, ее сущность и применение в биологии и медицине
- •§ 11. Экспериментальная часть
- •Задания для самостоятельной работы
- •Конкурс «кот в мешке»
- •§ 12. Обучающе-контролирующие тесты
- •7. Укажите 3 ответа, поясняющие уравнение Фрейндлиха:
- •8. Укажите 4 ответа, поясняющие уравнение Ленгмюра:
- •9. Укажите 3 ответа с правильной характеристикой трех частей изотермы адсорбции Ленгмюра:
- •10. Укажите 3 операции, проводимые при определении величины адсорбции на твердой поверхности:
- •11. Выберите 5 характеристик гидрофильности или гидрофобности некоторых видов поверхности:
- •12. Выберите 3 правила, которым подчиняется адсорбция растворенного вещества на твердой поверхности:
- •13. Укажите 5 примеров молекулярной и ионной адсорбции на угле:
- •24. Укажите 3 фактора, от которых зависит адсорбция газов твердым адсорбентом:
- •25. Укажите 3 фактора, от которых зависит адсорбция на границе твердое тело – раствор.
- •Глава IV. Физико-химия дисперсных систем
- •§ 1. Дисперсные системы и их классификация
- •Изменение удельной поверхности при дроблении
- •1 См3 вещества
- •Классификация систем по степени дисперсности
- •Классификация дисперсных систем по агрегатном состоянию дисперсной фазы и дисперсионной среды
- •§ 2. Коллоидное состояние. Методы получения и очистки коллоидных растворов
- •Диспергирование Конденсация
- •§ 3. Молекулярно-кинетические свойства коллоидных систем
- •§ 4. Оптические свойства коллоидных систем
- •§ 5. Классификация коллоидных систем
- •§ 6. Возникновение двойного электрического слоя и его строение
- •§ 7. Строение коллоидных частиц
- •§ 8. Электрокинетическне явления. Электрофорез и использование его в медицине
- •§ 9. Устойчивость коллоидных систем
- •Коагуляция золей As2s3 и Fe(oh)3 электролитами
- •§ 10. Пептизация. Коллоидная защита
- •§ 11. Аэрозоли и их Практическое Значение
- •§ 12. Суспензии, методы их получения и свойства
- •§ 13. Эмульсии, методы их получения и свойства
- •§ 14. Коллоидные поверхностно-активные вещества (пав)
- •§ 15. Экспериментальная часть
- •§ 16. Обучающе-контролирующие тесты
- •1. Укажите 4 характеристики состава и свойств дисперсных систем:
- •2. Укажите 3 типа дисперсных систем согласно классификации по размеру частиц:
- •19. Укажите 4 характеристики поверхностно-активных и поверхностно-инактивных веществ.
- •20. Физическая и коллоидная химия. Под ред. А.П. Беляева. Изд. Группа «гэотар-Медиа», – м.:, 2010. Оглавление
- •Коллоидная химия
- •Сталина Салиховна касымова физическая и коллоидная химия
§ 5. Классификация коллоидных систем
По интенсивности межфазных взаимодействий дисперсные системы разделяются на лиофильные (от греческого lio – растворяю, philia – люблю) и лиофобные (phobia – страх, нелюбовь). В лиофильных системах происходит интенсивное взаимодействие между частицами дисперсной фазы и дисперсионной средой. В случае, когда дисперсионной средой является вода, система называется гидрофильной (растворы мыл, некоторых белков и т.д). В настоящее время доказано, что лиофильные системы – это истинные растворы высокомолекулярных соединений, поэтому вместо термина «лиофильные» системы употребляют термин «растворы ВМС».
Растворы ВМС (белки, полисахариды, каучук, полиамиды) являются гомогенными, термодинамически равновесными системами. Их основной структурной единицей является сильно сольватированная (гидратированная) макромолекула высокомолекулярного соединения. Сольватация является одним из факторов устойчивости их растворов. Взаимодействие между дисперсной фазой и дисперсионной средой приводит к сильному понижению поверхностного натяжения, при этом твердое тело обнаруживает склонность к самопроизвольному диспергированию на частицы коллоидных размеров (10-6 –10-5 см).
Работа образования новых поверхностей раздела фаз совершается за счет кинетической энергии теплового движения, т.е. компенсируется ростом энтропии, обусловленным равномерным распределением частиц в объеме дисперсионной среды и включением их в броуновское движение. Для того чтобы образованная система была термодинамически устойчивой, диспергирование не должно продолжаться до молекулярных размеров.
В лиофобных системах почти полностью отсутствует взаимодействие между частицами дисперсной фазы и дисперсионной средой. В случае, когда дисперсионной средой является вода, система называется гидрофобной (эмульсии масел в воде, многие неметаллы в коллоидном состоянии и др.).
Лиофобные системы самопроизвольно не диспергируются, хотя для них всегда характерна та или иная степень межфазного взаимодействия (лиофилизация). Лиофобные системы термодинамически неустойчивы и характеризуются высокими значениями поверхностного натяжения на межфазной границе. Хотя лиофобные системы термодинамически неустойчивы (> 0), многие из них оказываются кинетически устойчивыми, и заметно не изменяются в течение длительного времени.
Для повышения устойчивости лиофобных систем в них добавляют стабилизаторы, которые, адсорбируясь на поверхности частиц, изменяют их взаимодействие с дисперсионной средой. Стабилизаторами являются неорганические электролиты и органические ПАВ.
§ 6. Возникновение двойного электрического слоя и его строение
При соприкосновении двух фаз между ними сразу же самопроизвольно начинается обмен заряженными частицами. Сильные электролиты в водных растворах практически нацело диссоциированы на ионы, и, как правило, на твердом адсорбенте из раствора адсорбируются в основном ионы одного вида. Кроме того, поверхностные молекулы вещества твердой фазы в растворе могут диссоциировать. При движении жидкой и твердой фаз плоскость скольжения их лежит на некотором расстоянии от твердой фазы (рис. 10, 11). Слой жидкой фазы толщиной в 2–3 молекулы при движении фаз остается на твердой фазе, достаточно прочно с ней связан и сообщает поверхности свой знак заряда. Величина и знак заряда поверхности зависят от природы твердых частиц адсорбента и от природы жидкости, с которой он соприкасается. На поверхности коллоидной частицы золя образуется адсорбционный слой, который состоит из потенциалопределяющих ионов со знаком, противоположным знаку твердой фазы. Под действием электростатических сил притяжения эквивалентное количество противоположно заряженных ионов, находящихся в жидкой фазе – противоионов, стремится расположиться ближе к ионам, адсорбированным на поверхности частиц. Противоионы распределяются в адсорбционном слое в плоскости, параллельной поверхности твердой фазы. Образовавшиеся два слоя ионов (один – на поверхности, другой – в растворе) Г. Гельмгольц назвал двойным электрическим слоем (рис.12, I). В целом эта система ионов нейтральная.
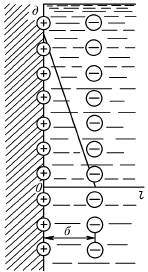
Рис. 10. Строение двойного электрического слоя
по Квинке-Гельмгольцу
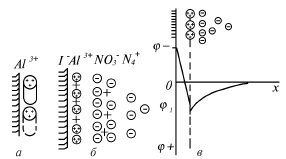
Рис.11. Сверхэквивалентная адсорбция:
а – схема адсорбционного взаимодействия много- зарядных катионов с отрицательно заряженной твердой поверхностью;
б – строение электрического слоя после перезарядки твердой поверхности;
в – изменение – потенциала в присутствии многозарядных ионов противоположного знака;
х – расстояние от твердой поверхности
Затем в работах Гуи (1910 г.) было показано, что противоионы образуют около твердой поверхности коллоидной частицы диффузный слой с постепенно убывающей концентрацией ионов (рис.12, II). По Штерну (1924 г.) одна часть ионов находится на молекулярном расстоянии от поверхности, а другая часть образует диффузный слой (рис.12, III). Следовательно, структура двойного слоя зависит от плотности расположения зарядов на поверхности коллоидных частиц.
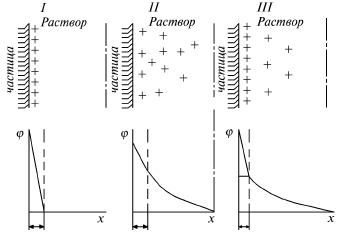
Рис. 12. Строение двойного электрического слоя:
I – по Гельмгольцу; II – по Гуи-Чемпену; III – по Штерну;
х – расстояние от твердой поверхности
Ученые А.Н. Фрумкин, Б.В. Дерягин и др. считают, что неподвижный адсорбционный слой содержит только часть противоионов, которая не может целиком компенсировать заряд твердой поверхности и не все заряды нейтрализуются и возникает некоторый потенциал, который составляет часть от общего потенциала поверхности коллоидной частицы.
Между твердой фазой и жидкостью возникает термодинамический потенциал , который уменьшается по мере удаления от поверхности твердой фазы (см. рис.11), причем в адсорбционном слое падение прямо пропорционально его толщине, а в диффузном слое – потенциал падает по кривой. При движении частицы дисперсной фазы в электрическом поле вместе с адсорбционным слоем противоионов перемещается часть жидкости. Скорость перемещения фаз при наложении электрического поля создает потенциал на границе скольжения, который является причиной всех электрокинетических явлений и называется электрокинетическим потенциалом, или -потенциалом (дзета-потенциалом). Он равен разности потенциалов между подвижной (диффузной) и неподвижной (адсорбционной) частью двойного электрического слоя. Величина электрокинетического потенциала определяется плотностью противоионов в диффузном слое, т.е. толщиной диффузного слоя противоионов. Электрокинетический потенциал является лишь частью термодинамического потенциала и всегда меньше его. Различные факторы влияют на электрокинетический и термодинамический потенциалы по-разному. Например, если ввести в систему индифферентный электролит, то термодинамический потенциал почти не изменится. Если же повысить концентрацию вводимого электролита, то из-за того, что для компенсаций потенциалоопределяющих ионов необходимо эквивалентное количество ионов противоположного знака, толщина диффузного слоя будет уменьшаться, т.е. сжиматься. Это происходит в связи с тем, что часть ионов из диффузного слоя переходит в адсорбционный слой. Чем меньше толщина диффузного слоя, тем больше противоионов этого слоя перейдет в адсорбционный слой и тем меньше будет значение электрокинетического потенциала. Наоборот, разбавление золя способствует увеличению толщины диффузного слоя за счет перехода противоионов из адсорбционного слоя. Отсюда следует, что электрокинетический потенциал очень чувствителен к посторонним электролитам и тем сильнее, чем больше заряд иона, причем влияние природы иона на-потенциал гораздо большее, чем заряда иона.
Коллоидные частицы способны перезаряжаться при введении неиндифферентного электролита. Например, если взять золь AgI, стабилизованный азотнокислым серебром, то потенциалопределяющим ионом в золе будет ион Ag+, а противоионом ион NO3-. Частицы золя будут положительно заряженными. Введем в систему избыток KI. Теперь потенциалопределяющим ионом будет ион I–, а противоионом – ион K+. Частицы золя приобретают в этом случае отрицательный заряд. Находящийся в растворенном состоянии в дисперсионной среде AgNO3, вступит в реакцию с введенным KI, и в системе дополнительно появится некоторое количество отрицательно заряженной дисперсной фазы. Таким образом, происходит перезарядка коллоидных частиц.
