
- •5720100 – Лечебное дело
- •Isbn 978-9943-05-412-7
- •Предисловие
- •Глава I. Учение о растворах
- •§ 1. Роль растворов в жизнедеятельности организмов. Вода как растворитель
- •§ 2. Растворимость газов в жидкостях
- •§ 3. Кессонная болезнь
- •§ 4. Закон и.М. Сеченова
- •§ 5. Осмос и осмотическое давление
- •§ 6. Закон вант-гоффа
- •§ 7. Роль осмоса и осмотического давления в биологических системах. Плазмолиз и гемолиз
- •§ 8. Коллигативные свойства растворов
- •1. Коллигативные свойства ионных растворов
- •2. Понижение давления насыщенного пара растворителя над раствором
- •3. Понижение температуры замерзания растворов
- •4. Повышение температуры кипения растворов
- •5. Взаимосвязь между коллигативными свойствами растворов и осмотическим давлением. Определение осмотического давления криоскопическим методом
- •6. Применение криоскопии и эбуллиоскопии
- •§ 9. Экспериментальная часть
- •§ 10. Обучающе-контролирующие тесты
- •1. Укажите 4 характерных признака явления осмоса:
- •2. Укажите 3 фактора, от которых зависит величина осмотического давления:
- •3. Укажите 3 зависимости, выражающие закон Вант-Гоффа:
- •4. Выберите 3 ответа, формулирующие закон Вант-Гоффа:
- •5. Укажите 4 характеристики явления гемолиза в организме:
- •6. Укажите 4 характеристики явления плазмолиза в организме:
- •7. Выберите 3 формулировки изотонического, гипотонического и гипертонического растворов:
- •8. Укажите 4 фактора, объясняющие суть закона Рауля:
- •9. Выберите 5 правильных ответов, характеризующих законы криоскопии и эбуллиоскопии:
- •10. Выберите 3 ответа, характеризующие изотонический коэффициент:
- •11. Выберите 3 физических свойства разбавленных растворов, зависящие от концентрации растворенных веществ в растворе:
- •12. Назовите 3 условия, при которых происходит явление осмоса:
- •Глава II. Электрохимия
- •§ 1. Электропроводимость растворов электролитов. Кондуктометрическое титрование
- •Удельное сопротивление ряда биологических Жидкостей
- •Предельная молярная электропроводимость ионов в воде (18 °c)
- •§ 2. Потенциалы и электродвижущие силы
- •Некоторые стандартные потенциалы восстановления
- •Стандартные окислительно-восстановительные потенциалы
- •§ 3. Гальванические элементы
- •§ 4. Типы электродов
- •§ 5. Электрохимия в медицине
- •§ 6. Экспериментальная часть
- •Вопрос 1. Почему при бесконечном разведении раствора скорости движения различных ионов не будут зависеть друг от друга?
- •§ 7. Потенциометрия. Потенциометрическое титрование
- •Потенциалы электродов сравнения при различных температурах
- •§ 8. Экспериментальная часть
- •Метод «круглого стола»
- •§ 8. Обучающе-контролирующие тесты
- •1. Укажите 5 ответов, дающих характеристику электропроводимости:
- •16. Выберите 4 ответа, отражающие изменения кривой кондуктометрического титрования сильной кислоты сильным основанием:
- •17. Выберите 4 ответа, отражающие изменения кривой кондуктометрического титрования слабой кислоты сильным основанием:
- •18. Выберите 4 ответа, отражающие изменения кривой при титровании смеси сильной и слабой кислот:
- •19. Укажите 4 ответа с данными об электропроводимости биологических жидкостей при различных заболеваниях:
- •20. Укажите 3 ответа со значениями электропроводности при различном состоянии кислотности в желудке:
- •21. Укажите 5 видов и характеристику потенциалов, возникающих на границах раздела фаз:
- •36. Укажите 4 типа электродов и их правильные характеристики:
- •Коллоидная химия
- •Глава III. Физико-химия поверхностных явлений
- •§ I. Поверхностные явления и их значение в биологии и медицине
- •§ 2. Поверхностная энергия и поверхностное натяжение
- •Поверхностное натяжение некоторых веществ в жидком состоянии на границе с воздухом или паром
- •§ 3. Адсорбция и поверхностное натяжение
- •§ 4. Поверхностно-активные и поверхностно- инактивные вещества
- •§ 5. Изотермы поверхностного натяжения
- •§ 6. Адсорбция на границе раздела жидкость – газ и жидкость – жидкость
- •§ 7. Адсорбция на границе раздела твердое тело – газ и твердое тело – жидкость (раствор)
- •§ 8. Ориентация молекул в поверхностном слое и структура биологических мембран
- •§ 9. Адсорбция из растворов электролитов
- •§ 10. Хроматография, ее сущность и применение в биологии и медицине
- •§ 11. Экспериментальная часть
- •Задания для самостоятельной работы
- •Конкурс «кот в мешке»
- •§ 12. Обучающе-контролирующие тесты
- •7. Укажите 3 ответа, поясняющие уравнение Фрейндлиха:
- •8. Укажите 4 ответа, поясняющие уравнение Ленгмюра:
- •9. Укажите 3 ответа с правильной характеристикой трех частей изотермы адсорбции Ленгмюра:
- •10. Укажите 3 операции, проводимые при определении величины адсорбции на твердой поверхности:
- •11. Выберите 5 характеристик гидрофильности или гидрофобности некоторых видов поверхности:
- •12. Выберите 3 правила, которым подчиняется адсорбция растворенного вещества на твердой поверхности:
- •13. Укажите 5 примеров молекулярной и ионной адсорбции на угле:
- •24. Укажите 3 фактора, от которых зависит адсорбция газов твердым адсорбентом:
- •25. Укажите 3 фактора, от которых зависит адсорбция на границе твердое тело – раствор.
- •Глава IV. Физико-химия дисперсных систем
- •§ 1. Дисперсные системы и их классификация
- •Изменение удельной поверхности при дроблении
- •1 См3 вещества
- •Классификация систем по степени дисперсности
- •Классификация дисперсных систем по агрегатном состоянию дисперсной фазы и дисперсионной среды
- •§ 2. Коллоидное состояние. Методы получения и очистки коллоидных растворов
- •Диспергирование Конденсация
- •§ 3. Молекулярно-кинетические свойства коллоидных систем
- •§ 4. Оптические свойства коллоидных систем
- •§ 5. Классификация коллоидных систем
- •§ 6. Возникновение двойного электрического слоя и его строение
- •§ 7. Строение коллоидных частиц
- •§ 8. Электрокинетическне явления. Электрофорез и использование его в медицине
- •§ 9. Устойчивость коллоидных систем
- •Коагуляция золей As2s3 и Fe(oh)3 электролитами
- •§ 10. Пептизация. Коллоидная защита
- •§ 11. Аэрозоли и их Практическое Значение
- •§ 12. Суспензии, методы их получения и свойства
- •§ 13. Эмульсии, методы их получения и свойства
- •§ 14. Коллоидные поверхностно-активные вещества (пав)
- •§ 15. Экспериментальная часть
- •§ 16. Обучающе-контролирующие тесты
- •1. Укажите 4 характеристики состава и свойств дисперсных систем:
- •2. Укажите 3 типа дисперсных систем согласно классификации по размеру частиц:
- •19. Укажите 4 характеристики поверхностно-активных и поверхностно-инактивных веществ.
- •20. Физическая и коллоидная химия. Под ред. А.П. Беляева. Изд. Группа «гэотар-Медиа», – м.:, 2010. Оглавление
- •Коллоидная химия
- •Сталина Салиховна касымова физическая и коллоидная химия
§ 6. Закон вант-гоффа
Между осмотическим давлением разбавленных растворов не электролитов (т.е. растворов, не проводящих электрический ток) и газовым давлением существует количественная аналогия – к осмотическому давлению приложимы все законы газового давления. Эта аналогия выражается законом Вант-Гоффа (1887 г.):
«Осмотическое давление раствора численно равно тому давлению, которое производило бы растворенное вещество, если бы оно находилось при данной температуре в газообразном состоянии и занимало объем, равный объему раствора».
Зависимость осмотического давления от объема раствора, количества растворенного вещества и температуры выражается уравнением, аналогичным уравнению Клапейрона-Менделеева для газов:
PV = nRT, (1)
где Р – осмотическое давление раствора;
V – объем раствора;
n – число молей растворенного вещества;
R – газовая постоянная;
T – абсолютная температура.
Переписываем уравнение (1) следующим образом:
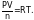
При замене в этом уравнении n/V, т.е. числа молей растворенного вещества в единице объема, на С, получим выражение:
P = CRT, (2)
где С – молярная концентрация. Это уравнение осмотического давления Р, т. е. осмотическое давление прямо пропорционально концентрации С и абсолютной температуре Т, а константа R должна иметь то же значение, что и для газов.
Концентрация растворенного вещества С может быть выражена также через массу растворенного вещества m и его молекулярную массу М:
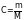 .
.
Тогда, подставив это выражение в формулу (2), получим формулу, удобную для вычисления молекулярной массы растворенного вещества:
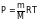 .
(3)
.
(3)
Закон Вант-Гоффа наиболее точно описывает разбавленные растворы при некоторой бесконечно малой концентрации растворенного вещества, исключающей взаимодействие между его частицами. Состояние и поведение растворов в этом случае можно уподобить идеальному газу, поэтому такие растворы называются идеальными.
Осмотическое давление зависит не от природы растворенного вещества и растворителя, а от числа частиц, находящихся в единице объема раствора (тезис, подтверждающий физическую теорию растворов). Например, 1 моль мочевины (60 г) и 1 моль глицерина (92 г), будучи растворены в равных количествах одного и того же растворителя, создают одинаковое давление. Отсюда следует, что эквимолекулярные растворы (растворы одинаковой молярной концентрации) имеют одно и то же осмотическое давление. Такие растворы называются изотоническими, т.е. это растворы с одинаковым осмотическим давлением независимо от состава растворенных веществ, обусловливающих это давление. Жидкость крови, в которой взвешены красные кровяные тельца, – плазма крови является изотонической жидкостью, находящейся в красных кровяных тельцах и других клетках организма.
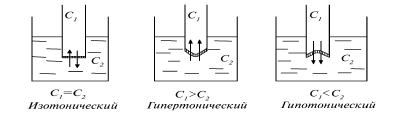
Когда в организм в терапевтических целях необходимо ввести водные растворы, эти растворы должны иметь осмотическое давление, равное осмотическому давлению плазмы крови, т. е. должны быть изотоническими с ней. Осмотическое давление жидкостей организма человека равно давлению 0,86 % (0,015 моль/л) раствора NaCl (физиологический раствор). Сейчас создаются более совершенные физиологические растворы, содержащие смесь солей (KCl, CaCl2, MgCl2, MgSO4 и др.). Такой состав сходен с составом морской воды. Клетки организмов хладнокровных животных являются изотоническими с более разбавленными растворами NaCl (у лягушек 0,6 % раствором). Жидкости организмов низших морских животных имеют осмотическое давление, почти равное осмотическому давлению морской воды.
Следовательно, растворы с осмотическим давлением, равным осмотическому давлению раствора, взятого за стандарт, называются изотоническими (изос – по гречески равный, tonos – напряжение, давление). Растворы с осмотическим давлением более высоким, чем в стандарте, называются гипертоническими (гипер – сверх, над), с меньшим давлением – гипотоническими (гипо – ниже, под).
В организм человека и животных можно вводить в больших количествах только изотонические растворы. Такие растворы вводят иногда больным по несколько литров в сутки, например, после тяжелых операций для возмещения потерь жидкости с кровью.
В клинической практике применяются и гипертонические растворы. Небольшие количества их вводят внутривенно, например, при глаукоме, характеризующейся повышенным внутриглазным давлением, чтобы «оттянуть» избыточное количество влаги из передней камеры глаза.
В хирургии широко применяют гипертонические повязки, представляющие собой марлевые полоски, смоченные в гипертонических растворах NaCl и введенные в гнойные раны; согласно законам осмоса ток раневой жидкости направляется по марле наружу, что способствует постоянному очищению раны от гноя, микроорганизмов, продуктов распада и пр.
Используемые в качестве слабительных средств плохо всасывающиеся в желудочно-кишечном тракте соли MgSO4 и Na2SO4 применяются также в виде гипертонических растворов. Это вызывает переход больших количеств воды из слизистой оболочки в просвет кишечника, что способствует послабляющему действию сульфатов.
