
- •5720100 – Лечебное дело
- •Isbn 978-9943-05-412-7
- •Предисловие
- •Глава I. Учение о растворах
- •§ 1. Роль растворов в жизнедеятельности организмов. Вода как растворитель
- •§ 2. Растворимость газов в жидкостях
- •§ 3. Кессонная болезнь
- •§ 4. Закон и.М. Сеченова
- •§ 5. Осмос и осмотическое давление
- •§ 6. Закон вант-гоффа
- •§ 7. Роль осмоса и осмотического давления в биологических системах. Плазмолиз и гемолиз
- •§ 8. Коллигативные свойства растворов
- •1. Коллигативные свойства ионных растворов
- •2. Понижение давления насыщенного пара растворителя над раствором
- •3. Понижение температуры замерзания растворов
- •4. Повышение температуры кипения растворов
- •5. Взаимосвязь между коллигативными свойствами растворов и осмотическим давлением. Определение осмотического давления криоскопическим методом
- •6. Применение криоскопии и эбуллиоскопии
- •§ 9. Экспериментальная часть
- •§ 10. Обучающе-контролирующие тесты
- •1. Укажите 4 характерных признака явления осмоса:
- •2. Укажите 3 фактора, от которых зависит величина осмотического давления:
- •3. Укажите 3 зависимости, выражающие закон Вант-Гоффа:
- •4. Выберите 3 ответа, формулирующие закон Вант-Гоффа:
- •5. Укажите 4 характеристики явления гемолиза в организме:
- •6. Укажите 4 характеристики явления плазмолиза в организме:
- •7. Выберите 3 формулировки изотонического, гипотонического и гипертонического растворов:
- •8. Укажите 4 фактора, объясняющие суть закона Рауля:
- •9. Выберите 5 правильных ответов, характеризующих законы криоскопии и эбуллиоскопии:
- •10. Выберите 3 ответа, характеризующие изотонический коэффициент:
- •11. Выберите 3 физических свойства разбавленных растворов, зависящие от концентрации растворенных веществ в растворе:
- •12. Назовите 3 условия, при которых происходит явление осмоса:
- •Глава II. Электрохимия
- •§ 1. Электропроводимость растворов электролитов. Кондуктометрическое титрование
- •Удельное сопротивление ряда биологических Жидкостей
- •Предельная молярная электропроводимость ионов в воде (18 °c)
- •§ 2. Потенциалы и электродвижущие силы
- •Некоторые стандартные потенциалы восстановления
- •Стандартные окислительно-восстановительные потенциалы
- •§ 3. Гальванические элементы
- •§ 4. Типы электродов
- •§ 5. Электрохимия в медицине
- •§ 6. Экспериментальная часть
- •Вопрос 1. Почему при бесконечном разведении раствора скорости движения различных ионов не будут зависеть друг от друга?
- •§ 7. Потенциометрия. Потенциометрическое титрование
- •Потенциалы электродов сравнения при различных температурах
- •§ 8. Экспериментальная часть
- •Метод «круглого стола»
- •§ 8. Обучающе-контролирующие тесты
- •1. Укажите 5 ответов, дающих характеристику электропроводимости:
- •16. Выберите 4 ответа, отражающие изменения кривой кондуктометрического титрования сильной кислоты сильным основанием:
- •17. Выберите 4 ответа, отражающие изменения кривой кондуктометрического титрования слабой кислоты сильным основанием:
- •18. Выберите 4 ответа, отражающие изменения кривой при титровании смеси сильной и слабой кислот:
- •19. Укажите 4 ответа с данными об электропроводимости биологических жидкостей при различных заболеваниях:
- •20. Укажите 3 ответа со значениями электропроводности при различном состоянии кислотности в желудке:
- •21. Укажите 5 видов и характеристику потенциалов, возникающих на границах раздела фаз:
- •36. Укажите 4 типа электродов и их правильные характеристики:
- •Коллоидная химия
- •Глава III. Физико-химия поверхностных явлений
- •§ I. Поверхностные явления и их значение в биологии и медицине
- •§ 2. Поверхностная энергия и поверхностное натяжение
- •Поверхностное натяжение некоторых веществ в жидком состоянии на границе с воздухом или паром
- •§ 3. Адсорбция и поверхностное натяжение
- •§ 4. Поверхностно-активные и поверхностно- инактивные вещества
- •§ 5. Изотермы поверхностного натяжения
- •§ 6. Адсорбция на границе раздела жидкость – газ и жидкость – жидкость
- •§ 7. Адсорбция на границе раздела твердое тело – газ и твердое тело – жидкость (раствор)
- •§ 8. Ориентация молекул в поверхностном слое и структура биологических мембран
- •§ 9. Адсорбция из растворов электролитов
- •§ 10. Хроматография, ее сущность и применение в биологии и медицине
- •§ 11. Экспериментальная часть
- •Задания для самостоятельной работы
- •Конкурс «кот в мешке»
- •§ 12. Обучающе-контролирующие тесты
- •7. Укажите 3 ответа, поясняющие уравнение Фрейндлиха:
- •8. Укажите 4 ответа, поясняющие уравнение Ленгмюра:
- •9. Укажите 3 ответа с правильной характеристикой трех частей изотермы адсорбции Ленгмюра:
- •10. Укажите 3 операции, проводимые при определении величины адсорбции на твердой поверхности:
- •11. Выберите 5 характеристик гидрофильности или гидрофобности некоторых видов поверхности:
- •12. Выберите 3 правила, которым подчиняется адсорбция растворенного вещества на твердой поверхности:
- •13. Укажите 5 примеров молекулярной и ионной адсорбции на угле:
- •24. Укажите 3 фактора, от которых зависит адсорбция газов твердым адсорбентом:
- •25. Укажите 3 фактора, от которых зависит адсорбция на границе твердое тело – раствор.
- •Глава IV. Физико-химия дисперсных систем
- •§ 1. Дисперсные системы и их классификация
- •Изменение удельной поверхности при дроблении
- •1 См3 вещества
- •Классификация систем по степени дисперсности
- •Классификация дисперсных систем по агрегатном состоянию дисперсной фазы и дисперсионной среды
- •§ 2. Коллоидное состояние. Методы получения и очистки коллоидных растворов
- •Диспергирование Конденсация
- •§ 3. Молекулярно-кинетические свойства коллоидных систем
- •§ 4. Оптические свойства коллоидных систем
- •§ 5. Классификация коллоидных систем
- •§ 6. Возникновение двойного электрического слоя и его строение
- •§ 7. Строение коллоидных частиц
- •§ 8. Электрокинетическне явления. Электрофорез и использование его в медицине
- •§ 9. Устойчивость коллоидных систем
- •Коагуляция золей As2s3 и Fe(oh)3 электролитами
- •§ 10. Пептизация. Коллоидная защита
- •§ 11. Аэрозоли и их Практическое Значение
- •§ 12. Суспензии, методы их получения и свойства
- •§ 13. Эмульсии, методы их получения и свойства
- •§ 14. Коллоидные поверхностно-активные вещества (пав)
- •§ 15. Экспериментальная часть
- •§ 16. Обучающе-контролирующие тесты
- •1. Укажите 4 характеристики состава и свойств дисперсных систем:
- •2. Укажите 3 типа дисперсных систем согласно классификации по размеру частиц:
- •19. Укажите 4 характеристики поверхностно-активных и поверхностно-инактивных веществ.
- •20. Физическая и коллоидная химия. Под ред. А.П. Беляева. Изд. Группа «гэотар-Медиа», – м.:, 2010. Оглавление
- •Коллоидная химия
- •Сталина Салиховна касымова физическая и коллоидная химия
Глава II. Электрохимия
§ 1. Электропроводимость растворов электролитов. Кондуктометрическое титрование
В первой половине XIX века бурно развились две области естественных наук – химия и учение об электричестве. К этому же времени относится и возникновение электрохимии. Развитие электрохимии связано с именами А. Ампера , который открыл законы взаимодействия электрических токов (1820 г.); Г. Ома, который доказал пропорциональность тока и напряжения (1827 г.), а позже и электролиза (1833 г.); М. Фарадея, который открыл электромагнитную индукцию (1831 г.); Дж. Джоуль, который обнаружил тепловыделение при прохождении тока (1843 г.); Г. Дэви, проводившего работы по электролизу водных растворов и расплавов солей (1807 г.) и других.
В настоящее время электрохимия – наука, устанавливающая количественные закономерности между химическими, поверхностными и электрическими свойствами различных систем, т.е. электрохимия – это наука о взаимном превращении электрической и химической энергий. Электрохимия – область химии, изучающая процессы, которые либо сопровождаются возникновением электрического тока, либо вызваны электрическим током. Преобразование химической энергии реакции в электрическую осуществляется в гальванических элементах. Химические же превращения за счет внешней электрической энергии происходят в электролитических ваннах или электролизерах. Электрохимия тесно связана со многими разделами науки. Электрохимические представления начали использовать не только в промышленности, но и для объяснения ряда важнейших биологических процессов, т.к. различные электрохимические явления играют исключительную роль в важнейших биологических процессах. Например, в транспорте ионов через клеточные мембраны, в превращении энергии на молекулярном уровне, в распространении нервных импульсов, в восприятии зрительного изображения и многих других. Биоэлектрохимия – один из самых молодых, но один из важнейших разделов электрохимии. Высокая точность и быстрота измерений привели к широкому использованию электрохимических методов количественного и качественного химического анализа, который можно использовать для периодического или непрерывного определения содержания ряда веществ в газообразных или жидких средах. Например, определение содержания оксидов углерода в атмосфере, кислорода в биологических жидкостях и т. д.
В электрохимии, в отличие от электростатики, учитывают не только электростатические, но и химические свойства свободных зарядов. Электрический ток в проводнике – это направленное перемещение свободных зарядов под влиянием приложенного электрического поля. В зависимости от вида зарядов проводимость может быть электронной и ионной.
Для того чтобы произошло взаимодействие между электрическим током и веществом, электричество должно проходить через среду, в которой происходит процесс, то есть среда должна проводить ток. Самыми лучшими проводниками электрического тока являются металлы, в которых электрический ток создается исключительно движением «свободных» электронов. Они являются проводниками первого рода. Кроме того, к проводникам первого рода относятся металлические сплавы, уголь, графит и другие вещества. Электрический ток в проводниках этого рода вызывает лишь нагревание тела без каких-либо химических превращений. Вещества, которые при прохождении через них электрического тока претерпевают химические превращения, называются проводниками второго рода. К ним относятся электролиты – водные растворы солей, кислот, оснований; расплавленные оксиды металлов, основания и соли. В электролитах проводниками электрического тока служат противоположно заряженные ионы.
Электрохимические методы исследования, применяемые в биологии и медицине, можно объединить в две большие группы. К первой группе относятся методы, требующие внешнего источника тока. Они изучают явления и процессы, протекающие в тканях и жидкостях организма при прохождении через них электрического тока. К ним относятся кондуктометрия, основанная на неспецифических электродных процессах и вольтамперометрия (полярография), позволяющая определять многие вещества на основе специфических электродных реакций окисления-восстановления, протекающих под действием внешнего потенциала.
Ко второй группе относятся методы без использования внешнего источника тока. Они основаны на измерении ЭДС гальванических элементов – составляемых электрохимических систем, в которых за счет изменения внутренней энергии генерируется электрический ток. В гальваническом элементе самопроизвольно происходит окислительно-восстановительная (редокс-) реакция и вырабатывается электрический ток (работа производится системой).
В кондуктометрических исследованиях основной экспериментальной величиной, получаемой при прямых измерениях, является сопротивление раствора электролита. Способность раствора проводить электричество характеризуется сопротивлением. Сопротивление проводника R пропорционально его длине и обратно пропорционально поперечному сечению S:
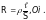 (1)
(1)
Коэффициент пропорциональности, равный сопротивлению проводника при расстоянии между двумя параллельными электродами = 1 cм и площади поперечного сечения проводника S=1 см2, называется удельным сопротивлением (Ом · см).
В медицине обычно измеряют удельное сопротивление биологических жидкостей (табл.1). Из таблицы видно, что, например, для нормальной плазмы крови человека удельное сопротивление = 0,65–0,74 Ом · м, для желудочного сока = 0,9 Ом · м.
Однако, при рассмотрении различных закономерностей поведения проводников II рода чаще пользуются величиной, обратной сопротивлению и называемой электропроводимостью I, то есть
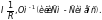 (2)
(2)
Таблица 1
