
- •5720100 – Лечебное дело
- •Isbn 978-9943-05-412-7
- •Предисловие
- •Глава I. Учение о растворах
- •§ 1. Роль растворов в жизнедеятельности организмов. Вода как растворитель
- •§ 2. Растворимость газов в жидкостях
- •§ 3. Кессонная болезнь
- •§ 4. Закон и.М. Сеченова
- •§ 5. Осмос и осмотическое давление
- •§ 6. Закон вант-гоффа
- •§ 7. Роль осмоса и осмотического давления в биологических системах. Плазмолиз и гемолиз
- •§ 8. Коллигативные свойства растворов
- •1. Коллигативные свойства ионных растворов
- •2. Понижение давления насыщенного пара растворителя над раствором
- •3. Понижение температуры замерзания растворов
- •4. Повышение температуры кипения растворов
- •5. Взаимосвязь между коллигативными свойствами растворов и осмотическим давлением. Определение осмотического давления криоскопическим методом
- •6. Применение криоскопии и эбуллиоскопии
- •§ 9. Экспериментальная часть
- •§ 10. Обучающе-контролирующие тесты
- •1. Укажите 4 характерных признака явления осмоса:
- •2. Укажите 3 фактора, от которых зависит величина осмотического давления:
- •3. Укажите 3 зависимости, выражающие закон Вант-Гоффа:
- •4. Выберите 3 ответа, формулирующие закон Вант-Гоффа:
- •5. Укажите 4 характеристики явления гемолиза в организме:
- •6. Укажите 4 характеристики явления плазмолиза в организме:
- •7. Выберите 3 формулировки изотонического, гипотонического и гипертонического растворов:
- •8. Укажите 4 фактора, объясняющие суть закона Рауля:
- •9. Выберите 5 правильных ответов, характеризующих законы криоскопии и эбуллиоскопии:
- •10. Выберите 3 ответа, характеризующие изотонический коэффициент:
- •11. Выберите 3 физических свойства разбавленных растворов, зависящие от концентрации растворенных веществ в растворе:
- •12. Назовите 3 условия, при которых происходит явление осмоса:
- •Глава II. Электрохимия
- •§ 1. Электропроводимость растворов электролитов. Кондуктометрическое титрование
- •Удельное сопротивление ряда биологических Жидкостей
- •Предельная молярная электропроводимость ионов в воде (18 °c)
- •§ 2. Потенциалы и электродвижущие силы
- •Некоторые стандартные потенциалы восстановления
- •Стандартные окислительно-восстановительные потенциалы
- •§ 3. Гальванические элементы
- •§ 4. Типы электродов
- •§ 5. Электрохимия в медицине
- •§ 6. Экспериментальная часть
- •Вопрос 1. Почему при бесконечном разведении раствора скорости движения различных ионов не будут зависеть друг от друга?
- •§ 7. Потенциометрия. Потенциометрическое титрование
- •Потенциалы электродов сравнения при различных температурах
- •§ 8. Экспериментальная часть
- •Метод «круглого стола»
- •§ 8. Обучающе-контролирующие тесты
- •1. Укажите 5 ответов, дающих характеристику электропроводимости:
- •16. Выберите 4 ответа, отражающие изменения кривой кондуктометрического титрования сильной кислоты сильным основанием:
- •17. Выберите 4 ответа, отражающие изменения кривой кондуктометрического титрования слабой кислоты сильным основанием:
- •18. Выберите 4 ответа, отражающие изменения кривой при титровании смеси сильной и слабой кислот:
- •19. Укажите 4 ответа с данными об электропроводимости биологических жидкостей при различных заболеваниях:
- •20. Укажите 3 ответа со значениями электропроводности при различном состоянии кислотности в желудке:
- •21. Укажите 5 видов и характеристику потенциалов, возникающих на границах раздела фаз:
- •36. Укажите 4 типа электродов и их правильные характеристики:
- •Коллоидная химия
- •Глава III. Физико-химия поверхностных явлений
- •§ I. Поверхностные явления и их значение в биологии и медицине
- •§ 2. Поверхностная энергия и поверхностное натяжение
- •Поверхностное натяжение некоторых веществ в жидком состоянии на границе с воздухом или паром
- •§ 3. Адсорбция и поверхностное натяжение
- •§ 4. Поверхностно-активные и поверхностно- инактивные вещества
- •§ 5. Изотермы поверхностного натяжения
- •§ 6. Адсорбция на границе раздела жидкость – газ и жидкость – жидкость
- •§ 7. Адсорбция на границе раздела твердое тело – газ и твердое тело – жидкость (раствор)
- •§ 8. Ориентация молекул в поверхностном слое и структура биологических мембран
- •§ 9. Адсорбция из растворов электролитов
- •§ 10. Хроматография, ее сущность и применение в биологии и медицине
- •§ 11. Экспериментальная часть
- •Задания для самостоятельной работы
- •Конкурс «кот в мешке»
- •§ 12. Обучающе-контролирующие тесты
- •7. Укажите 3 ответа, поясняющие уравнение Фрейндлиха:
- •8. Укажите 4 ответа, поясняющие уравнение Ленгмюра:
- •9. Укажите 3 ответа с правильной характеристикой трех частей изотермы адсорбции Ленгмюра:
- •10. Укажите 3 операции, проводимые при определении величины адсорбции на твердой поверхности:
- •11. Выберите 5 характеристик гидрофильности или гидрофобности некоторых видов поверхности:
- •12. Выберите 3 правила, которым подчиняется адсорбция растворенного вещества на твердой поверхности:
- •13. Укажите 5 примеров молекулярной и ионной адсорбции на угле:
- •24. Укажите 3 фактора, от которых зависит адсорбция газов твердым адсорбентом:
- •25. Укажите 3 фактора, от которых зависит адсорбция на границе твердое тело – раствор.
- •Глава IV. Физико-химия дисперсных систем
- •§ 1. Дисперсные системы и их классификация
- •Изменение удельной поверхности при дроблении
- •1 См3 вещества
- •Классификация систем по степени дисперсности
- •Классификация дисперсных систем по агрегатном состоянию дисперсной фазы и дисперсионной среды
- •§ 2. Коллоидное состояние. Методы получения и очистки коллоидных растворов
- •Диспергирование Конденсация
- •§ 3. Молекулярно-кинетические свойства коллоидных систем
- •§ 4. Оптические свойства коллоидных систем
- •§ 5. Классификация коллоидных систем
- •§ 6. Возникновение двойного электрического слоя и его строение
- •§ 7. Строение коллоидных частиц
- •§ 8. Электрокинетическне явления. Электрофорез и использование его в медицине
- •§ 9. Устойчивость коллоидных систем
- •Коагуляция золей As2s3 и Fe(oh)3 электролитами
- •§ 10. Пептизация. Коллоидная защита
- •§ 11. Аэрозоли и их Практическое Значение
- •§ 12. Суспензии, методы их получения и свойства
- •§ 13. Эмульсии, методы их получения и свойства
- •§ 14. Коллоидные поверхностно-активные вещества (пав)
- •§ 15. Экспериментальная часть
- •§ 16. Обучающе-контролирующие тесты
- •1. Укажите 4 характеристики состава и свойств дисперсных систем:
- •2. Укажите 3 типа дисперсных систем согласно классификации по размеру частиц:
- •19. Укажите 4 характеристики поверхностно-активных и поверхностно-инактивных веществ.
- •20. Физическая и коллоидная химия. Под ред. А.П. Беляева. Изд. Группа «гэотар-Медиа», – м.:, 2010. Оглавление
- •Коллоидная химия
- •Сталина Салиховна касымова физическая и коллоидная химия
§ 8. Коллигативные свойства растворов
1. Коллигативные свойства ионных растворов
Присутствие в растворе молекулярных веществ сказывается на некоторых его физических свойствах. Введение в раствор ионных веществ также влияет на температуры замерзания и кипения раствора и вызывает появление осмотического давления, однако в данном случае имеется некоторая особенность. Следует учесть, что при растворении 1 моля NaCl в растворе появляются 2 моля ионов, а ионы каждого типа оказывают независимое действие на раствор, обусловливая его коллигативные свойства, подобно молекулам растворенных молекулярных веществ.
Поэтому следует ожидать, что в разбавленных водных растворах NaCl и MgCl2 коллигативные свойства, вычисленные по закону Вант-Гоффа, должны проявляться соответственно вдвое и втрое сильнее, чем, например, у раствора сахара в воде, так как число частиц в растворе в 2 и 3 раза больше, чем если бы NaCl или MgCl2 находились в нем в виде молекул NaCl или MgCl2. Таким образом, особенности водных растворов электролитов, противоречащие с первого взгляда законам Вант-Гоффа и Рауля, были объяснены на основе этих же законов.
Поэтому Вант-Гофф исправил уравнение P = СRT, введя в него коэффициент «i» (изотонический коэффициент), который зависит от типа молекулы электролита:
Росм = iСRT.
Изотонический коэффициент Вант-Гоффа обладает коллигативными свойствами (от лат. colligative – собирать), так как является суммой всех частиц в растворе.
Изотонический коэффициент находится следующим образом.
Для 2-х ионного электролита:
NaCl = Na+ + Cl–
1–
i = 1 – + + = 1 +
Для 3-х ионного электролита:
CaCl2 = Ca2+ + 2Cl–
1– 2
i = 1 – + + 2 = 1+ 2
Для 4-х ионного электролита:
AlCl3 = Al3+ + 3Cl–
1–
i = 1–+ + 3 = 1 + 3
Для любого электролита:
i = 1 + m.
Отсюда = (i–1)/ m.
Некоторые физические свойства разбавленных растворов (давление паров над раствором, температура кипения и замерзания) зависят от концентрации растворенных веществ в растворе. Поэтому коллигативными свойствами являются: понижение давления паров, повышение температуры кипения, понижение температуры замерзания и осмотическое давление раствора.
2. Понижение давления насыщенного пара растворителя над раствором
Давление насыщенного пара жидкости при данной температуре является постоянной величиной. Опыт показывает, что давление насыщенного пара над жидкостью при постоянной температуре понижается, если в ней растворить некоторое количество другого вещества. Это объясняется действием ван-дер-ваальсовых сил между молекулами растворителя и растворенного вещества. Растворяя небольшое количество какого-либо вещества в растворителе, мы понижаем концентрацию последнего в единице объема и тем самым уменьшаем число молекул растворителя, покидающих поверхность раствора в единицу времени.
В результате – давление пара над раствором всегда меньше, чем над чистым растворителем. При этом понижение давления пара тем больше, чем больше концентрация растворенного вещества в растворе.
Если в некотором растворителе растворяют нелетучее вещество, равновесное давление паров растворителя при этом понижается. Например, растворы сахара или NaCl в воде имеют более низкое давление паров, чем чистая вода. Экспериментально установлено, что понижение давления паров зависит от концентрации частиц растворенного вещества.
Например, добавление 1 моля какого-либо неэлектролита, скажем глюкозы, или 0,5 моля NaCl к определенному количеству воды приводит к практически одинаковому понижению давления паров. В обоих растворах содержится по 1,0 молю растворенных частиц, потому что при растворении 0,5 моля NaCl образуется 0,5 моля ионов Na+ и 0,5 моля ионов Cl–. Количественное описание давления паров растворов, содержащих нелетучие растворенные вещества, дает закон Рауля.
Обобщая результаты экспериментальных данных, французский физик Рауль (1887 г.) установил, что давление насыщенного пара растворителя над раствором равно его давлению над чистым растворителем, умноженному на молярную долю растворителя в растворе, т.е.
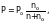
где Р0 – давление насыщенного пара над чистым растворителем;
Р – давление насыщенного пара над раствором;
n0 – число молей растворителя;
n – число молей растворенного вещества.
На практике чаще всего применяют другую форму закона Рауля:
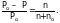 (1)
(1)
Выражение (P0–P)/P0 называется относительным понижением давления пара над раствором. Закон Рауля формулируется следующим образом:
«Относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества в растворе».
Для сильно разбавленных растворов n по сравнению с nо очень мало, им можно пренебречь, и формула (1) примет вид:
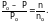 (2)
(2)
Относительное понижение давления пара для данного раствора не зависит от природы растворенного вещества и растворителя, а также от температуры. Оно зависит от концентрации раствора.
На основании закона Рауля можно вычислить молекулярные массы растворенных веществ.
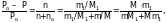
откуда,
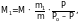 (3)
(3)
где Ро – давление насыщенного пара над чистым растворителем;
Р – давление насыщенного пара над раствором, содержащим m1 граммов растворенного вещества; М1 – молекулярная масса растворенного вещества, г;
М – молекулярная масса растворителя, г; m – масса растворителя, г.
