
- •5720100 – Лечебное дело
- •Isbn 978-9943-05-412-7
- •Предисловие
- •Глава I. Учение о растворах
- •§ 1. Роль растворов в жизнедеятельности организмов. Вода как растворитель
- •§ 2. Растворимость газов в жидкостях
- •§ 3. Кессонная болезнь
- •§ 4. Закон и.М. Сеченова
- •§ 5. Осмос и осмотическое давление
- •§ 6. Закон вант-гоффа
- •§ 7. Роль осмоса и осмотического давления в биологических системах. Плазмолиз и гемолиз
- •§ 8. Коллигативные свойства растворов
- •1. Коллигативные свойства ионных растворов
- •2. Понижение давления насыщенного пара растворителя над раствором
- •3. Понижение температуры замерзания растворов
- •4. Повышение температуры кипения растворов
- •5. Взаимосвязь между коллигативными свойствами растворов и осмотическим давлением. Определение осмотического давления криоскопическим методом
- •6. Применение криоскопии и эбуллиоскопии
- •§ 9. Экспериментальная часть
- •§ 10. Обучающе-контролирующие тесты
- •1. Укажите 4 характерных признака явления осмоса:
- •2. Укажите 3 фактора, от которых зависит величина осмотического давления:
- •3. Укажите 3 зависимости, выражающие закон Вант-Гоффа:
- •4. Выберите 3 ответа, формулирующие закон Вант-Гоффа:
- •5. Укажите 4 характеристики явления гемолиза в организме:
- •6. Укажите 4 характеристики явления плазмолиза в организме:
- •7. Выберите 3 формулировки изотонического, гипотонического и гипертонического растворов:
- •8. Укажите 4 фактора, объясняющие суть закона Рауля:
- •9. Выберите 5 правильных ответов, характеризующих законы криоскопии и эбуллиоскопии:
- •10. Выберите 3 ответа, характеризующие изотонический коэффициент:
- •11. Выберите 3 физических свойства разбавленных растворов, зависящие от концентрации растворенных веществ в растворе:
- •12. Назовите 3 условия, при которых происходит явление осмоса:
- •Глава II. Электрохимия
- •§ 1. Электропроводимость растворов электролитов. Кондуктометрическое титрование
- •Удельное сопротивление ряда биологических Жидкостей
- •Предельная молярная электропроводимость ионов в воде (18 °c)
- •§ 2. Потенциалы и электродвижущие силы
- •Некоторые стандартные потенциалы восстановления
- •Стандартные окислительно-восстановительные потенциалы
- •§ 3. Гальванические элементы
- •§ 4. Типы электродов
- •§ 5. Электрохимия в медицине
- •§ 6. Экспериментальная часть
- •Вопрос 1. Почему при бесконечном разведении раствора скорости движения различных ионов не будут зависеть друг от друга?
- •§ 7. Потенциометрия. Потенциометрическое титрование
- •Потенциалы электродов сравнения при различных температурах
- •§ 8. Экспериментальная часть
- •Метод «круглого стола»
- •§ 8. Обучающе-контролирующие тесты
- •1. Укажите 5 ответов, дающих характеристику электропроводимости:
- •16. Выберите 4 ответа, отражающие изменения кривой кондуктометрического титрования сильной кислоты сильным основанием:
- •17. Выберите 4 ответа, отражающие изменения кривой кондуктометрического титрования слабой кислоты сильным основанием:
- •18. Выберите 4 ответа, отражающие изменения кривой при титровании смеси сильной и слабой кислот:
- •19. Укажите 4 ответа с данными об электропроводимости биологических жидкостей при различных заболеваниях:
- •20. Укажите 3 ответа со значениями электропроводности при различном состоянии кислотности в желудке:
- •21. Укажите 5 видов и характеристику потенциалов, возникающих на границах раздела фаз:
- •36. Укажите 4 типа электродов и их правильные характеристики:
- •Коллоидная химия
- •Глава III. Физико-химия поверхностных явлений
- •§ I. Поверхностные явления и их значение в биологии и медицине
- •§ 2. Поверхностная энергия и поверхностное натяжение
- •Поверхностное натяжение некоторых веществ в жидком состоянии на границе с воздухом или паром
- •§ 3. Адсорбция и поверхностное натяжение
- •§ 4. Поверхностно-активные и поверхностно- инактивные вещества
- •§ 5. Изотермы поверхностного натяжения
- •§ 6. Адсорбция на границе раздела жидкость – газ и жидкость – жидкость
- •§ 7. Адсорбция на границе раздела твердое тело – газ и твердое тело – жидкость (раствор)
- •§ 8. Ориентация молекул в поверхностном слое и структура биологических мембран
- •§ 9. Адсорбция из растворов электролитов
- •§ 10. Хроматография, ее сущность и применение в биологии и медицине
- •§ 11. Экспериментальная часть
- •Задания для самостоятельной работы
- •Конкурс «кот в мешке»
- •§ 12. Обучающе-контролирующие тесты
- •7. Укажите 3 ответа, поясняющие уравнение Фрейндлиха:
- •8. Укажите 4 ответа, поясняющие уравнение Ленгмюра:
- •9. Укажите 3 ответа с правильной характеристикой трех частей изотермы адсорбции Ленгмюра:
- •10. Укажите 3 операции, проводимые при определении величины адсорбции на твердой поверхности:
- •11. Выберите 5 характеристик гидрофильности или гидрофобности некоторых видов поверхности:
- •12. Выберите 3 правила, которым подчиняется адсорбция растворенного вещества на твердой поверхности:
- •13. Укажите 5 примеров молекулярной и ионной адсорбции на угле:
- •24. Укажите 3 фактора, от которых зависит адсорбция газов твердым адсорбентом:
- •25. Укажите 3 фактора, от которых зависит адсорбция на границе твердое тело – раствор.
- •Глава IV. Физико-химия дисперсных систем
- •§ 1. Дисперсные системы и их классификация
- •Изменение удельной поверхности при дроблении
- •1 См3 вещества
- •Классификация систем по степени дисперсности
- •Классификация дисперсных систем по агрегатном состоянию дисперсной фазы и дисперсионной среды
- •§ 2. Коллоидное состояние. Методы получения и очистки коллоидных растворов
- •Диспергирование Конденсация
- •§ 3. Молекулярно-кинетические свойства коллоидных систем
- •§ 4. Оптические свойства коллоидных систем
- •§ 5. Классификация коллоидных систем
- •§ 6. Возникновение двойного электрического слоя и его строение
- •§ 7. Строение коллоидных частиц
- •§ 8. Электрокинетическне явления. Электрофорез и использование его в медицине
- •§ 9. Устойчивость коллоидных систем
- •Коагуляция золей As2s3 и Fe(oh)3 электролитами
- •§ 10. Пептизация. Коллоидная защита
- •§ 11. Аэрозоли и их Практическое Значение
- •§ 12. Суспензии, методы их получения и свойства
- •§ 13. Эмульсии, методы их получения и свойства
- •§ 14. Коллоидные поверхностно-активные вещества (пав)
- •§ 15. Экспериментальная часть
- •§ 16. Обучающе-контролирующие тесты
- •1. Укажите 4 характеристики состава и свойств дисперсных систем:
- •2. Укажите 3 типа дисперсных систем согласно классификации по размеру частиц:
- •19. Укажите 4 характеристики поверхностно-активных и поверхностно-инактивных веществ.
- •20. Физическая и коллоидная химия. Под ред. А.П. Беляева. Изд. Группа «гэотар-Медиа», – м.:, 2010. Оглавление
- •Коллоидная химия
- •Сталина Салиховна касымова физическая и коллоидная химия
§ 13. Эмульсии, методы их получения и свойства
Эмульсиями называются дисперсные системы, состоящие из двух взаимно нерастворимых жидкостей. В таких системах одна из жидкостей (дисперсная фаза) взвешена в другой (дисперсионной среде) в виде капелек. При этом отдельные капельки одной из них окружены сплошной средой другой жидкости (рис. 22). Радиус взвешенных частиц находится в пределах 10–5–10–3 см. Примерами эмульсий могут служить молоко, сливочное масло, латексы, кровь, лимфа, природная нефть, кремы, мази, эмульсии, применяемые в парфюмерии, распыляемые смеси для борьбы с вредителями растений, лекарственные составы и т.д. Эмульсии классифицируются по характеру дисперсной фазы и дисперсионной среды и по концентрации дисперсной фазы. Эмульсия образована из трудно или мало взаимно растворимых жидкостей, сильно отличающихся по типу внутримолекулярной связи. Если дисперсионная среда состоит из полярных молекул (вода), а дисперсная фаза из неполярных или слабо полярных молекул, которая по отношению к воде выступает как «масло». Под «маслом» следует понимать любую неполярную жидкость независимо от ее химического состава. Это может быть и действительно масло, а также бензол, хлороформ, керосин, толуол и др.
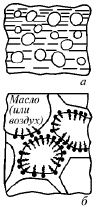
Рис. 22. Схема строения эмульсий (А) и высококонцентрированных эмульсий и пен (Б)
Получают эмульсии механическим диспергированием (эмульгированием) одной жидкости в другой. Диспергирование производят встряхиванием, взбалтыванием, действием ультразвука, разбиванием смеси в аппаратах различных конструкций, а также выдавливанием вещества дисперсной фазы через тонкие отверстия в дисперсионную среду под большим давлением. Кроме того, существуют методы замены растворителя и взаимной конденсации паров. Эмульсии – седиментационно неустойчивые системы. Если дисперсная фаза и дисперсионная среда отличаются по плотности, то возможна седиментация (или всплывание) капелек дисперсной фазы, т.е. нарушение однородности концентрации.
Эмульсии агрегативно неустойчивы, т.е. обладают большой поверхностью раздела. Капельки могут самопроизвольно слипаться друг с другом (коалесценция). Процесс этот протекает медленно, но в пределе он может привести к полному разрушению эмульсии и расслоению жидкостей, т.е. происходит процесс деэмульгирования. Для устойчивости эмульсий в систему прибавляют так называемые стабилизаторы или эмульгаторы, которые адсорбируясь на поверхности раздела двух фаз (масло-вода), уменьшают поверхностное натяжение на ней, т.е. должны быть поверхностно-активными веществами. Помимо этого эмульгатор, концентрируясь на поверхности капелек дисперсной фазы, должен образовывать механически прочный слой (пленку), который препятствует их агрегированию, т.е. предотвращает коалесценцию.
Действие эмульгатора избирательно, поэтому для каждой системы его находят экспериментальным путем. Эмульгаторы, лучше растворимые в воде, способствуют образованию прямых эмульсий (м/в). Эмульгаторы, лучше растворимые в неполярных жидкостях, дают обратные эмульсии (в/м). При правильно подобранном эмульгаторе можно приготовить эмульсию с очень высокой концентрацией дисперсной фазы. Например, в 1 % растворе олеата натрия C17H33COONa может быть получена 99 %-ная эмульсия (м/в) бензола. Эмульгатор должен быть подобен той жидкости, которая образует дисперсионную среду. Стабилизация эмульсии типа м/в производится растворимыми в воде высокомолекулярными соединениями, например, белками или водорастворимыми гидрофильными мылами (мылами щелочных металлов), а стабилизация эмульсий типа в/м – нерастворимыми в воде высокомолекулярными веществами, которые, однако, хорошо растворимы в углеводородах (каучук, смолы и др.), а также нерастворимыми в воде мылами многовалентных металлов (магниевые, кальциевые, алюминиевые мыла). Молекулы эмульгатора, содержащие полярные и неполярные группы (мыла, белки), в адсорбционных слоях полярными концами ориентируются к полярной жидкости, а неполярными концами – к неполярной. На рис. 23 показана различная ориентация молекул таких эмульгаторов на поверхности капелек жидкости в эмульсиях типа м/в и в/м. При наличии на поверхности капелек оболочек из ПАВ, показанных на рисунке, эмульсии приобретают устойчивость.
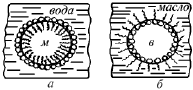
Рис. 23. Схема расположения дифильных молекул эмульгатора
на поверхности капель эмульсии типа: а – м /в; б – в/м
Механически прочные защитные пленки на межфазной границе жидкостей в ряде случаев образуются частицами высокодисперсных твердых порошков, называемых твердыми эмульгаторами. Твердые порошки избирательно смачиваются теми жидкостями, которые составляют эмульсию, т.е. они проявляют себя как гидрофильные или гидрофобные вещества (рис. 24). Частицы глины, мыла, гипса, стеклянного порошка, смачиваемые водой, являются гидрофильными эмульгаторами и стабилизируют эмульсии типа м/в. Частицы сажи, сульфидов (PbS, HgS), иодидов (PbI2, HgI2) смачиваются маслом, но водой не смачиваются, являются гидрофобными эмульгаторами и стабилизируют эмульсии типа в/м.
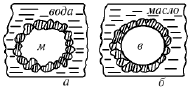
Рис. 24. Схема расположения частиц твердого эмульгатора на поверхности капель
эмульсии типа:
а – м/в, порошок гидрофилен; б – в/м, порошок гидрофобен
Часто возникает необходимость разрушить эмульсию и выделить ее составные части. Так, например, сырая нефть в момент выхода на поверхность земли содержит воду и является эмульсией типа в/м. Вода является нежелательным компонентом, поэтому эмульсию разрушают действием электрического поля или центрифугированием до остаточного содержания воды 1 %. В некоторых случаях разрушение эмульсии можно вызвать нагреванием. В этом случае происходит десорбция эмульгатора с поверхности капелек или растворение его в дисперсной фазе. Разрушить эмульсии можно и механическим путем – сбиванием, центрифугированием, фильтрованием, прибавлением электролита, изменяющего природу эмульгатора. Разрушением эмульсий пользуются при необходимости тщательной очистки сточных вод.
Эмульсии широко распространены в природе и имеют большое практическое значение. К эмульсиям относятся молоко, сливки, майонезы, маргарин, яичный желток, природная нефть и др. Основные физиологические жидкости – кровь, лимфа являются эмульсиями. Дисперсную фазу в крови представляют эритроциты. Благодаря наличию адсорбированных на поверхности белков, аминокислот и ионов электролитов, эритроциты имеют некоторый отрицательный заряд, что определяет устойчивость эмульсии. При патологических воспалительных процессах в организме увеличивается содержание некоторых видов белков, которые адсорбируются на поверхности эритроцитов, снижая заряд частиц. В результате усиливается скорость оседания эритроцитов (реакция оседания эритроцитов – РОЭ). Велико значение эмульсии в жизни человека. Необходимой составной частью питания являются жиры, но они нерастворимы в водной среде, являющейся основой жизнедеятельности организма. Поэтому организм хорошо усваивает только эмульгированные жиры: молоко, сливки, сметану, сливочное масло, а такие жиры, как растительное масло, животный жир переводятся в эмульгированное состояние сначала в желудке, затем в двенадцатиперстной кишке, куда поступает желчь, содержащая холевые кислоты, и только после этого усваивается организмом. Соли холевых кислот, образующиеся в верхнем отделе кишечника при значениях рН = 8,0–8,5, являются хорошими эмульгаторами. Перистальтические движения кишечника производят диспергирующее действие, при котором получается высокодисперсная прямая эмульсия. Она всасывается через стенки тонких кишок и поступает в лимфу и кровь.
В организме жиры и липоиды переносятся кровью в виде эмульсий и комплексов с -глобулином (хиломикронные эмульсии), обеспечивая жировое питание. Целесообразно использовать прямые эмульсии при введении вещества в организм per os (через рот) и обратные эмульсии (втирания, мази) – при введении лекарственных препаратов per cutarum (через кожу), так как кожа непроницаема для воды и растворимых в ней препаратов.
В фармацевтической промышленности многие лекарственные вещества применяются в виде эмульсий, причем обычно эмульсии м/в используются в составе лекарств для внутреннего употребления, а эмульсии типа в/м – для наружных средств. Эмульгированием устраняют или ослабляют неприятный вкус масел и смол, например, в эмульсиях рыбьего жира, касторового масла и др. Эмульгаторами служат крахмальный клейстер, яичный желток, желатина, декстрин и др. Эмульсиями являются медицинские минеральные масла, бактерицидные эмульсии в/м с 97 % растительного масла для лечения тепловых ожогов, различные эмульсионные мази, пасты и т.д.
В настоящее время ведутся широкие исследования по созданию жировых эмульсий для парантерального энергетического обеспечения голодающего или ослабленного организма путем внутривенного вливания. Жировые эмульсии должны иметь достаточно высокую концентрацию и степень дисперсности, обладать устойчивостью и не быть токсичными. Чаще всего для получения эмульсии используется хлопковое, соевое, оливковое и некоторые другие масла. Эмульгаторами служат фосфатиды и синтетические ПАВ. Концентрация эмульсий составляет 10–20 %, содержание эмульгатора не более 1,5 %.
