
- •5720100 – Лечебное дело
- •Isbn 978-9943-05-412-7
- •Предисловие
- •Глава I. Учение о растворах
- •§ 1. Роль растворов в жизнедеятельности организмов. Вода как растворитель
- •§ 2. Растворимость газов в жидкостях
- •§ 3. Кессонная болезнь
- •§ 4. Закон и.М. Сеченова
- •§ 5. Осмос и осмотическое давление
- •§ 6. Закон вант-гоффа
- •§ 7. Роль осмоса и осмотического давления в биологических системах. Плазмолиз и гемолиз
- •§ 8. Коллигативные свойства растворов
- •1. Коллигативные свойства ионных растворов
- •2. Понижение давления насыщенного пара растворителя над раствором
- •3. Понижение температуры замерзания растворов
- •4. Повышение температуры кипения растворов
- •5. Взаимосвязь между коллигативными свойствами растворов и осмотическим давлением. Определение осмотического давления криоскопическим методом
- •6. Применение криоскопии и эбуллиоскопии
- •§ 9. Экспериментальная часть
- •§ 10. Обучающе-контролирующие тесты
- •1. Укажите 4 характерных признака явления осмоса:
- •2. Укажите 3 фактора, от которых зависит величина осмотического давления:
- •3. Укажите 3 зависимости, выражающие закон Вант-Гоффа:
- •4. Выберите 3 ответа, формулирующие закон Вант-Гоффа:
- •5. Укажите 4 характеристики явления гемолиза в организме:
- •6. Укажите 4 характеристики явления плазмолиза в организме:
- •7. Выберите 3 формулировки изотонического, гипотонического и гипертонического растворов:
- •8. Укажите 4 фактора, объясняющие суть закона Рауля:
- •9. Выберите 5 правильных ответов, характеризующих законы криоскопии и эбуллиоскопии:
- •10. Выберите 3 ответа, характеризующие изотонический коэффициент:
- •11. Выберите 3 физических свойства разбавленных растворов, зависящие от концентрации растворенных веществ в растворе:
- •12. Назовите 3 условия, при которых происходит явление осмоса:
- •Глава II. Электрохимия
- •§ 1. Электропроводимость растворов электролитов. Кондуктометрическое титрование
- •Удельное сопротивление ряда биологических Жидкостей
- •Предельная молярная электропроводимость ионов в воде (18 °c)
- •§ 2. Потенциалы и электродвижущие силы
- •Некоторые стандартные потенциалы восстановления
- •Стандартные окислительно-восстановительные потенциалы
- •§ 3. Гальванические элементы
- •§ 4. Типы электродов
- •§ 5. Электрохимия в медицине
- •§ 6. Экспериментальная часть
- •Вопрос 1. Почему при бесконечном разведении раствора скорости движения различных ионов не будут зависеть друг от друга?
- •§ 7. Потенциометрия. Потенциометрическое титрование
- •Потенциалы электродов сравнения при различных температурах
- •§ 8. Экспериментальная часть
- •Метод «круглого стола»
- •§ 8. Обучающе-контролирующие тесты
- •1. Укажите 5 ответов, дающих характеристику электропроводимости:
- •16. Выберите 4 ответа, отражающие изменения кривой кондуктометрического титрования сильной кислоты сильным основанием:
- •17. Выберите 4 ответа, отражающие изменения кривой кондуктометрического титрования слабой кислоты сильным основанием:
- •18. Выберите 4 ответа, отражающие изменения кривой при титровании смеси сильной и слабой кислот:
- •19. Укажите 4 ответа с данными об электропроводимости биологических жидкостей при различных заболеваниях:
- •20. Укажите 3 ответа со значениями электропроводности при различном состоянии кислотности в желудке:
- •21. Укажите 5 видов и характеристику потенциалов, возникающих на границах раздела фаз:
- •36. Укажите 4 типа электродов и их правильные характеристики:
- •Коллоидная химия
- •Глава III. Физико-химия поверхностных явлений
- •§ I. Поверхностные явления и их значение в биологии и медицине
- •§ 2. Поверхностная энергия и поверхностное натяжение
- •Поверхностное натяжение некоторых веществ в жидком состоянии на границе с воздухом или паром
- •§ 3. Адсорбция и поверхностное натяжение
- •§ 4. Поверхностно-активные и поверхностно- инактивные вещества
- •§ 5. Изотермы поверхностного натяжения
- •§ 6. Адсорбция на границе раздела жидкость – газ и жидкость – жидкость
- •§ 7. Адсорбция на границе раздела твердое тело – газ и твердое тело – жидкость (раствор)
- •§ 8. Ориентация молекул в поверхностном слое и структура биологических мембран
- •§ 9. Адсорбция из растворов электролитов
- •§ 10. Хроматография, ее сущность и применение в биологии и медицине
- •§ 11. Экспериментальная часть
- •Задания для самостоятельной работы
- •Конкурс «кот в мешке»
- •§ 12. Обучающе-контролирующие тесты
- •7. Укажите 3 ответа, поясняющие уравнение Фрейндлиха:
- •8. Укажите 4 ответа, поясняющие уравнение Ленгмюра:
- •9. Укажите 3 ответа с правильной характеристикой трех частей изотермы адсорбции Ленгмюра:
- •10. Укажите 3 операции, проводимые при определении величины адсорбции на твердой поверхности:
- •11. Выберите 5 характеристик гидрофильности или гидрофобности некоторых видов поверхности:
- •12. Выберите 3 правила, которым подчиняется адсорбция растворенного вещества на твердой поверхности:
- •13. Укажите 5 примеров молекулярной и ионной адсорбции на угле:
- •24. Укажите 3 фактора, от которых зависит адсорбция газов твердым адсорбентом:
- •25. Укажите 3 фактора, от которых зависит адсорбция на границе твердое тело – раствор.
- •Глава IV. Физико-химия дисперсных систем
- •§ 1. Дисперсные системы и их классификация
- •Изменение удельной поверхности при дроблении
- •1 См3 вещества
- •Классификация систем по степени дисперсности
- •Классификация дисперсных систем по агрегатном состоянию дисперсной фазы и дисперсионной среды
- •§ 2. Коллоидное состояние. Методы получения и очистки коллоидных растворов
- •Диспергирование Конденсация
- •§ 3. Молекулярно-кинетические свойства коллоидных систем
- •§ 4. Оптические свойства коллоидных систем
- •§ 5. Классификация коллоидных систем
- •§ 6. Возникновение двойного электрического слоя и его строение
- •§ 7. Строение коллоидных частиц
- •§ 8. Электрокинетическне явления. Электрофорез и использование его в медицине
- •§ 9. Устойчивость коллоидных систем
- •Коагуляция золей As2s3 и Fe(oh)3 электролитами
- •§ 10. Пептизация. Коллоидная защита
- •§ 11. Аэрозоли и их Практическое Значение
- •§ 12. Суспензии, методы их получения и свойства
- •§ 13. Эмульсии, методы их получения и свойства
- •§ 14. Коллоидные поверхностно-активные вещества (пав)
- •§ 15. Экспериментальная часть
- •§ 16. Обучающе-контролирующие тесты
- •1. Укажите 4 характеристики состава и свойств дисперсных систем:
- •2. Укажите 3 типа дисперсных систем согласно классификации по размеру частиц:
- •19. Укажите 4 характеристики поверхностно-активных и поверхностно-инактивных веществ.
- •20. Физическая и коллоидная химия. Под ред. А.П. Беляева. Изд. Группа «гэотар-Медиа», – м.:, 2010. Оглавление
- •Коллоидная химия
- •Сталина Салиховна касымова физическая и коллоидная химия
§ 8. Электрокинетическне явления. Электрофорез и использование его в медицине
Рассмотренные выше примеры строения мицелл помогают наглядно представить движение коллоидных частиц при пропускании постоянного тока через коллоидный раствор. При этом к электродам движутся не мицеллы, которые электронейтральны, а только гранулы. К электрокинетическим явлениям обычно относят электрические явления, связанные с перемещением раствора относительно заряженной поверхности твердой фазы. При движении жидкости относительно твердой поверхности на границе между адсорбционным и диффузным слоями возникает электрокинетический потенциал (или -потенциал), определяющий скорость перемещения фаз и имеющий большое значение при характеристике коллоидных систем, в частности их устойчивости. К электрокинетическим явлениям относятся электроосмос, электроосмотическое давление, электрофорез, потенциал течения и потенциал седиментации. Причиной всех этих явлений оказывается потенциал, соответствующий диффузной части двойного слоя.
Электрокинетические явления в частности электрофорез и электроосмос были открыты в 1808 г. профессором Московского университета Ф.Ф. Рейсом. При электрофорезе коллоидные частицы дисперсной фазы под действием постоянного электрического тока двигаются к противоположно заряженному электроду. Таким образом, электрофорез – движение коллоидных частиц в электрическом поле. Электрофорез можно изучать на простом приборе (рис. 14).
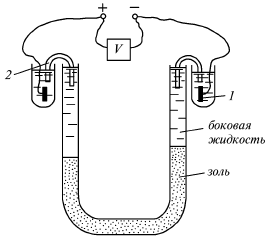
Рис.14. Схема устройства для изучения электрофореза.
1 – электрод, 2 – солевой мостик
Через коллоидный раствор в U-образной трубке пропускается постоянный электрический ток, и гранулы начинают перемещаться к противоположно заряженному электроду, а противоионы – к другому электроду. Перемещаясь в электрическом поле, гранула увлекает за собой адсорбционный слой жидкости с содержащимися в нем противоионами, которые нейтрализуют часть заряда поверхности. Избыток эяряда, мерой которого является -потенциал, влияет на скорость и направление движения частицы в электрическом поле. Чем больше толщина двойного электрического слоя, тем больше электрофоретическая скорость частиц и -потенциал. Наблюдая за движением частиц с помощью ультрамикроскопа, можно экспериментально найти скорость частиц при электрофорезе U по формуле Г. Гельмгольца-М. Смолуховского:
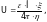 (1)
(1)
где – диэлектрическая проницаемость;
– вязкость среды;
Н – градиент потенциала,
Н
= Е/
 (Е
– величина внешней ЭДС;
(Е
– величина внешней ЭДС;
– расстояние между электродами).
Скорость электрофоретического переноса обычно относят к единице приложенного потенциала, поэтому обе части уравнения делим на Н:
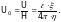 (2)
(2)
Величина U0 обычно служит для сравнения способности к электрофорезу различных коллоидных систем и называется электрофоретической подвижностью. Далее из уравнения (2) можно найти потенциал:
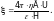 (3)
(3)
Большинство биологических полимеров содержат заряженные группы, поэтому они способны двигаться в электрическом поле. Скорость перемещения макромолекул в электрическом поле является их полезной характеристикой. Это свойство можно использовать для определения молекулярной массы белков, для различия макромолекул на основе их общего заряда или формы, для определения изменений в аминокислотном составе при замене заряженной аминокислоты на незаряженную и наоборот, а также для количественного разделения на фракции таких сложных систем, как белки и другие высокомолекулярные электролиты. Широкое применение электрофорез находит в биохимии: он служит для идентификации отдельных белков в смесях и носит название иммуноэлектрофореза – новый высокочувствительный метод. Известно, что каждый белок имеет свою уникальную структуру и это определяет специфичность его антигенного состава. Наиболее точным способом выявления антигенов является их способность взаимодействовать с антителами, т.е. веществами белковой природы, которые образуются в организме в ответ на введение антигена. После взаимодействия антитела со «своим» антигеном образуется видимый на глаз преципитат, состоящий из комплексов антиген – антитело. Иммуноэлектрофорез проводится в два этапа. На первом этапе выполняется электрофорез смеси белков, например, сыворотки крови, мочи, молока и др. В результате на электрофореграмме белки распределяются по группам в зависимости от их заряда. На втором этапе электрофореграмма обрабатывается смесью антител, направленных против отдельных белков изучаемого материала. В результате образуются зоны преципитации комплексов антитело – антиген. Их число характеризует количество белков, составляющих исходный материал (рис.15).
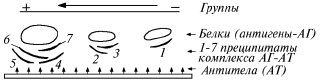
Рис.15. Принцип иммуноэлектрофореза
Иммуноэлектрофорез используют для целей диагностики, в судебной медицине для анализа трупного материала и в научно-исследовательской работе. Он служит основным методом идентификации белков, содержащихся в сложных смесях и незаменим при контроле за качеством очистки белковых препаратов.
Явление, обратное электрофорезу (возникновение разности потенциалов на электродах, расположенных на разной высоте в сосуде, где происходит оседание дисперсных частиц), назвали потенциалом оседания (или седиментации). Его обнаружил Дорн в 1880 г. На рис. 16 показана схема устройства для изучения потенциала оседания, который трудно поддается количественному изучению, так как возникающая разность потенциалов очень мала.
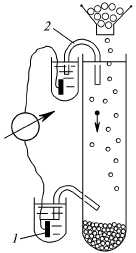
Рис. 16. Схема устройства для изучения потенциала оседания.
1 – электрод; 2 – солевой мостик
Явление переноса жидкости под действием внешнего электрического поля, наблюдаемое в капиллярно-пористых телах и одиноких капиллярах, называется электроосмосом. В этом случае двойной электрический слой образуется на внутренней поверхности капилляров пористого тела в результате избирательной адсорбции одного из ионов электролита, присутствующего в жидкости, заполняющей капилляр. На рис.17 изображен двойной электрический слой, образовавшийся в капилляре. Условно принято, что потенциалопределяющие ионы заряжены отрицательно, а противоионы – положительно.
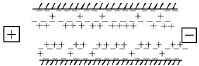
Рис. 17. Схема движения жидкости и
противоионов при электоосмосе
При приложении на капилляр электрического поля (рис. 18) слой противоионов (диффузная часть двойного слоя) в капилляре будет перемещаться к катоду, увлекая за собой вследствие силы трения и молекулярного сцепления всю массу жидкости, которая заполняет капилляры. При этом возникает – потенциал, определяемый как разность потенциалов между подвижной (диффузной) и неподвижной частями двойного электрического слоя.
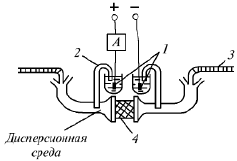
Рис. 18. Схема устройства для изучения электроосмоса.
1 – электрод; 2 – солевой мостик; 3 – капиллярная трубка;
4 – пористая диафрагма.
Явление, обратное электроосмосу, – возникновение разности потенциалов между концами одиночного капилляра при протекании через него раствора под давлением – называется потенциалом течения (протекания) (рис. 19). Это явление впервые обнаружил Г. Квинке в 1859 г. Изучение потенциала протекания представляет интерес для понимания некоторых процессов в биологических системах, так как причиной возникновения биопотенциалов может служить перемещение ионов с жидкостью в организме.
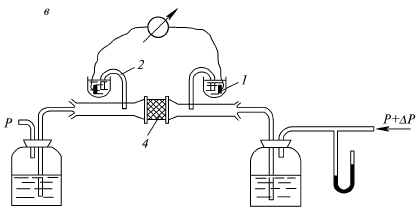
Рис. 19. Схема устройства для изучения потенциала протекания.
1 – электрод; 2 – солевой мостик; 3 – капиллярная трубка;
4 – пористая диафрагма
