
- •5720100 – Лечебное дело
- •Isbn 978-9943-05-412-7
- •Предисловие
- •Глава I. Учение о растворах
- •§ 1. Роль растворов в жизнедеятельности организмов. Вода как растворитель
- •§ 2. Растворимость газов в жидкостях
- •§ 3. Кессонная болезнь
- •§ 4. Закон и.М. Сеченова
- •§ 5. Осмос и осмотическое давление
- •§ 6. Закон вант-гоффа
- •§ 7. Роль осмоса и осмотического давления в биологических системах. Плазмолиз и гемолиз
- •§ 8. Коллигативные свойства растворов
- •1. Коллигативные свойства ионных растворов
- •2. Понижение давления насыщенного пара растворителя над раствором
- •3. Понижение температуры замерзания растворов
- •4. Повышение температуры кипения растворов
- •5. Взаимосвязь между коллигативными свойствами растворов и осмотическим давлением. Определение осмотического давления криоскопическим методом
- •6. Применение криоскопии и эбуллиоскопии
- •§ 9. Экспериментальная часть
- •§ 10. Обучающе-контролирующие тесты
- •1. Укажите 4 характерных признака явления осмоса:
- •2. Укажите 3 фактора, от которых зависит величина осмотического давления:
- •3. Укажите 3 зависимости, выражающие закон Вант-Гоффа:
- •4. Выберите 3 ответа, формулирующие закон Вант-Гоффа:
- •5. Укажите 4 характеристики явления гемолиза в организме:
- •6. Укажите 4 характеристики явления плазмолиза в организме:
- •7. Выберите 3 формулировки изотонического, гипотонического и гипертонического растворов:
- •8. Укажите 4 фактора, объясняющие суть закона Рауля:
- •9. Выберите 5 правильных ответов, характеризующих законы криоскопии и эбуллиоскопии:
- •10. Выберите 3 ответа, характеризующие изотонический коэффициент:
- •11. Выберите 3 физических свойства разбавленных растворов, зависящие от концентрации растворенных веществ в растворе:
- •12. Назовите 3 условия, при которых происходит явление осмоса:
- •Глава II. Электрохимия
- •§ 1. Электропроводимость растворов электролитов. Кондуктометрическое титрование
- •Удельное сопротивление ряда биологических Жидкостей
- •Предельная молярная электропроводимость ионов в воде (18 °c)
- •§ 2. Потенциалы и электродвижущие силы
- •Некоторые стандартные потенциалы восстановления
- •Стандартные окислительно-восстановительные потенциалы
- •§ 3. Гальванические элементы
- •§ 4. Типы электродов
- •§ 5. Электрохимия в медицине
- •§ 6. Экспериментальная часть
- •Вопрос 1. Почему при бесконечном разведении раствора скорости движения различных ионов не будут зависеть друг от друга?
- •§ 7. Потенциометрия. Потенциометрическое титрование
- •Потенциалы электродов сравнения при различных температурах
- •§ 8. Экспериментальная часть
- •Метод «круглого стола»
- •§ 8. Обучающе-контролирующие тесты
- •1. Укажите 5 ответов, дающих характеристику электропроводимости:
- •16. Выберите 4 ответа, отражающие изменения кривой кондуктометрического титрования сильной кислоты сильным основанием:
- •17. Выберите 4 ответа, отражающие изменения кривой кондуктометрического титрования слабой кислоты сильным основанием:
- •18. Выберите 4 ответа, отражающие изменения кривой при титровании смеси сильной и слабой кислот:
- •19. Укажите 4 ответа с данными об электропроводимости биологических жидкостей при различных заболеваниях:
- •20. Укажите 3 ответа со значениями электропроводности при различном состоянии кислотности в желудке:
- •21. Укажите 5 видов и характеристику потенциалов, возникающих на границах раздела фаз:
- •36. Укажите 4 типа электродов и их правильные характеристики:
- •Коллоидная химия
- •Глава III. Физико-химия поверхностных явлений
- •§ I. Поверхностные явления и их значение в биологии и медицине
- •§ 2. Поверхностная энергия и поверхностное натяжение
- •Поверхностное натяжение некоторых веществ в жидком состоянии на границе с воздухом или паром
- •§ 3. Адсорбция и поверхностное натяжение
- •§ 4. Поверхностно-активные и поверхностно- инактивные вещества
- •§ 5. Изотермы поверхностного натяжения
- •§ 6. Адсорбция на границе раздела жидкость – газ и жидкость – жидкость
- •§ 7. Адсорбция на границе раздела твердое тело – газ и твердое тело – жидкость (раствор)
- •§ 8. Ориентация молекул в поверхностном слое и структура биологических мембран
- •§ 9. Адсорбция из растворов электролитов
- •§ 10. Хроматография, ее сущность и применение в биологии и медицине
- •§ 11. Экспериментальная часть
- •Задания для самостоятельной работы
- •Конкурс «кот в мешке»
- •§ 12. Обучающе-контролирующие тесты
- •7. Укажите 3 ответа, поясняющие уравнение Фрейндлиха:
- •8. Укажите 4 ответа, поясняющие уравнение Ленгмюра:
- •9. Укажите 3 ответа с правильной характеристикой трех частей изотермы адсорбции Ленгмюра:
- •10. Укажите 3 операции, проводимые при определении величины адсорбции на твердой поверхности:
- •11. Выберите 5 характеристик гидрофильности или гидрофобности некоторых видов поверхности:
- •12. Выберите 3 правила, которым подчиняется адсорбция растворенного вещества на твердой поверхности:
- •13. Укажите 5 примеров молекулярной и ионной адсорбции на угле:
- •24. Укажите 3 фактора, от которых зависит адсорбция газов твердым адсорбентом:
- •25. Укажите 3 фактора, от которых зависит адсорбция на границе твердое тело – раствор.
- •Глава IV. Физико-химия дисперсных систем
- •§ 1. Дисперсные системы и их классификация
- •Изменение удельной поверхности при дроблении
- •1 См3 вещества
- •Классификация систем по степени дисперсности
- •Классификация дисперсных систем по агрегатном состоянию дисперсной фазы и дисперсионной среды
- •§ 2. Коллоидное состояние. Методы получения и очистки коллоидных растворов
- •Диспергирование Конденсация
- •§ 3. Молекулярно-кинетические свойства коллоидных систем
- •§ 4. Оптические свойства коллоидных систем
- •§ 5. Классификация коллоидных систем
- •§ 6. Возникновение двойного электрического слоя и его строение
- •§ 7. Строение коллоидных частиц
- •§ 8. Электрокинетическне явления. Электрофорез и использование его в медицине
- •§ 9. Устойчивость коллоидных систем
- •Коагуляция золей As2s3 и Fe(oh)3 электролитами
- •§ 10. Пептизация. Коллоидная защита
- •§ 11. Аэрозоли и их Практическое Значение
- •§ 12. Суспензии, методы их получения и свойства
- •§ 13. Эмульсии, методы их получения и свойства
- •§ 14. Коллоидные поверхностно-активные вещества (пав)
- •§ 15. Экспериментальная часть
- •§ 16. Обучающе-контролирующие тесты
- •1. Укажите 4 характеристики состава и свойств дисперсных систем:
- •2. Укажите 3 типа дисперсных систем согласно классификации по размеру частиц:
- •19. Укажите 4 характеристики поверхностно-активных и поверхностно-инактивных веществ.
- •20. Физическая и коллоидная химия. Под ред. А.П. Беляева. Изд. Группа «гэотар-Медиа», – м.:, 2010. Оглавление
- •Коллоидная химия
- •Сталина Салиховна касымова физическая и коллоидная химия
§ 7. Строение коллоидных частиц
Коллоидные частицы в лиофобных золях обладают значительно большими размерами по сравнению с размерами частиц в истинных растворах и представляют собой сложные образования, практически нерастворимые в дисперсионной среде. Такие коллоидные частицы сорбируют на своей поверхности определенное количество частиц дисперсионной среды и называются мицеллами. В лиофобных золях обычно говорят о мицелле (дисперсная фаза золя) и интермицеллярной жидкости (дисперсионная среда этого же золя). Мицелла имеет сложное строение и состоит из внутренней и внешней сфер. Внутренняя сфера является нейтральной и называется ядром., внешняя сфера является ионогенной и состоит, в свою очередь, из двух слоев.
На рис.13 показана схема строения золя АgI, получаемого при некотором избытке КI и AgNO3 .
Рассмотрим образование золя АgI, который получается при взаимодействии очень разбавленных растворов AgNO3 и KI:
AgNO3 + KI = AgI + KNO3
золь
Устойчивый золь AgI может быть получен только при избытке одного из исходных веществ и при проведении реакции с очень разбавленными растворами. Только в этом случае осадок не выпадает и образуется коллоидный раствор AgI. Йодид калия KI способствует стабилизации коллоидных частиц AgI, т.е. является стабилизатором частиц AgI, препятствует сближению частиц и тем самым обусловливает устойчивость золя.
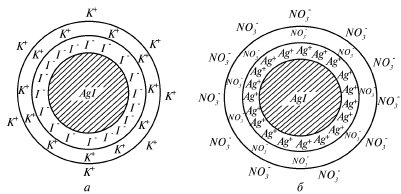
Рис. 13. Схема строения коллоидной мицеллы золя АgI:
а – получаемого при избытке КI; б – получаемого при избытке AgNO3
Основную массу мицеллы составляет вещество агрегата коллоидной частицы кристаллической или аморфной структуры, нерастворимое в дисперсионной среде. Агрегат мицеллы построен из нейтральных молекул или атомов. В данном случае агрегатом являются кристаллики AgI , состоящие из большого числа молекул: m[AgI] . Эти мельчайшие агрегаты являются зародышами более крупных коллоидных частиц, и так как агрегат является носителем свободной поверхностной энергии, то на его поверхности начинают адсорбироваться из раствора те частицы, которые входят в кристаллическую решетку AgI (правило Панета-Фаянса). В данном случае при избытке KI адсорбироваться будут ионы I–, которые достраивают кристаллическую решетку ядра, образуют адсорбционный слой и ядра заряжаются отрицательно: [AgI] nI– , что препятствует их соединению и укрупнению. Эти ионы являются потенциалоопределяющими. Противоположными по знаку потенциалоопределяющим ионам в растворе являются противоионы – катионы К+, электростатически притягивающиеся потенциалоопределяющими ионами адсорбционного слоя. Количество этих противоионов будет (п – х)K+. Ядро с адсорбционным слоем называется коллоидной частицей (или просто частицей) или гранулой:
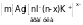
Оставшаяся часть противоионов располагается дальше от ядра и образует диффузный слой, который является подвижным и способен перемещаться относительно адсорбционного слоя. Толщина диффузного слоя может изменяться с изменением концентрации и зарядов ионов, имеющих противоположный знак по отношению к ядру. Противоионы адсорбционного и диффузного слоев находятся в состоянии подвижного равновесия. Ядро с адсорбционным и диффузным слоями называется мицеллой:
{m [AgI]nI-(n-x)K+}x- xK+
мицелла
Таким образом, для золя AgI при избытке KI формула мицеллы пишется следующим образом:
{m[AgI] nI- (n-x) K+}x- xK+
¬Агрегат® Aдсорбиро- Противоионы ад- Противоионы
ванные сорбционного диффузного
ионы слоя слоя
¬¾¾ Ядро ¾¾®
¬¾¾¾ Гранула ¾¾¾®
(коллоидная частица)
¬¾¾¾¾¾ Мицелла ¾¾¾¾¾®
Здесь m – число молекул йодида серебра в ядре;
n – число адсорбированных ионов;
(n – х) – число противоионов адсорбционного слоя;
х – число противоионов диффузного слоя. Значения m, n и х могут меняться в широких пределах в зависимости от условий приготовления, т.е. мицелла не имеет определенного состава.
Для золя AgI при избытке AgNO3 благодаря адсорбции ионов Аg+ на поверхности ядра, коллоидная частица заряжается положительно, и формула мицеллы запишется следующим образом:
{m[AgI]
nAg+
(n-x)
NO }x+
x
NO
}x+
x
NO
¬Агрегат® Aдсорбиро- Противоионы Противоионы
ванные адсорбционного диффузного
ионы слоя слоя
¬¾¾ Ядро ¾¾®
¬¾¾¾ Гранула ¾¾¾®
(коллоидная частица)
¬¾¾¾¾¾ Мицелла ¾¾¾¾¾®
В этом случае для мицеллы золя AgI стабилизатором является AgNO3.
Возможен случай, когда концентрации AgNO3 и KI равны, тогда формула мицеллы золя AgI имеет вид:
{m [AgI] nAg+ · n NO3-}0
Золь будет находиться в иэоэлектрическом состоянии, при котором -потенциал равен 0. В данном случае противоиоиы диффузного слоя полностью перешли в адсорбционный слой, и гранула оказывается лишенной заряда.
Это способствует сближению коллоидных частиц до таких расстояний, при которых силы межмолекулярного сцепления становятся больше электростатического отталкивания, и частицы начинают слипаться в более крупные агрегаты, т.е. система становится агрегативно неустойчивой, но коагуляция наступает не в иэоэлектрическом состоянии, а несколько раньше.
Рассмотрим образование золя гидроксида железа (III), полученного гидролизом FeCl3.
Реакция гидролиза протекает по уравнению:
FеСl3 + 3Н2О⇄ Fе(ОН)3+3НC1
Золь гидроксида
железа
Ионным стабилизатором для этого золя является FeOCl:
Fe(OH)3 + НС1 = FeOCl + 2H2O
FeOCl⇄ FeO+ + C1–
Агрегат мицеллы будет состоять из большого числа молекул Fe(OH)3, потенциалоопределяюцим ионом будет FeO+, так как ион С1- не входит в состав агрегата.
Тогда формула мицеллы золя Fe(OH)3 запишется следующим образом:
{ m[Fe(OH)3] × nFeO+ × (n-x)Cl- }x+ × xCl-
Агрегат Адсорбирован- Противоионы ад- Противоионы
ные ионы сорбционного диффузного
слоя слоя
¬¾¾ Ядро ¾¾®
¬¾¾¾ Гранула ¾¾¾®
(коллоидная частица)
¬¾¾¾¾¾¾¾ Мицелла ¾¾¾¾¾®
или формулой:
{ m[Fe(OH)3] nFe3+ 3 (n - x)Cl- }3x+ ×3xCl-
nFe Cl3 ¾® nFe3+ + 3nCl-
ионный
стабилизатор
Аналогичным образом можно написать формулу мицеллы золя сульфида мышьяка As2S3, который получают действием H2S на раствор мышьяковистой кислоты:
2H3AsO3 + 3H2S = As2S3 + 6H2O.
золь
Стабилизатором является H2S:
H2S⇄ H+ + HS-
Для получения Аs2S3 необходим избыток H2S, и гранула сульфида мышьяка заряжена всегда отрицательно.
{m [As2S3]nHS- ·(n – x)H+}x-· xH+.
Таким образом, мицелла – электрически нейтральная коллоидная частица, способная к самостоятельному существованию. От нее зависят все основные свойства коллоидной системы.
